Topping-off 技术防治椎间融合后邻近节段椎间盘退变实验研究
2018-03-01梁博徐建广
梁博 徐建广
椎间融合技术是治疗各种原因引起的腰椎不稳症最为有效的手术方法,随着内固定材料及腰椎外科技术的进步,患者术后往往能获得较高的融合率。然而融合术后随之而来的邻近节段过度活动及应力增加,易引起椎间盘的加速退变,而对于邻近节段已有退变的患者,若不对其加以保护,融合术后往往更易加速其退变进程,严重者甚至需要再次手术治疗[1-2]。因此,如何防治腰椎融合术后邻近节段退变业已成为腰椎外科领域的技术难题。文献报道棘突间动态内固定系统可以有效保留植入节段的活动度,降低后方关节突关节的应力,从而延缓椎间盘退变发生,降低再手术率[3-4]。Topping-off技术即在融合节段的邻近节段置入棘突间动态内固定系统,有效缓解了邻近节段的过度活动及应力增加[5-6]。然而 Topping-off 技术的合理性和适应证仍饱受质疑,尤其是缺乏系统科学的实验研究支持。笔者在建立比格犬腰椎间盘退变实验模型基础上,应用后路棘突间动态固定装置 Coflex 对椎间融合术后上位邻近退变节段椎间盘加以保护 ( Topping-off 技术 ),研究 Topping-off 技术对比格犬腰椎间盘的退变进程有无延缓和保护作用。
材料与方法
一、实验模型制作
选用 16 只健康成年比格犬 ( 由上海交通大学附属第六人民医院动物实验中心提供 ),性别不限,平均年龄 19 个月,体重 16.5~21.3 kg。所有犬术前均行腰椎 X 线片及 MRI 检查,确认实验犬无脊柱先天疾病与椎间盘退变情况。
术前晚禁食、备皮。用 2% ( 1 ml / kg ) 戊巴比妥静脉注射麻醉实验犬,俯卧位固定四肢,消毒铺巾,在 L5~6平面从棘突中线向右侧旁开 12 cm 为入针点,用穿刺针 ( 16 G ) 在 C 型臂机引导下经皮穿刺 L5~6椎间盘,深度控制在透视下正侧位均提示穿过对侧纤维环,建立腰椎间盘退变的动物模型[7]。用配对比较法将实验犬随机分为仅行椎间融合的对照组 ( n=8 ) 及椎间融合加相邻节段棘突间 Coflex 置入的实验组 ( n=8 ),具体为将 16 只犬中年龄、体重、性别基本相同的犬进行两两配对为 8 对,并将每对中的犬编号为 1 和 2,之后从随机数字表连续抄录 8 个数字,奇数则将 1 号入对照组,2 号入实验组,偶数则相反。对照组实验犬改为仰卧位,取腹直肌旁正中直切口长约 4~5 cm,经腹膜外显露L6~7椎间隙,取髂骨行椎间植骨融合术,术中 C 型臂机透视植骨位置满意后,逐层关闭切口;实验组犬行 Topping-off 技术,即在 L6~7椎间植骨融合基础上,改为俯卧位固定,做后正中切口长约 3~4 cm,仔细保留棘上韧带,彻底去除 L5~6棘间韧带,试模后置入大小合适的 Coflex 装置,棘突打孔后连同棘上韧带一并进行固定,C 型臂机术中透视 Coflex 位置满意后关闭皮肤切口。
术后每天青霉素 240 万单位静滴抗炎,共 3 天,采用笼养加放养相结合方式进行饲养,每天 2 次观察犬的切口情况及四肢活动情况,术后 2 周拆线,每月摄腰椎正侧位 X 线片一次,了解椎间植骨融合情况及 Coflex 位置,直至椎间骨性愈合。分别于术后 3、6 个月摄腰椎 MRI 检查后,L5~6椎间盘取材,每组每次 4 只,每个髓核分成 2 个标本,一个经普通固定溶液固定后,行 HE 染色及免疫组织化学测定,另一标本在 RNase-free 生理盐水中迅速漂洗,去除血渍和污物,再用包装样本专用的铝箔包好并记录编号,放入液氮罐保存,行分子生物学测定。
二、实验指标观察
1. 腰椎 MRI 检查:使用 Videman 法[8]对 L5~6椎间盘髓核腰椎 MRI T2加权图像进行半定量分析,具体评分标准:1 级:髓核无退变征象,显示为高强度信号 ( 0 分 );2 级:轻度退变,信号强度轻度降低 ( 1 分 );3 级:中度退变,信号强度中等降低( 2 分 );4 级:严重退变,信号缺失 ( 3 分 )。退变分数为髓核前、中、后 3 个部位分数之和,0 分无退变,9 分最严重。在此基础上,以相邻脑脊液为参考标准,髓核脑脊液信号强度比值作为校正值来定量分析退变程度。
2. II 型胶原阳性细胞数测定:免疫组织化学采用 EnVision 法检测纤维环组织中 II 型胶原的阳性细胞数,EnVision 法又称为 ELPS ( enhance labeled polymer system ) 法,抗原-抗体反应结合后,第二抗体上标记有多聚化合物 ( 葡聚糖 ) 酶复合物( EnVision 复合物 ),与第一抗体结合,进而由酶作用底物进行显色定位,用于比较实验组与对照组L5~6椎间盘组织中 II 型胶原阳性细胞数。
3. 分子生物学测定:采用聚合酶链反应 ( polymerase chain reaction,PCR ) 法测定髓核组织内基质金属蛋白酶阻滞剂-1 ( tissue inhibitor of metalloproteinase-1,TIMP-1 ),骨形态发生蛋白-15 ( bone morphogenetic protein-15,BMP-15 ) 及内参基因 GAPDH含量,通过 RNA 抽提、分光光度计检测 RNA 浓度、反转录、PCR 扩增以及免疫电泳等步骤,比较实验组与对照组 L5~6椎间盘髓核组织中 TIMP-1、BMP-15 及内参基因 GAPDH 含量。
三、统计学处理
采用 SPSS 17.0 软件进行统计学分析,计量资料以±s 表示,两组间比较采用独立样本 t 检验以检验显著性水平。P<0.05 为差异有统计学意义。
结 果
一、MRI 检查
MRI 示两组动物 L6~7节段均顺利融合。应用Videman 法对 L5~6椎间盘髓核腰椎 MRI T2加权图像进行半定量分析,术后 3 个月两组椎间盘髓核 MRI T2加权图像半定量值差异无统计学意义 ( P>0.05 ),说明两组退变速度相当,实验组病变髓核 3 个月与6 个月 MRI T2加权图像半定量值的差异无统计学意义 ( P>0.05 ),而对照组病变髓核 3 个月与 6 个月差异有统计学意义 ( P<0.05 ),对照组与实验组术后6 个月差异有统计学意义 ( P<0.05 ),说明 Coflex 动态稳定系统对椎间盘退变有一定保护作用 ( 表 1 )。
二、II 型胶原阳性细胞数测定
按免疫组织化学 EnVision 法检测纤维环组织中II 型胶原的阳性细胞数,术后 3 个月两组 COL-2 阳性细胞数差异无统计学意义 ( P>0.05 ),说明两组退变速度相当,实验组病变髓核 3 个月与 6 个月 COL-2阳性细胞含量的差异无统计学意义 ( P>0.05 ),而对照组病变髓核 3 个月与 6 个月差异有统计学意义( P<0.05 ),对照组与实验组术后 6 个月差异有统计学意义 ( P<0.05 ),说明 Coflex 动态稳定系统能椎间盘退变有一定保护作用 ( 表 2 )。
三、分子生物学测定
采用 PCR 法测定髓核组织内 TIMP-1、BMP-15及内参基因 GAPDH 含量,术后 3 个月两组病变髓核组织内 TIMP-1、BMP-15 基因表达值差异无统计学意义 ( P>0.05 ),说明两组退变速度相当,实验组3 个月与 6 个月病变髓核组织内 TIMP-1、BMP-15基因表达值差异无统计学意义 ( P>0.05 ),而对照组病变髓核 3 个月与 6 个月差异有统计学意义 ( P<0.05 ),对照组与实验组术后 6 个月差异有统计学意义 ( P<0.05 ),说明 Coflex 动态稳定系统能椎间盘退变有一定保护作用 ( 表 3 )。
表1 两组术后 3 个月和 6 个月椎间盘髓核 MRI T2 加权图像半定量值比较 ( ±s )Tab.1 Postopera-tive semi quantitative analysis of T2 MRI images at 3 and 6 months ( ±s )

表1 两组术后 3 个月和 6 个月椎间盘髓核 MRI T2 加权图像半定量值比较 ( ±s )Tab.1 Postopera-tive semi quantitative analysis of T2 MRI images at 3 and 6 months ( ±s )
注:a与术后 3 个月比较,差异有统计学意义 ( t=7.376,P=0.0018 );b与术后 3 个月比较,差异无统计学意义 ( t=0.745,P=0.498 )Notice: aThere were significant differences when compared to the data 3 months after the surgery ( t = 7.376, P = 0.0018 ); bThere were no significant differences when compared to the data 3 months after the surgery ( t = 0.745, P = 0.498 )
组别 术后 3 个月 术后 6 个月对照组 1.89±0.12 2.92±0.21a实验组 1.76±0.12 1.69±0.11b t 值 1.327 8.987 P 值 0.2552 0.0008
表2 两组术后 3 个月、6 个月 II 型胶原阳性细胞数比较 ( ±s )Tab.2 Comparison of type II collagen-positive cell number at 3 and 6 months ( ±s )
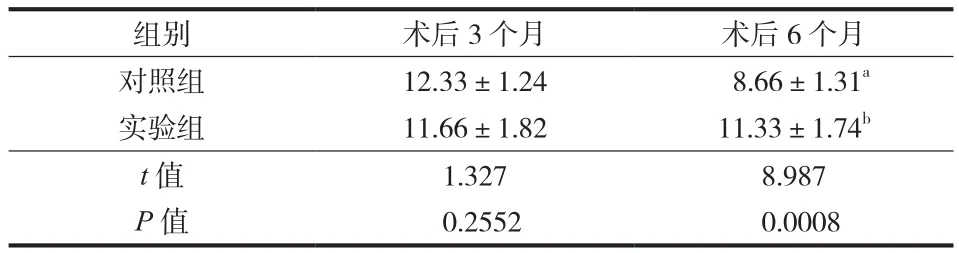
表2 两组术后 3 个月、6 个月 II 型胶原阳性细胞数比较 ( ±s )Tab.2 Comparison of type II collagen-positive cell number at 3 and 6 months ( ±s )
注:a与术后 3 个月比较,差异有统计学意义 ( t=3.524,P=0.0244 );b与术后 3 个月比较,差异无统计学意义 ( t=0.003,P=0.9981 )Notice: aThere were significant differences when compared to the data 3 months after the surgery ( t = 3.524, P = 0.0244 ); bThere were no significant differences when compared to the data 3 months after the surgery ( t = 0.003, P = 0.9981 )
组别 术后 3 个月 术后 6 个月对照组 12.33±1.24 8.66±1.31a实验组 11.66±1.82 11.33±1.74b t 值 1.327 8.987 P 值 0.2552 0.0008
表- 3 两组术后 3 个月、6 个月各基因表达量 / 内参基因值比较( ±s )Tab.3 TIMP-1 and BMP-15 gene expression analysis at 3 and 6 months (±s)

表- 3 两组术后 3 个月、6 个月各基因表达量 / 内参基因值比较( ±s )Tab.3 TIMP-1 and BMP-15 gene expression analysis at 3 and 6 months (±s)
注:a与术后 3 个月比较,差异有统计学意义 ( P<0.05 );b与术后 3 个月比较,差异无统计学意义 ( P>0.05 )Notice: aThere were significant differences when compared to the data 3 months after the surgery ( P < 0.05 ); bThere were no significant differences when compared to the data 3 months after the surgery ( P > 0.05 )
BMP-15 /GAPDH对照组 0.70±0.12 0.78±0.13 1.86±0.14a 1.98±0.24a实验组 0.78±0.14 0.83±0.14 0.85±0.13b 0.98±0.14b t 值 0.751 0.453 9.157 6.234 P 值 0.4942 0.6738 0.0007 0.0034组别术后 3 个月 术后 6 个月TIMP-1 /GAPDH BMP-15 /GAPDH TIMP-1 /GAPDH
讨 论
一、腰椎间盘退变动物模型及评价指标建立
椎间盘退行性改变是椎间盘突出症的基本病理生理过程,建立一种操作简单、可重复性好又接近人类腰椎生物力学环境的理想动物模型是防治椎间盘退变实验研究关键。比格犬属于软骨营养障碍型椎间盘犬,其椎间盘在解剖结构和生化成分上与人类接近,虽然犬为四肢动物,但是喜好蹲坐,较接近与人类腰椎间盘所处的生物力学环境,因此本研究使用比格犬作为建立椎间盘退变模型的动物。2005 年 Masuda 等[9]报道应用普通针头穿刺纤维环方法损伤髓核组织来诱发椎间盘退变,因其具有实验周期短、成功率高等优点,是目前公认的理想椎间退变动物模型建立技术。但其使用的是“切开法”直视下进行穿刺操作,仍存在手术创伤大,操作过程烦琐等缺点。为此,笔者借鉴微创脊柱外科技术,采用 C 型臂机引导下经皮椎间隙直接穿刺纤维环及髓核组织来建立腰椎间盘退变模型,经形态学、免疫组织化学及分子生物学各项指标测定证实能建立理想的腰椎间盘退变实验模型,具有手术创伤小、动物生存率高、操作简单、可重复性好等优点[7]。
在诸多反映椎间盘退变影像学指标中,MRI 检查因其具有图像清晰、软组织分辨率高、能多平面扫描等优点,一直是是评价椎间盘退变程度首选的无损伤性影像学检查方法[10]。Videman 等[8]对髓核退变进行了半定量分析,将强度降低分为 4 级,对应为 0~3 分,退变分数为髓核前、中、后 3 个部位分数之和,0 分无退变,9 分最严重,能较好提供椎间盘退变的相关信息。本研究发现其观察结果能较好地反映椎间盘髓核的退变程度,与组织学、免疫组织化学及分子生物学指标具有良好一致性。正常椎间盘主要由水、胶原及蛋白多糖构成。胶原主要与椎间盘的弹性和机械强度相关,在腰椎退变早期,髓核中 II 型胶原含量即出现减少,发展趋势与椎间盘退变严重程度成正比[11]。因此,本课题采用测量髓核中 COL-2 阳性细胞变化来判断椎间盘的退变与否以及严重程度。本实验结果表明两组COL-2 阳性细胞术后 3 个月、6 个月时出现明显的逐步减少趋势,实验组减少趋势较对照组为轻。髓核组织内细胞因子较多,包括促合成作用的细胞因子 BMP,抗代谢作用的细胞因子 TIMP 等,TIMP-1和生长因子 BMP-15 通过胶原和蛋白多糖的增加来影响细胞外基质,诱发椎间盘退变[12]。本实验研究结果表明,对照组椎间盘髓核组织在术后 3 个月、6 个月 TIMP-1、BMP-15 的相对表达量均明显增加,符合椎间盘退变后基因表达改变,实验组虽然上述两种细胞因子含量也有增高,但与对照组比较差异有统计学意义。
二、椎间融合对邻近节段椎间盘退变影响
椎间融合术是重建脊椎稳定性、纠正腰椎异常负荷承载方式的有效方法。近年来的研究发现椎间融合虽能有效重建脊柱稳定性,但同时易诱发邻近节段的退变。Phillips 等[13]通过对兔腰椎融合内固定模型研究,发现融合后 3 个月即可见融合邻近节段椎间盘的环状板层胶原束的平行排列结构紊乱,6 个月时失去板层结构特征,9 个月时椎间盘结构被紊乱纤维组织替代,并见纤维环撕裂。Chen 等[14]通过建立腰椎有限元模型研究腰椎前路融合术后邻近节段椎间盘的压力分布,发现邻近节段椎间盘内部的压力异常增高,腰椎总活动度减小,而邻近节段运动占整个腰椎运动的百分比增加,脊柱节段活动度出现重新分配,导致邻近节段的活动度增加及运动方式异常。如邻近节段术前已存在某些退变因素,退变则会进一步加速发展,融合前邻近节段是否存在退变因素及其状况直接关系到术后退变的发生率和进展程度[15-16]。但也有研究发现,年龄是腰椎融合后加速邻近节段退变的重要因素之一,>55 岁的腰椎后外侧融合患者,其邻近节段退变发生率高达 36.7%,而<55 岁者仅为 12.0%,且在融节段的远隔节段也可以出现与融合邻近节段相似的退变表现,认为融合前该病变的自然史比融合本身的影响更大[17],因此椎间融合是否引起邻近节段的退变一直是脊柱外科领域内争论的课题。本次实验随机选取比格犬进行腰椎间融合作为对照组,腰椎间融合加相邻节段 Coflex 置入作为实验组,术后第 3、6 个月形态学、免疫组织化学及分子生物学各项指标检测结果支持椎间融合将加剧邻近节段椎间盘退变观点,但本实验研究的观察时间有限,随着时间延长,目标椎间盘是否会随着自然史而加速退变尚需进一步研究。
三、后路棘突间动态装置对椎间盘退变作用
为防治腰椎融合后引起相邻节段椎间盘退变导致“邻椎病 ( adjacent segment disease,ASD )”,近年来有学者提出“动态稳定”概念[3-4]。目前临床上使用的动态稳定系统大致可分为棘突间动态固定系统 ( 如 X-Stop 系统、Coflex 系统等 ),棘突间韧带系统 ( 如 Wallis system ) ,椎弓根钉联合韧带系统 ( 如Dynewyw 系统 ) 及椎弓根钉联合半坚强金属固定系统 ( 如 DSS 系统 ) 四大类,其中以棘突间动态系统Coflex 临床应用最广泛,该装置设计的主要原理能减轻关节突关节压力,维持神经管高度,增加腰椎稳定性[18-19]。陈一衡等[20]对 30 例退行性腰椎管狭窄患者行 Coflex 棘突间动力内固定治疗,术后影像学观察包括椎间隙高度相邻椎体边缘夹角、椎管及硬膜囊面积、椎管及硬膜囊横矢状径等指标。结果发现术后椎间隙背侧高度明显增大,手术节段相邻椎体间运动幅度无明显增大,椎管内空间、硬膜囊面积均有所增加。本实验研究应用 Topping-off 技术来防治椎间融合术后比格犬上位邻近椎间盘退变,经 MRI 检查、COL-2 阳性细胞含量、TIMP-1 及BMP-15 基因表达量,发现术后 6 个月实验组各项观察指标均好于对照组,表明后路棘突间固定装置Coflex 对比格犬的腰椎间盘退变有一定保护作用,Topping-off 技术对椎间融合后相邻节段退变有一定延缓作用。
虽然后路棘突间动态固定装置在近期内可减缓椎间盘退变进程,但由于其置入后的负荷分解规律,置入位置及置入物本身预置的压应力等对椎间盘退变影响等问题尚未解决,且实验及临床研究时间有限,尤其是缺乏系统的随机对照研究和合理评价体系,需要更多的研究来支持与验证。
[1] Siewe J, Otto C, Knoell P, et al. Comparison of standard fusion with a “topping off” system in lumbar spine surgery: a protocol for a randomized controlled trial[J]. BMC Musculoskelet Disord, 2011, 12:239.
[2] Nachanakian A, El Helou A, Alaywan M. Posterior dynamic stabilization: The interspinous spacer from treatment to prevention[J]. Asian J Neurosurg, 2016, 11(2):87-93.
[3] Zhu Z, Liu C, Wang K, et al. Topping-off technique prevents aggravation of degeneration of adjacent segment fusion revealed by retrospective and finite element biomechanical analysis[J]. J Orthop Surg Res, 2015, 10:10.
[4] Liu HY, Zhou J, Wang B, et al. Comparison of Toppingoff and posterior lumbar interbody fusion surgery in lumbar degenerative disease: a retrospective study[J]. Chin Med J(Engl), 2012, 125(22):3942-3946.
[5] Chou PH, Lin HH, An HS, et al. Could the topping-off technique be the preventive strategy against adjacent segment disease after pedicle screw-based fusion in lumbar degenerative diseases? A systematic review[J]. Biomed Res Int, 2017,2017:4385620.
[6] Chen XL, Guan L, Liu YZ, et al. Interspinous dynamic stabilization adjacent to fusion versus double-segment fusion for treatment of lumbar degenerative disease with a minimum follow-up of three years [J]. Int Orthop, 2016, 40(6):1275-1283.
[7] 彭俊, 徐建广. 椎间盘退变与修复动物的体内模型和体外模型[J]. 中国组织工程研究与临床康复, 2010, 14(11):2035-2038.
[8] Videman T, Nummi P, Battié MC, et al. Digital assessment of MRI for lumbar disc desiccation. A comparison of digital versus subjective assessments and digital intensity profiles versus discogram and macroanatomic findings[J]. Spine, 1994,19(2):192-198.
[9] Masuda K, Aota Y, Muehleman C, et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J]. Spine, 2005, 30(1):5-14.
[10] Zhou H, Hou S, Shang W, et al. A new in vivo animal model to create intervertebral disc degeneration characterized by MRI,radiography, CT/discogram, biochemistry, and histology[J].Spine, 2007, 32(8):864-872.
[11] Roughley PJ. Biology of intervertebral disc aging and degeneration: involvement of the extracellular matrix[J]. Spine,2004, 29(23):2691-2699.
[12] Wallach CJ, Sobajima S, Watanabe Y, et al. Gene transfer of the catabolic inhibitor TIMP-1 increases measured proteoglycans in cells from degenerated human intervertebral discs[J]. Spine,2003, 28(20):2331-2337.
[13] Phillips FM, Reuben J, Wetzel FT. Intervertebral disc degeneration adjacent to a lumbar fusion. An experimental rabbit model[J]. J Bone Joint Surg Br, 2002, 84(2):289-294.
[14] Chen CS, Cheng CK, Liu CL, et al. Stress analysis of the disc adjacent to interbody fusion in lumbar spine[J]. Med Eng Phys,2001, 23(7):483-491.
[15] Kumar MN, Baklanov A, Chopin D. Correlation between sagittal plane changes and adjacent segment degeneration following lumbar spine fusion[J]. Eur Spine J, 2001, 10(4):314-319.
[16] Ekman P, Möller H, Shalabi A, et al. A prospective randomised study on the long-term effect of lumbar fusion on adjacent disc degeneration[J]. Eur Spine J, 2009, 18(8):1175-1186.
[17] Bae JS, Lee SH, Kim JS, et al. Adjacent segment degeneration after lumbar interbody fusion with percutaneous pedicle screw fixation for adult low-grade isthmic spondylolisthesis:minimum 3 years of follow-up[J]. Neurosurgery, 2010, 67(6):1600-1608.
[18] Sobottke R, Schlüter-Brust K, Kaulhausen T, et al. Interspinous implants (X Stop, Wallis, Diam) for the treatment of LSS: is there a correlation between radiological parameters and clinical outcome[J]? Eur Spine J, 2009, 18(10):1494-1503.
[19] Richolt JA, Rauschmann MA, Schmidt S. Interspinous spacers--technique of Coflex™ implantation[J]. Oper Orthop Traumatol, 2010, 22(5-6):536-544.
[20] 陈一衡, 徐丁, 徐华梓. Coflex 棘突间动力内固定装置治疗退行性腰椎管狭窄[J]. 中国骨伤, 2009, 22(12):902-905.
