Coflex 棘突间固定装置植入术治疗腰椎管狭窄症七年随访
2018-03-01郑晓青昌耘冰顾宏林梁国彦庄见雄尹东刘斌
郑晓青 昌耘冰 顾宏林 梁国彦 庄见雄 尹东 刘斌
退行性腰椎管狭窄症 ( degenerative lumber spinal stenosis,DLSS ) 是临床上常见疾病,常采用椎管减压融合内固定术治疗[1],获得了确切的疗效。但腰椎融合后可造成邻近节段应力集中,邻近节段的运动范围异常增加,继发邻近节段病变[2-3]。为了避免这些并发症,动态固定的理念应运而生,棘突间非融合技术是这一理念的体现,Coflex 棘突间固定装置是临床上应用得比较多的非融合固定物,对于其中长期疗效目前尚不清楚,能否减少或延缓术后邻近节段退变 ( adjacent segment degeneration,ASD )的发生尚无定论。2007 年 6 月至 2010 年 6 月,我科采用 Coflex 和融合技术两种方法治疗 DLSS 患者100 例,比较两组患者疗效满意度和 ASD 情况等,以评估 Coflex 的临床应用价值,报告如下。
资料与方法
一、纳入与排除标准
1. 纳入标准:( 1 ) 有明确的间歇性跛行,可伴有腰痛或下肢放射痛,经过正规的保守治疗无效;( 2 ) 术前 X 线片、MRI 等检查证实为 DLSS;( 3 ) 责任节段 ( L4~5) 可伴有腰椎间盘突出或 I 度以下滑脱,邻近节段 ( L3~4、L5~S1) 无滑脱、不稳;( 4 ) 椎管狭窄程度均可采用 Coflex 手术或者后路腰椎椎间融合术 ( posterior lumbar intervertebral fusion,PLIF )达到减压效果者。
2. 排除标准:( 1 ) 既往有腰椎手术史、腰椎严重外伤、感染史或者其它腰椎疾病者,如侧、后凸畸形,类风湿关节炎或强直性脊柱炎等;( 2 ) 责任节段退变性滑脱超过 I 度或真性滑脱;( 3 ) 邻近节段有滑脱、不稳;( 4 ) 严重骨质疏松;( 5 ) 严重椎管狭窄,只能采用 PLIF 才能达到效果者。
二、一般资料
本研究共纳入 100 例。Coflex 组 50 例,11 例失访,末次随访 39 例,其中男 23 例,女 16 例,年龄 48~70 岁,平均 ( 57.6±5.9 ) 岁;融合组 50 例,7 例失访,末次随访 43 例,男 28 例,女 15 例,年龄50~73 岁,平均 ( 59.0±6.7 ) 岁。所有患者术前均行腰椎正侧位+动力位 X 线、MRI 检查。
三、手术方法
Coflex 组:全麻俯卧位,透视确定手术节段后,取后正中切口,长约 5 cm,锐性分离棘上韧带至 L4棘突上缘和 L5棘突下缘,沿骨膜剥离显露至双侧小关节,注意保护双侧小关节囊。行双侧小开窗减压,注意切除增生肥厚的黄韧带,必要时切除增生内聚的小关节突内侧缘,同时注意侧隐窝的减压,小关节切除不超过内侧 1 / 3。如果同时存在明显的椎间盘突出,同时摘除突出的部分髓核。切除棘间韧带直至硬膜,以咬骨钳修整上下棘突,同时注意保护棘突避免损伤棘突造成骨折。选择合适大小 Coflex 假体 ( Paradium 公司,美国 ),假体应尽可能贴近棘突根部和椎板,假体放置合适且无松动后再次透视确认,适度夹紧侧翼,1 号薇乔线穿过假体侧孔与棘上韧带缝合结扎,放置引流后术毕。
融合组:全麻俯卧位,透视确定手术节段后,取后正中切口。骨膜下剥离椎旁肌,向两侧牵开,显露棘突两侧椎板,向责任椎两侧置入椎弓根钉,C 型臂机透视其位置良好,行病变椎体全椎板减压,去除增生的黄韧带、小关节突,扩大神经根管。切开纤维环,将病变椎间盘切除行椎间植骨融合,最后连接钛棒,放置引流后术毕。
四、评价方法
1. 临床疗效观察:比较两组患者的手术时间、术中出血量、下床活动时间、住院天数;对比两组间术前、末次随访时日本骨科学会 ( Japanese orthopaedic association,JOA ) 评分、Oswestry 功能障碍指数 ( oswestry disability index,ODI ) 及疼痛视觉模拟评分 ( visual analogue scale,VAS ),记录两组患者随访过程的并发症。
2. 影像学观察:术前及末次随访均拍摄腰椎正侧位+过伸过屈动力位 X 线片及 MRI。使用 PACS影像系统提供的测量工具。椎间隙高度:站立侧位X 线片上 L3~4和 L5~S1节段相邻终板中点的距离;椎间活动度=过伸位椎间隙角度-过屈位椎间隙角度;椎间隙高度丢失量=术前椎间隙高度-末次随访椎间隙高度;椎间活动度增加量=末次随访椎间活动度-术前椎间活动度 ( 图 1、2 )。由 2 位医师进行所有病例的测量,取平均值。术前和末次随访时分别对 L3~4和 L5~S1进行 Pfirrmann 分级评定,由 2 位医师评定,如果 2 名医生产生误差,则由第3 位医生来最终确定。
五、统计学处理
采用 SPSS 17.0 软件进行统计学分析,计量资料采用±s 表示,两组间的 JOA、VAS、ODI、术中出血量、手术时间等组间比较采用独立样本 t 检验,组内比较采用配对 t 检验,等级资料采用秩和检验,率的比较采用 χ2检验,P<0.05 为差异有统计学意义。
结 果
Coflex 组平均随访时间 ( 7.02±0.34 ) 年,融合组平均随访时间 ( 7.62±0.18 ) 年,两组随访时间差异无统计学意义 ( P>0.05 )。Coflex 组患者手术时间、术中出血量、下床活动时间、住院天数明显优于融合组,两组间数据差异有统计学意义 ( P<0.01 ) ( 表 1 )。
表1- 手术时间、术中出血量、下床活动时间、住院天数两组比较 ( ±s )Tab.1 The comparison of the -operation time, intraoperative blood loss, off-bed time, hospital stay ( ±s )

表1- 手术时间、术中出血量、下床活动时间、住院天数两组比较 ( ±s )Tab.1 The comparison of the -operation time, intraoperative blood loss, off-bed time, hospital stay ( ±s )
项目 Coflex 组 ( n=39 ) 融合组 ( n=43 ) t 值 P 值手术时间 ( min ) 54.33±12.17 99.48±24.56 -10.28 < 0.001术中出血量 ( ml ) 74.74±23.33 184.10±47.98 -12.80 < 0.001下床活动时间 ( 天 ) 2.30± 0.46 3.79± 0.76 -9.18 < 0.001平均住院天数 ( 天 ) 5.61± 1.13 8.28± 0.68 -10.34 < 0.001
两组患者 JOA、ODI、VAS 评分值在末次随访时较术前均有显著改善,差异有统计学意义 ( P<0.01 ),两组间术前和末次随访比较差异无统计学意义 ( P>0.05 ) ( 表 2 )。
随访过程中两组邻近节段椎间隙高度均减少,两组间椎间隙高度丢失量比较差异有统计学意义( P<0.01 ) ( 表 3 )。
表2 两组术前及末次随访的 JOA、ODI、VAS 评分 ( ±s )Tab.2 The comparison of JOA, VAS, ODI ( ±s )
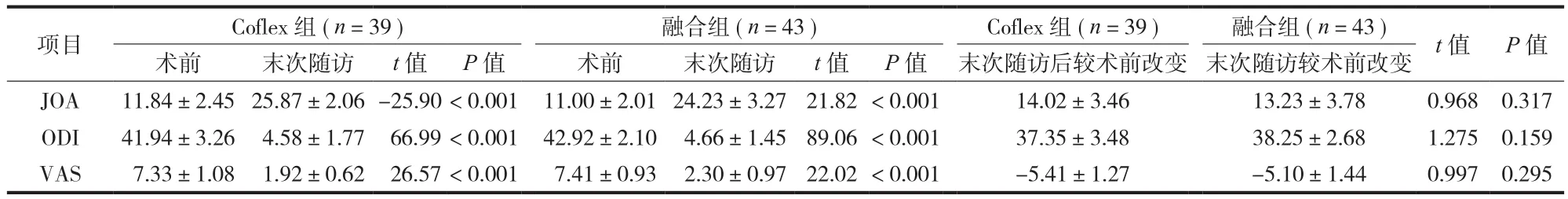
表2 两组术前及末次随访的 JOA、ODI、VAS 评分 ( ±s )Tab.2 The comparison of JOA, VAS, ODI ( ±s )
项目 Coflex 组 ( n=39 ) 融合组 ( n=43 ) Coflex 组 ( n=39 ) 融合组 ( n=43 ) t 值 P 值术前 末次随访 t 值 P 值 术前 末次随访 t 值 P 值 末次随访后较术前改变 末次随访较术前改变JOA 11.84±2.4525.87±2.06-25.90 < 0.001 11.00±2.0124.23±3.27 21.82 < 0.001 14.02±3.46 13.23±3.78 0.968 0.317 ODI 41.94±3.26 4.58±1.77 66.99 < 0.001 42.92±2.10 4.66±1.45 89.06 < 0.001 37.35±3.48 38.25±2.68 1.275 0.159 VAS 7.33±1.08 1.92±0.62 26.57 < 0.001 7.41±0.93 2.30±0.97 22.02 < 0.001 -5.41±1.27 -5.10±1.44 0.997 0.295
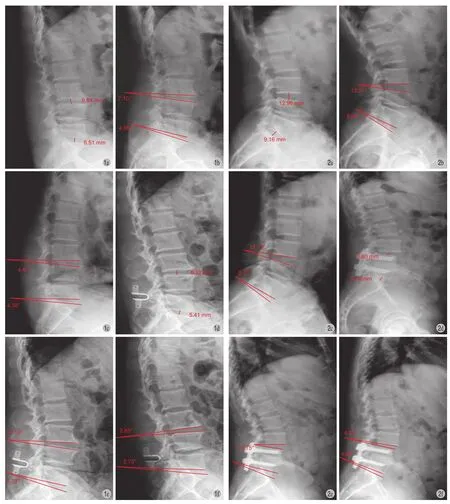
图1 Coflex 组:椎间隙高度丢失量 = 术前椎间隙高度 ( a ) - 末次随访椎间隙高度 ( d );椎间活动度增加量 = 末次随访椎间活动度( e - f ) - 术前椎间活动度 ( b - c )。术前 L3~4 及 L5~S1 椎间隙高度 ( 图 a ) 较末次随访 ( 图 d ) 有丢失;术前 L3~4 及 L5~S1 椎间活动度( 图 b、c ) 较末次随访有增加 ( 图 e、f )图2 融合组:椎间隙高度丢失量 = 术前椎间隙高度 ( a ) - 末次随访椎间隙高度 ( d );椎间活动度增加量 = 末次随访椎间活动度( e - f ) - 术前椎间活动度 ( b - c )。术前 L3~4 及 L5~S1 椎间隙高度 ( 图 a ) 较末次随访 ( 图 d ) 有丢失;术前 L3~4 及 L5~S1 椎间活动度( 图 b、c ) 较末次随访有增加 ( 图 e、f )Fig.1 Coflex Group: loss of intervertebral height = intervertebral height preoperatively ( a ) - intervertebral height at the latest follow-up ( d );The range of increased intervertebral motion = the range of intervertebral motion at the latest follow-up ( e - f ) - the range of intervertebral motion preoperatively ( b - c ). The intervertebral height preoperatively L3-4, L5 - S1 ( Figure a ), at the latest follow-up ( Figure d ), height loss exited. The intervertebral motion at the latest follow-up ( Figure e, f ) increased comparing with the data preoperatively ( Figure b, c )Fig.2 Fusion Group: loss of intervertebral height = intervertebral height preoperatively ( a ) - intervertebral height at the latest follow-up ( d );The range of increased intervertebral motion = the range of intervertebral motion at the latest follow-up ( e - f ) - the range of intervertebral motion preoperatively ( b - c ). The intervertebral height preoperatively L3-4, L5 - S1 ( Figure a ), at the latest follow-up ( Figure d ), height loss exited. The intervertebral motion at the latest follow-up ( Figure e, f ) increased comparing with the data preoperatively ( Figure b, c )
Coflex 组和融合组随访过程中邻近节段椎间活动均增加,两组间椎间活动度增加量比较差异有统计学意义 ( P<0.01 ) ( 表 4 )。
末次随访时,融合组上下邻近节段椎间盘Pfirrmann 分级进展较 Coflex 组明显,两组比较差异有统计学意义 ( P<0.05 ) ( 表 5 )。
术后并发症:Coflex 组 4 例接受二次手术:1 例因临床症状型 ASD ( L3~4椎间盘突出 ) 行髓核摘除术,2 例随访过程中 L4~5椎间盘突出复发,行融合术,1 例术后半年活动时突发剧烈腰痛,X 线提示上位棘突 ( L4) 骨折,行腰椎融合术。融合组 3 例接受二次手术:2 例 L5~S1椎管退变性狭窄,1 例L3~4DLSS 伴椎间盘突出。末次随访时,Coflex 组6 例 L4棘突出现骨吸收;4 例在屈曲位 X 线片上有L4棘突固定端的松动,但患者均无主诉腰痛等不适( 表 6 )。
讨 论
临床上,DLSS 常采用椎管减压融合内固定术治疗,但其创伤大、出血多、ASD 越来越受到重视[4-6]。针对这种情况,有学者提出非融合固定理念,采用弹性固定的方法,保留手术节段活动范围、减少椎间盘负荷及 ASD 的几率[7-8]。常用的有人工椎间盘、棘突间撑开装置 ( interspinous process distraction device,IPD ) 以及基于椎弓根钉技术的弹性固定系统等[9]。IPD 相对更微创,出血更少,恢复更快等优点受到重视,20 世纪 90 年代,Jacques Samani 发明了棘突间 U 形固定装置,并在临床治疗中取得良好的效果[10]。2005 年,Paradigm Spine 公司对该装置进行改进,并命名为 Coflex,它保留手术节段的伸屈运动功能,同时限制过度的伸屈活动,是一种动态稳定装置[11],该系统的多中心前瞻性随机对照临床试验已获美国 FDA 研究性器械豁免批准[5]。Richter 等[9]统计了最大样本的 Coflex 手术,近 14 000 例的临床应用,研究表明 Coflex 治疗退行性腰椎疾病取得良好的临床疗效;Davis 等[5]研究显示,Coflex 手术后功能改善情况与融合手术接近,并且 Coflex 手术创伤更小、安全性更高;Errico 等[12]在随访中长期的 Coflex 临床疗效显示,92% 的患者对治疗结果表示满意或非常满意。目前关于 Coflex手术>7 年以上的临床疗效报告非常少,本研究随访比较了>7 年的 Coflex 手术和融合手术的临床疗效,结果显示:Coflex 组和融合组末次随访时,JOA、ODI、VAS 评分值均较术前有显著改善,两组均能获得良好的临床疗效。Coflex 组手术时间、术中出血量、下床活动时间、住院天数明显优于融合组,这可能与 Coflex 手术对骨性结构切除和椎旁肌剥离等较少相关,说明 Coflex 手术创伤更小、恢复更快,与近期的临床荟萃分析结果一致[13]。
表3 邻近节段椎间隙高度丢失量两组比较 ( ±s,mm )Tab.3 The comparison of intervertebral height loss of adjacent segments ( ±s, mm )
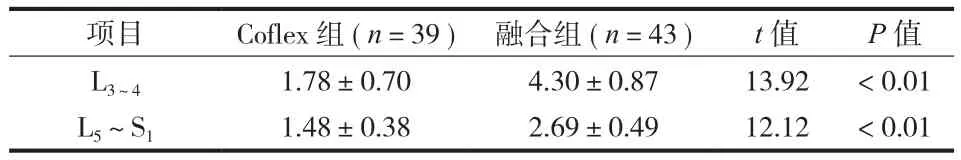
表3 邻近节段椎间隙高度丢失量两组比较 ( ±s,mm )Tab.3 The comparison of intervertebral height loss of adjacent segments ( ±s, mm )
项目 Coflex 组 ( n=39 ) 融合组 ( n=43 ) t 值 P 值L3~4 1.78±0.70 4.30±0.87 13.92 < 0.01 L5~S1 1.48±0.38 2.69±0.49 12.12 < 0.01
表4 邻近节段椎间活动度增加量两组比较 ( ±s,° )Tab.4 The comparison of the increased range of intervertebral motion of adjacent segments ( ±s, ° )

表4 邻近节段椎间活动度增加量两组比较 ( ±s,° )Tab.4 The comparison of the increased range of intervertebral motion of adjacent segments ( ±s, ° )
项目 Coflex 组 ( n=39 ) 融合组 ( n=43 ) t 值 P 值L3~4 3.05±1.30 4.03±0.34 -4.60 < 0.01 L5~S1 3.04±1.24 4.01±0.33 -4.71 < 0.01

表5 两组术前及末次随访时邻近节段椎间盘 Pfirrmann 分级 ( 例 )Tab.5 The comparison of Pfirrmann grading of the adjacent segments ( case )
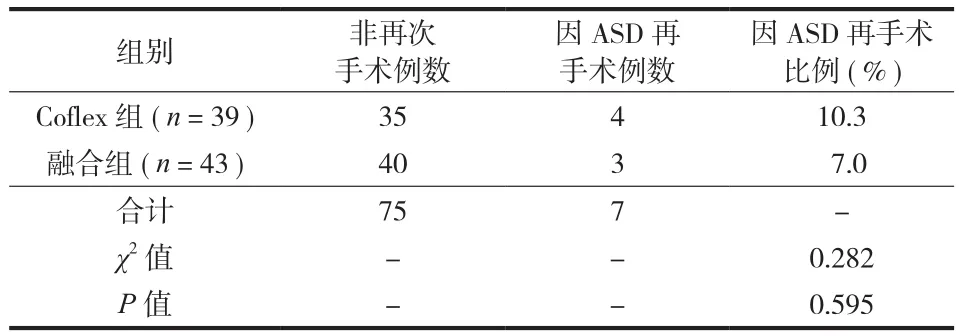
表6 两组因 ASD 再手术率的比较 ( 例 )Tab.6 The comparison of the reoperation rate for adjacent segment degeneration ( case )
腰椎椎管减压椎间融合术已广泛用于治疗DLSS,许多学者发现融合术后 ASD[14-16]。Alentado等[17]研究发现,9% 的融合术后患者因 ASD 行二次手术治疗。目前关于 ASD 的病理机制仍不明确,和多种因素相关[18]。基础研究证实,椎间盘髓核细胞的退变是发生 ASD 的内在因素[19-20],椎间盘压力增加是加速退变的重要原因[21],生物力学研究表明:融合手术后相邻节段应力增加、活动幅度加大,在其它因素的综合作用下会引起或加速 ASD[8]。Meta 分析显示,腰椎融合术后影像学上 ASD 发生率在 21.3%~31.9%,出现临床症状的 ASD 在 6.4%~10.7%[22],且随访时间越长,ASD 发生率越高。Park等[23]研究部分 10 年以上随访病例,结果显示融合术后影像学 ASD 发生率高达 100%,在本组研究中,笔者采用邻近节段椎间活动度改变来评估邻近节段的应力情况;采用邻近节段椎间高度改变和邻近节段椎间盘 Pfirrmann 分级进展情况来评估 ASD。末次随访时,Coflex 组和融合组邻近节段活动度均较术前增加,但 Coflex 组的椎间活动度增加量少于融合组,差异有统计学意义,这结果说明:和融合术相比,Coflex 手术后邻近节段应力小于融合组,能减少邻近节段的应力集中。生物力学研究表明,Coflex 装置能避免邻近节段应力过多集中,有利相邻节段的保护[24]。Bae 等[25]进行了前瞻性、多中心随机对照研究也显示:与 Coflex 手术比较,融合手术邻近节段的活动度增加,可能加速 ASD 的发生。同样,在本组研究中 Coflex 组和融合组椎间隙高度均较术前有所丢失,Pfirrmann 分级均有不同程度的进展,随诊时间的延长,无论是 Coflex 手术还是融合手术,ASD 均会发生,只是发生的严重程度不一样而已。相比融合组,Coflex 组椎间隙高度丢失和 Pfirrmann 分级进展均明显低于融合组,这说明 Coflex 手术能延缓或者减少 ASD 的发生 ( 图 3 ),可见 Coflex 手术后邻近节段椎间盘退变程度要小于融合手术。有学者报告:棘突间动态稳定装置邻近节段有一定的保护作用,能延缓或者减少 ASD 的发生,非融合的生物力学报告也优于融合术[12,26]。
虽然 Coflex 手术患者在末次随访中仍取得良好的临床疗效,且能延缓或者减少 ASD 的发生,但其并发症也不容忽视,在本组研究中,Coflex 组 4 例接受二次手术:1 例因临床症状型 ASD ( L3~4椎间盘突出 ) 行髓核摘除术,2 例随访过程中 L4~5椎间盘突出复发,行融合术,1 例术后半年活动时突发剧烈腰痛,X 线提示上位棘突 ( L4) 骨折,行腰椎融合术。再手术率达 10.3%,而融合组的再手术率只有7.0%。Lee 等[27]系统性地回顾了 Coflex 等在内的棘突间稳定装置临床应用的并发症发生率 ≤ 32.3%,翻修率也高于融合手术。末次随访时,Coflex 组 6 例L4棘突出现骨吸收;4 例在屈曲位片上有 L4棘突固定端的松动,患者均无主诉腰痛等不适,可见 Coflex手术的植入物相关的并发症并不少见。笔者分析认为,这可能是由于 Coflex 装置植入深度不够,应该将 Coflex 装置到椎板间隙之间,而不是单纯的棘突间隙,当植入深度不够时会加大棘突的应力,而棘突骨质不足以稳定 Coflex 装置,所以出现骨质吸收、假体松动,甚至棘突骨折的可能。当然,手术节段的椎间盘高度以及活动度的下降,也可能带来棘突骨折、假体移位等并发症[28]。
综上所述,Coflex 手术和融合手术在治疗 DLSS均能取得良好的临床疗效,7 年随访临床满意,Coflex 组在近期具有出血少、创伤小、术后恢复快等优点。Coflex 手术比融合手术更能维持邻近节段稳定性和椎间高度,而且能延缓或者减少 ASD 的发生,但其再手术率较高,而且 Coflex 手术的患者植入物相关并发症并不少见。
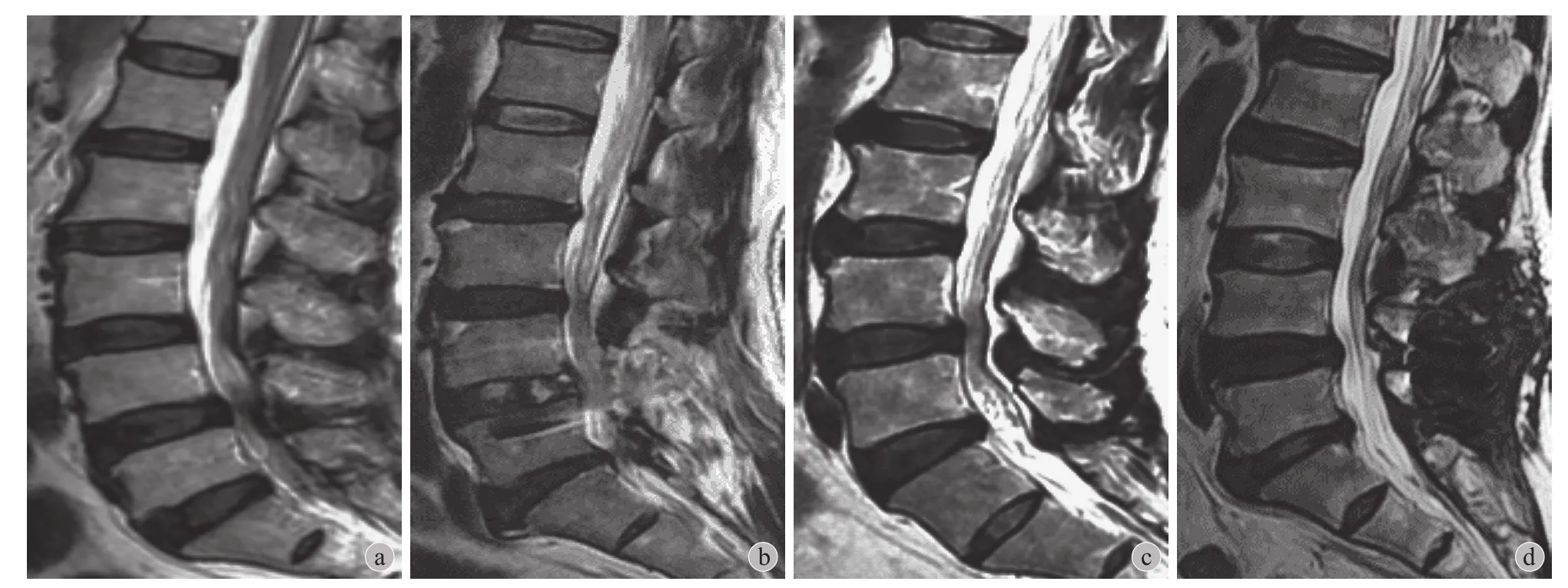
图3 融合组手术病例 a:术前 L3~4 Pfirrmann 分级 III 级,L5~S1 III 级;b:末次随访时 L3~4 Pfirrmann 分级 IV 级,L5~S1 IV 级。Coflex 手术病例:c:术前 L3~4 Pfirrmann 分级 III 级,L5~S1 III 级;d:末次随访时 L3~4 Pfirrmann 分级 III 级,L5~S1 IV 级Fig.3 Fusion Group a: Pfirrmann grade III in L3-4, grade III in L5 - S1 preoperatively; b: At the latest follow-up, Pfirrmann grade IV in L3-4, grade IV in L5 - S1. Coflex group; c: Pfirrmann grade III in L3-4, grade III in L5 - S1 preoperatively; d: At the latest follow-up, Pfirrmann grade III in L3-4,grade IV in L5 - S1
[1] Kreiner DS, Shaffer WO, Baisden JL, et al. An evidencebased clinical guideline for the diagnosis and treatment of degenerative lumbar spinal stenosis (update)[J]. Spine J, 2013,13(7):734-743.
[2] Ghiselli G, Wang JC, Bhatia NN, et al. Adjacent segment degeneration in the lumbar spine[J]. J Bone Joint Surg Am,2004, 86-A(7):1497-1503.
[3] Cheh G, Bridwell KH, Lenke LG, et al. Adjacent segment disease followinglumbar / thoracolumbar fusion with pedicle screw instrumentation: a minimum 5-year follow-up[J]. Spine,2007, 32(20):2253-2257.
[4] Alentado VJ, Lubelski D, Healy AT, et al. Predisposing characteristics of adjacent segment disease after lumbar fusion[J]. Spine, 2016, 41(14):1167-1172.
[5] Davis RJ, Errico TJ, Bae H, et al. Decompression and Coflex interlaminar stabilization compared with decompression and instrumented spinal fusion for spinal stenosis and lowgrade degenerative spondylolisthesis: two-year results from the prospective, randomized, multicenter, Food and Drug Administration Investigational Device Exemption trial[J].Spine, 2013, 38(18):1529-1539.
[6] Chen HC, Wu JL, Huang SC, et al. Biomechanical evaluation of a novel pedicle screw-based interspinous spacer: A finite element analysis[J]. Med Eng Phys, 2017, 46:27-32.
[7] Musacchio MJ, Lauryssen C, Davis RJ, et al. Evaluation of decompression and interlaminar stabilization compared with decompression and fusion for the treatment of lumbar spinal stenosis: 5-year follow-up of a prospective, randomized,controlled trial[J]. Int J Spine Surg, 2016, 10:6.
[8] Lawrence BD, Wang J, Arnold PM, et al. Predicting the risk of adjacent segment pathology after lumbar fusion: a systematic review[J]. Spine, 2012, 37(Suppl 22):S123-132.
[9] Richter A, Schutz C, Hauck M, et al. Does an interspinous device (Coflex) improve the outcome of decompressive surgery in lumbar spinal stenosis? One-year follow up of a prospective case control study of 60 patients[J]. Eur Spine J, 2010,19(2):283-289.
[10] Adelt D. The interspinous U implant (now Coflex): longterm outcome, study overview and differential indication[J].Orthopade, 2010, 39(6):595-601.
[11] Tsai KJ, Murakami H, Lowery GL, et al. A biomechanical evaluation of an interspinous device (Coflex) used to stabilize the lumbar spine[J]. J Surg Orthop Adv, 2006, 15(3):167-172.
[12] Errico TJ, Kamerlink JR, Quirno M, et al. Survivorship of coflex interlaminar-interspinous implant[J]. SAS J, 2009,3(2):59-67.
[13] Kuang MJ, Ma JX, Ma XL. Decompression and coflex interlaminar stabilization compared with conventional surgical procedures for lumbar spinal stenosis: A systematic review and meta-analysis[J]. Int J Surg, 2017, 45:164-165.
[14] Celestre PC, Montgomery SR, Kupperman AI, et al. Lumbar clinical adjacent segment pathology: predilection for proximal levels[J]. Spine, 2014, 39(2):172-176.
[15] Hikata T, Kamata M, Furukawa M. Risk factors for adjacent segment disease after posterior lumbar interbody fusion and efficacy of simultaneous decompression surgery for symptomatic adjacent segment disease[J]. J Spinal Disord Tech,2014, 27(2):70-75.
[16] Sears WR, Sergides IG, Kazemi N, et al. Incidence and prevalence of surgery at segments adjacent to a previous posterior lumbar arthrodesis[J]. Spine J, 2011, 11(1):11-20.
[17] Alentado VJ, Lubelski D, Healy AT, et al. Predisposing characteristics of adjacent segment disease after lumbar fusion[J]. Spine, 2016, 41(14):1167-1172.
[18] Kim JY, Ryu DS, Paik HK, et al. Paraspinal muscle, facet joint, and disc problems: risk factors for adjacent segment degeneration after lumbar fusion[J]. Spine J, 2016, 16(7):867-875.
[19] Soukane DM, Shirazi-Adl A, Urban JP. Computation of coupled diffusion of oxygen, glucose and lactic acid in an intervertebral disc[J]. J Biomech, 2007, 40(12):2645-2654.
[20] Galbusera F, van Rijsbergen M, Ito K, et al. Ageing and degenerative changes of the intervertebral disc and their impact on spinal flexibility[J]. Eur Spine J, 2014, 23(Suppl 3):S324-332.
[21] Adams MA, Dolan P. Intervertebral disc degeneration: evidence for two distinct phenotypes[J]. J Anat, 2012, 221(6):497-506.
[22] Xia XP, Chen HL, Cheng HB. Prevalence of adjacent segment degeneration after spine surgery: a systematic review and metaanalysis[J]. Spine, 2013, 38(7):597-608.
[23] Park P, Garton HJ, Gala VC, et al. Adjacent segment disease after lumbar or lumbosacral fusion: review of the literature[J].Spine, 2004, 29(17):1938-1944.
[24] Kafer W, Cakir B, Midderhoff S, et al. Circumferential dynamic stabilization of the lumbar spine: a biomechanical analysis[J].Eur Spine J, 2014, 23(11):2330-2339.
[25] Bae HW, Davis RJ, Lauryssen C, et al. Three-year followup of the prospective, randomized, controlled trial of coflex interlaminar stabilization vs instrumented fusion in patients with lumbar stenosis[J]. Neurosurgery, 2016, 79(2):169-181.
[26] Errico TJ, Kamerlink JR, Quirno M, et al. Survivorship of coflex interlaminar-interspinous implant[J]. SAS J, 2009, 3(2):59-67.
[27] Lee SH, Seol A, Cho TY, et al. A systematic review of interspinous dynamic stabilization[J]. Clin Orthop Surg, 2015,7(3):323-329.
[28] Lee N, Shin DA, Kim KN, et al. Paradoxical radiographic changes of coflex interspinous device with minimum 2-year follow-up in lumbar spinal stenosis[J]. World Neurosurg, 2016,85:177-184.
