采后多胺处理对杏果实黑斑病的控制及贮藏品质的影响
2018-02-28马岳岳李永才胡培芳
马岳岳,李永才*,胡培芳,毕 阳
杏作为时令水果,因其营养丰富、色泽鲜艳、香气浓郁、风味极佳,深受消费者的喜爱[1-3]。但由于杏采收正值高温季节,采后迅速成熟衰老,易受病原物的侵染而发生腐烂,烂损极为严重,其中由于链格孢(Alternaria alternata)引起的黑斑病是杏果实采后的主要病害之一[4]。虽然目前采用化学杀菌剂能有效控制采后病害,但由于长期使用化学杀菌剂会使病原物产生抗性,并造成农药残留和环境污染等一系列问题。因此,迫切需要寻找一种安全有效的病害控制技术。
多胺是生物体代谢过程中具有生物活性的一类低分子质量的脂肪族含氮碱[5],常见的有腐胺、精胺和亚精胺[6]。近年来研究表明多胺在调节植物的生长、控制个体的发育、延缓衰老、提高植物对不利环境的抵御能力等方面具有重要的作用[7]。在苹果[8]、南瓜[9]和中国甘蓝[10]上研究发现采后气调贮藏能有效提高果蔬体内多胺的含量,且其含量与果蔬贮藏时间呈一定的正相关,同样温度预处理抑制南瓜冷害的同时伴随着组织内多胺的累积[11];长期贮藏的番茄果肉软化同腐胺含量也密切相关[12]。外源多胺处理也可有效地减缓果实品质劣变,如0.25~1.00 mmol/L精胺处理红元帅苹果可有效抑制其贮藏后期果肉软化[10]。外源多胺处理还可以通过降低自由基和过氧化氢的含量、保护细胞膜的完整性、调控相关基因的表达、提高抗氧化酶的活性等[7,13]诱导植物产生抗性,如在大麦感染叶锈病真菌(Puccinia hordei)后,被感染叶片中出现了多胺的快速响应积聚[14]。另外0.4~1.0 mmol/L亚精胺处理黄瓜幼苗能够有效控制黄瓜幼苗灰霉病[15]和白粉病[16]的发生,降低其发病病情指数。但有关多胺对植物生理的调控或病害控制多集中于植株上,在果蔬尤其杏果实方面鲜见系统研究报道。因此本实验以兰州大接杏为原料,研究外源多胺对杏果实黑斑病的控制及贮藏期间品质的影响,以期为多胺在采后果蔬防腐保鲜上应用提供理论依据和技术支撑。
1 材料与方法
1.1 菌株、材料、培养基与试剂
A. alternata分离于贮藏中自然发病的果实,纯化后用马铃薯葡萄糖(potato dextrose agar,PDA)培养基保存待用。
大接杏于2016年8月采摘于甘肃省永靖县刘家峡杏园,挑选大小、色泽基本一致且无机械损伤的果实,纸箱包装后运达实验室,冷库3 ℃低温贮藏待用。
PDA培养基[17]:马铃薯200 g、蔗糖20 g、琼脂20 g、蒸馏水1 000 mL。
多胺(精胺、亚精胺、腐胺,均为分析纯) 上海源叶生物科技有限公司。
1.2 仪器与设备
LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;DHP-9272B型恒温培养箱 上海一恒科技有限公司;WZB系列便携式数显折光仪 上海精科仪器有限公司;GY-4型果实硬度计 山东恒美电子科技有限公司;GXH-3051H型果蔬呼吸仪 上海精密仪器仪表有限公司;Ci6x系列色度计 爱色丽(上海)色彩科技有限公司;7820A型气相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 病原菌的分离与纯化
参照李永才[18]的方法进行。采集有黑斑病的大接杏果实,用体积分数75%的酒精进行果实表面消毒,再用无菌水冲洗后切取病健交界处的组织,在无菌操作条件下移至PDA培养基上,然后放于28 ℃保温培养,待其长出分生孢子之后再进行分离、纯化,并通过回接实验确定其致病性。分离纯化的病原物在PDA培养基上保存备用。
1.3.2 孢子悬浮液的配制
参照刘红霞等[19]的方法并略作修改,无菌操作条件下在培养7 d的A. alternata培养皿中倒入30 mL无菌水,并加入0.2 mL体积分数0.01% Tween-80,用已提前高温高压灭过菌的涂布器轻刮,将所得溶液通过4 层纱布过滤到三角瓶中,用无菌水稀释,在混合器上振荡15 s,用血球计数板计数,配制成1.26×106个/mL孢子悬浮液。
1.3.3 多胺处理对果实黑斑病的控制
损伤接种参照Moscoso-Ramirez等[20]的方法。果实采收后,选取大小均匀、无病虫害和瑕疵的果实,用体积分数75%酒精进行表面擦拭消毒,分别用5、10、15、20、40 mmol/L的腐胺,0.5、1.0、1.5、2.0、4.0 mmol/L的精胺和0.5、1.0、1.5、2.0、4.0 mmol/L的亚精胺浸泡杏果实15 mim,自然晾干。将浸泡处理后的杏果实常温贮藏24 h后用已灭菌的铁钉(直径3 mm)在赤道部位均匀打4 个深3 mm的孔,晾干后用移液枪吸取20 µL孢子悬浮液,接入孔内,室温下晾干后,装入厚度为0.02 mm的保鲜袋中,在室温(25±2)℃,相对湿度45%~55%下贮藏,每隔1 d观察并测定果实表面的病斑直径。每个处理用果9 个。
1.3.4 生理指标的测定
选择大小、果色均匀一致且无伤病、未经处理的杏果实在体积分数2%的次氯酸钠溶液中浸泡2 min,清水冲洗后,分别在经最适浓度的腐胺、精胺、亚精胺(由1.3.3节的实验结果筛选出)溶液中浸泡15 min,以蒸馏水浸泡处理作对照,取出后在室温下晾干,市售PE保鲜袋(40 cm×25 cm,厚度0.02 mm)包装,室温下贮藏。每个处理用果实10 个,3 次重复。
1.3.4.1 质量损失率的测定
参照高春丽等[21]的方法,采用称量法测定果实的质量,根据公式(1)计算质量损失率。每个处理用果实10 个,重复3 次。
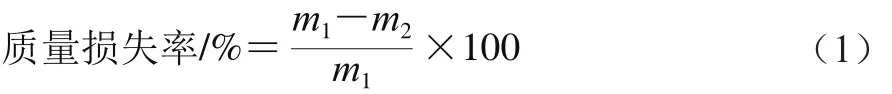
式中:m1为果实初始质量/g;m2为果实贮藏后质量/g。
1.3.4.2 呼吸强度的测定
参照寇晓虹等[22]的方法,采用果蔬呼吸仪进行测定。先测得空呼吸室内的CO2及O2的体积分数,然后将果实放入呼吸室内,达到平衡时读取此时的CO2和O2的体积分数。气体流速500 mL/min。各处理用果实10 个,重复3 次,取平均值。
1.3.4.3 果实乙烯释放量的测定
乙烯释放量测定参照Biswas等[23]的方法并进行修改。随机取4 个果实放入2 L干燥器中密封4 h,然后抽取1 mL混合气体注入气相色谱仪测定乙烯释放量/(μL/(kg·h))。
色谱条件:DM-5色谱柱,汽化室温度1 200 ℃,柱温60 ℃,氢气流量30 mL/min,空气流量400 mL/min,氮气流量25 mL/min,氢火焰离子化检测器检测,检测室温度150 ℃。
1.3.5 品质指标的测定
1.3.5.1 硬度的测定
采用果蔬硬度计测定。果实最大直径处去皮后均匀选3 个点测定,每个处理用果实10 个,每处理重复3 次。
1.3.5.2 可溶性固形物含量的测定
参照曹建康等[24]的方法,采用数显折光仪测定果实贮藏期间果肉可溶性固形物(total soluble solids,TSS)含量。果实最大直径处均匀选3 个点测定,每个处理用果实10 个,重复3 次。
1.3.5.3 色差的测定
参照de Aquino等[25]的方法并稍作修改。在果实赤道部位均匀选取3 个部位,用色度计直接在果实表面测定颜色参数,根据公式(2)计算色差。每个处理用果实10 个,重复3 次。
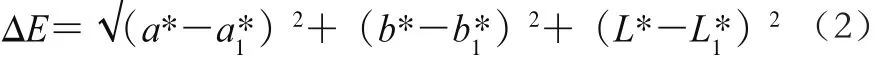
式中:ΔE为色差;a1*为样品原始红绿值;b1*为样品原始黄绿值;L1*为样品原始亮度值;a*为样品贮藏期间测定的红绿值;b*为样品贮藏期间测定的黄绿值;L*为样品贮藏期间测定的亮度值。
1.4 数据处理
所有实验数据采用Excel 2010计算标准偏差并作图,用DPS 7.05数据处理系统进行Duncan多重差异显著分析。
2 结果与分析
2.1 采后外源多胺处理对杏果实黑斑病的控制效果
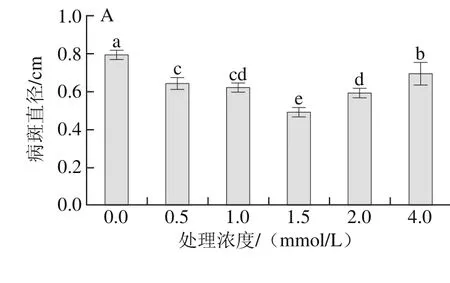
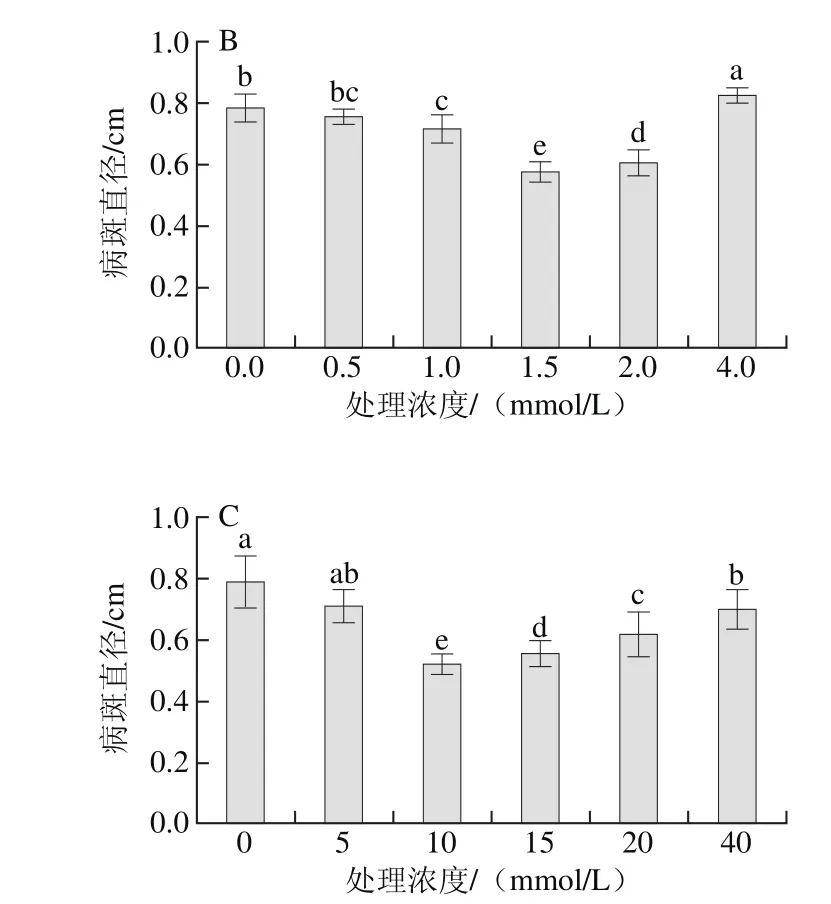
图1 外源精胺(A)、亚精胺(B)和腐胺(C)处理对杏果实黑斑病的控制效果Fig. 1 Controlling effect of exogenous spermine (A), spermidine (B)and putrescine (C) treatment on black spot of apricot fruits
由图1可知,外源不同浓度精胺、亚精胺和腐胺处理杏果实后常温条件下贮藏24 h,再损伤接种黑斑病菌A. alternata,放置3 d后发现多胺能显著提高果实抗性并有效抑制杏果实黑斑病的扩展,且随处理浓度的增加,其病斑直径呈现先下降后升高的趋势。其中1.5 mmol/L的精胺和亚精胺、10 mmol/L腐胺的抑制效果显著好于对照组及其他处理组(P<0.05),3 d时其病斑直径分别为0.49、0.58 cm和0.52 cm,较对照组分别减少了38.0%、26.6%和34.2%。这一结果与尚庆茂等[15]在黄瓜幼苗上的研究结果一致,他们同样发现,多胺处理后黄瓜幼苗灰霉病的病情指数较对照组降低了25.4%,且处理组的苯丙氨酸解胺酶、过氧化物酶和多酚氧化酶等防御相关酶活性及总酚等物质含量均显著提高。刘长命等[26]在研究多胺类物质对甜瓜植株抵抗白粉病菌(Podosphaera xanthii)侵染的作用机理中发现,抗性甜瓜品种在接种白粉病菌48 h后,一些抗性基因出现快速上调,且感染叶片病情指数显著降低,同时还发现多胺处理影响了植物活性氧代谢及内源多胺的代谢。本实验同时发现超过最佳浓度(精胺1.5 mmol/L、亚精胺1.5 mmol/L、腐胺10 mmol/L)后,随着多胺处理浓度的增加,果实病斑直径反而逐渐增大,表明多胺对果实抗病性的诱导及病害抑制存在最适的处理浓度。
2.2 采后外源多胺处理对杏果实贮藏品质及生理特性的影响
2.2.1 采后多胺处理对杏果实质量损失率的影响
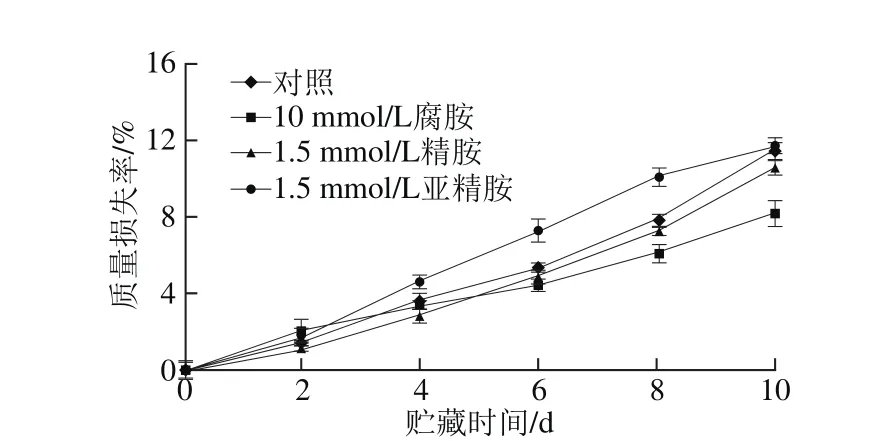
图2 外源多胺处理对杏果实质量损失率的影响Fig. 2 Effect of exogenous polyamine treatment on weight loss percentage of apricot fruits
由图2可知,杏果实贮藏期间,所有处理组的杏果实质量损失率均随贮藏时间的延长逐渐增大,除亚精胺处理组外,外源多胺处理的杏果实质量损失率在贮藏4 d后均低于对照组。贮藏第10天时,腐胺处理的杏果实质量损失率仅为8.2%,显著低于对照组(11.5%)及其他多胺处理组,较对照组降低了28.3%;而精胺处理的杏果实质量损失率与对照组差异不明显,可见不同种类不同浓度多胺处理对杏果实贮藏期间水分蒸腾的影响存在差异。
2.2.2 采后外源多胺处理对杏果实贮藏期呼吸强度的影响
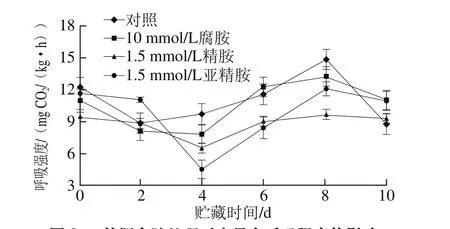
图3 外源多胺处理对杏果实呼吸强度的影响Fig. 3 Effect of exogenous polyamine treatment on respiration intensity of apricot fruits
由图3可知,杏果实贮藏期间,所有处理组果实的呼吸强度随着时间的延长均呈现先下降后上升再下降的趋势,外源多胺处理虽未延迟果实呼吸高峰出现的时间,但总体上有效地抑制了果实呼吸强度的增加。在贮藏第8天时,对照组和处理组的果实呼吸强度均达到了高峰值,其中对照组的果实呼吸强度高达14.84 mg CO2/(kg·h),而腐胺、精胺和亚精胺处理组的果实呼吸强度仅分别为13.31、9.67、12.10 mg CO2/(kg·h),较对照组分别降低了10.3%、34.8%和18.5%。王颉等[27]在鸭梨上也发现50 µg/L精胺和50 µg/L亚精胺对贮藏期间鸭梨的呼吸强度具有显著的抑制作用。
2.2.3 采后多胺处理对杏果实贮藏期乙烯释放量的影响由图4可知,处理组和对照组杏果实贮藏期间乙烯释放量均呈现先上升后下降的趋势,且在第6天出现乙烯释放高峰。外源多胺处理能有效地抑制杏果实乙烯的释放量。贮藏第6天时对照组果实的乙烯释放量已高达35.24 μL/(kg·h),而腐胺、精胺和亚精胺处理组果实的乙烯释放量仅分别为32.34、33.11、31.75 μL/(kg·h),分别较对照降低了8.2%、6.0%和9.9%。这与王颉等[27]在鸭梨上的研究结果一致,同时Ke等[28]发现多胺抑制剂甲基乙二醛双脒腙能显著促进梨果果实的乙烯释放量,进一步证明了多胺能抑制果实贮藏期间乙烯释放。
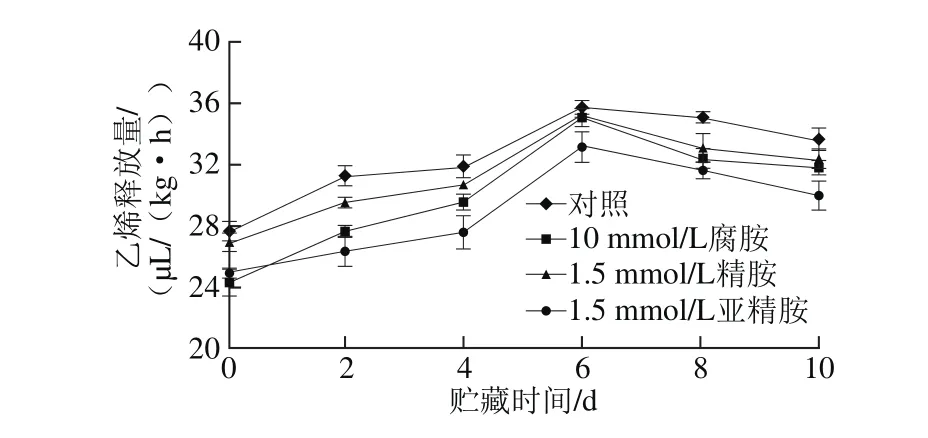
图4 外源多胺处理对杏果实乙烯释放量的影响Fig. 4 Effect of exogenous polyamine treatment on ethylene release from apricot fruits
2.2.4 采后多胺处理对杏果实硬度的影响
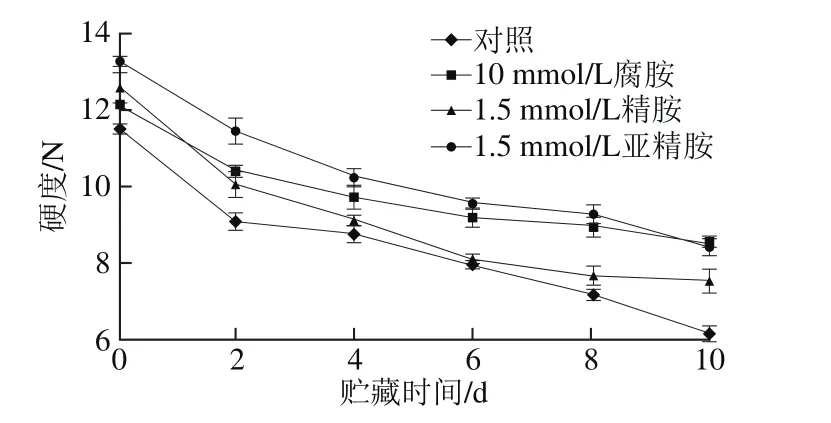
图5 外源多胺处理对杏果实硬度的影响Fig. 5 Effect of exogenous polyamine treatment on apricot fruit ベrmness
由图5可知,在整个常温贮藏期间,对照组和所有处理组杏果实硬度随贮藏时间的延长呈逐渐下降趋势,相比对照组,不同种类多胺处理明显延缓了贮藏期间杏果实硬度的降低,尤其10 mmol/L腐胺和1.5 mmol/L亚精胺的延缓作用最为明显,在贮藏第10天时腐胺和亚精胺处理组果实硬度为8.44 N和8.46 N,均为对照组的1.4 倍左右。这与Wang等[10]用精胺处理‘红元帅’苹果抑制了果实软化的结果相类似,同样研究发现精胺和亚精胺处理能有效延缓鸭梨果实硬度的降低,其进一步分析发现多胺处理能够显著抑制鸭梨果等多聚半乳糖醛酸酶和羧甲基纤维素酶活性的升高[27],表明外源多胺可通过调节果实细胞壁代谢酶活性而维持果实硬度[29-31]。
2.2.5 采后多胺处理对杏果实TSS含量的影响
TSS是影响果实风味的一个主要因素。由图6可知,在杏果实常温贮藏期间,处理组及对照组果实TSS含量均随着时间的延长呈现先上升后下降的趋势,且处理组的TSS含量均显著低于对照组,贮藏第10天时,对照组TSS含量达10.08%,比0 d(11.37%)降低了11.3%,而腐胺、精胺和亚精胺处理组在贮藏第10天时,TSS含量分别为9.46%、9.66%和9.12%,与贮藏初期(腐胺处理组10.75%、精胺处理组10.54%、亚精胺处理组10.29%)相比,分别降低了12.0%、8.3%和11.4%。而王颉等[27]研究发现,经多胺处理后,鸭梨的TSS含量在贮藏后期高于对照组,此现象与本实验结果不一致,可能是外源多胺对果实碳水化合物代谢的调控因果实品种而异。
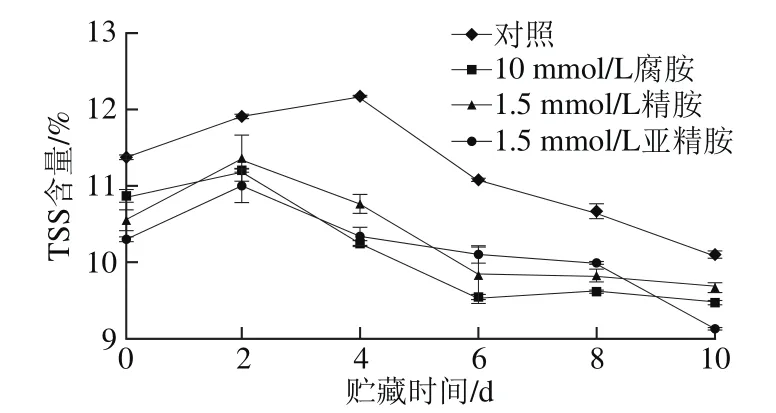
图6 外源多胺处理对杏果实TSS含量的影响Fig. 6 Effect of exogenous polyamine treatment on total soluble solid content of apricot fruits
2.2.6 采后多胺处理对杏果实货架期色泽的影响
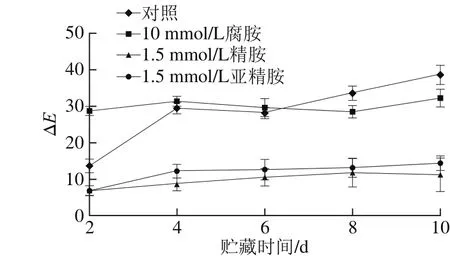
图7 外源多胺处理对货架期杏果实色泽的影响Fig. 7 Effect of exogenous polyamine treatment on color difference of apricot fruits
如图7所示,不同多胺处理杏果实后其色差变化的趋势均是逐渐增加。相比对照组,多胺处理后的杏果实色差值变化比较缓慢,总体趋势变化一致。在贮藏第10天时,腐胺、精胺和亚精胺处理组果实色差值分别为32.25、11.30和14.40,较对照组色差值38.67,分别降低了16.6%、70.8%和62.8%。可见外源多胺能有效维持贮藏期间杏果实的色泽,但其控制机理尚需进一步研究。
3 结 论
外源多胺处理能显著抑制杏果实黑斑病的扩展,有效提高果实的抗病性。其中1.5 mmol/L精胺、1.5 mmol/L亚精胺和10 mmol/L腐胺效果最佳,贮藏3 d后其病斑直径仅分别为0.49、0.58 cm和0.52 cm,较对照组分别减少了38.0%、26.6%和34.2%。同时外源多胺处理能够明显抑制杏果实呼吸强度的升高和减少乙烯的释放量,延缓果实衰老;并且有效地降低果实质量损失率,延缓果实硬度下降,抑制TSS含量降低,有效地保持了果实的贮藏品质。
[1] 符勇, 郜海燕, 周拥军, 等. 杏采后生理及品质保持技术研究概况[J]. 浙江农业科学, 2012(5): 725-729. DOI:10.16178/j.issn.0528-9017.2012.05.005.
[2] 陈亚敏, 陈复生, 杨宏顺, 等. 杏采后的品质变化及保鲜技术的研究进展[J]. 食品科技, 2012, 37(5): 26-30. DOI:10.13684/j.cnki.spkj.2012.05.054.
[3] 王春艳, 田金强, 王强. 杏贮藏加工技术研究进展[J]. 果树学报, 2010,27(6): 995-1001. DOI:10.13925/j.cnki.gsxb.2010.06.006.
[4] 刁春英, 毕阳, 李永才. 壳聚糖对互隔交链孢菌(Alternaria alternata)的离体抑制作用[J]. 中国农学通报, 2010, 26(10): 91-94.
[5] GONZALEZ G A, VILLA-RODRIGUEZ A J, AYALA-ZAVALA F J, et al. Improvement of the antioxidant status of tropical fruits as a secondary response to some postharvest treatments[J]. Trends in Food Science &Technology, 2010, 21(10): 475-482.
[6] YIU J C, JUANG L D, FANG Y T, et al. Exogenous putrescine reduces flooding-induced oxidative damage by increasing the antioxidant properties of Welsh onion[J]. Scientia Horticulturae, 2009, 120(3): 306-314. DOI:10.1016/j.scienta.2008.11.020.
[7] TANOU G, ZIOGAS V, BELGHAZI M, et al. Polyamines reprogram oxidative and nitrosative status and the proteome of citrus plants exposed to salinity stress[J]. Plant, Cell and Environment, 2014, 37(4): 864-865.DOI:10.1111/pce.12204.
[8] BOTH V, THEWES F R, BRACKMAN A, et al. Effect of low oxygen conditioning and ultralow oxygen storage on the volatile profile, ethylene production and respiration rate of ‘Royal Gala’apples[J]. Scientia Horticulturae, 2016, 209(19): 156-164. DOI:10.1016/j.scienta.2016.06.028.
[9] KRAMER G F, WANG C Y, CONWAY W S. Correlation of reduced softening and increased polyamine levels during low oxygen storage of‘McIntosh’ app1e[J]. Journal of the American Society for Horticultural Science, 1989, 114(6): 942-946.
[10] WANG C Y, JI Z L. Effect of low oxygen storage on chilling injury and polyamines in Zucchini squash[J]. Scientia Horticulturae, 1989, 39(1): 1-7.DOI:10.1016/034-4238(89)90031-9.
[11] KRAMER G F, WANG C Y. Correlation of reduced chilling injury and oxidative damage with increased spermine and spermidine levels in zucchini squash[J]. Physiologia Plantarum, 1989, 76(4): 479-484.DOI:10.1111/j.1399-3054.1989.tb05466.x.
[12] CASAS J L, ACOSTA M, RIO J A D, et al. Ethylene evolution during ripening of detached tomato fruit: its relation with polyamine metabolism[J]. Plant Growth Regulation, 1990, 9(2): 89-96. DOI:10.1007/BF00027436.
[13] ZHANG W P, JIANG B, LI W G, et al. Polyamines enhance chilling tolerance of cucumber (Cucumis sativus L.) through modulating antioxidative system[J]. Scientia Horticulturae, 2009, 122(2): 200-208.DOI:10.1016/j.scienta.2009.05.013.
[14] SHEN W Y, NADA K, TACHIBANA S. Involvement of polyamines in the chilling tolerance of cucumber cultivars[J]. Plant Physiology, 2000,124(1): 431-439. DOI:10.1104/pp.124.1.431.
[15] 尚庆茂,张志刚. 亚精胺对黄瓜幼苗灰霉病的诱抗作用[J]. 应用生态学报, 2008, 19(4): 825-830. DOI:10.13287/j.1001-9332.2008.0211.
[16] 于力, 郭世荣, 阎君, 等. 亚精胺诱导黄瓜幼苗对白粉病抗性的研究[J]. 西北植物学报, 2012, 32(7): 1384-1389. DOI:10.3969/j.issn.1000-4025.2012.07.016.
[17] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 25-27.
[18] 李永才. 碳酸盐和碳酸氢盐对鸭梨采后黑斑病和青霉病的控制研究[J]. 食品科技, 2007, 32(1): 185-188. DOI:10.13684/j.cnki.spkj.2007.01.058.
[19] 刘红霞, 毕阳, 郭玉蓉, 等. 采后浸泡或真空渗透钙、钡、镁对金矮生苹果青霉病的影响[J]. 甘肃农业大学学报, 1998, 33(4): 404-408.DOI:10.13432/j.cnki.jgsau.1998.04.016.
[20] MOSCOSO-RAMIREZ P A, MONTESINOS-HERRERO C, PALOU L, et al. Characterization of postharvest treatments with sodium methylparaben to control citrus green and blue molds[J]. Postharvest Biology and Technology, 2013, 77(2): 128-137. DOI:10.1016/j.postharvbio.2012.10.007.
[21] 高春丽, 李永才, 毕阳, 等. 采后亚硒酸钠处理对杏果黑斑病的控制及贮藏品质的影响[J]. 食品科学, 2016, 37(14): 258-263.DOI:10.7506/spkx1002-6630-201614047.
[22] 寇晓虹, 王文生, 吴彩娥, 等. 鲜枣冷藏过程中生理生化变化的研究[J]. 中国农业科学, 2000, 33(6): 44-49. DOI:10.3321/j.issn:0578-1752.2000.06.008.
[23] BISWAS P, EAST A R, BRECHT J K, et al. Intermittent warming during low temperature storage reduces tomato chilling injury[J]. Postharvest Biology and Technology, 2012, 74(4): 71-78.
[24] 曹建康, 姜微波. 柠檬酸处理对鸭梨果实贮藏特性的影响[J]. 食品科技, 2005, 26(10): 84-87.
[25] DE AQUINO A B, BLANK A F, DE AQUINO SANTANA L C L.Impact of edible chitosan-cassava starch coatings enriched with Lippia gracilis Schauer genotype mixtures on the shelf life of guavas (Psidium guajava L.) during storage at room temperature[J]. Food Chemistry,2015, 171: 108-116.
[26] 刘长命, 杨瑞平, 莫言玲, 等. 外源Spd预处理对甜瓜白粉病抗性及其内源多胺的诱导分析[J]. 西北植物学报, 2016, 36(1): 85-92.DOI:10.7606/j.issn.1000-4025.2016.01.0085.
[27] 王颉, 李里特, 丹阳, 等. 多胺处理对鸭梨采后生理的影响[J]. 食品科学, 2003, 24(7): 141-147. DOI:10.3321/j.issn:1002-6630.2003.07.035.
[28] KE D, ROMANI R J. Effect spermidine on ethylene production and the senescence of suspension-cultured pear fruit cells[J]. Plant Physiology and Biochemistry, 1988, 26(2): 109-116.
[29] 赵云峰, 林瑜, 林河通. 细胞壁组分变化与果实成熟软化的关系研究进展[J]. 食品科技, 2012, 37(12): 29-33. DOI:10.13684/j.cnki.spkj.2012.12.002.
[30] 齐秀东, 李海山, 魏建梅, 等. 采后嘎拉苹果果实细胞壁代谢及关键酶基因表达特性研究[J]. 华北农学报, 2012, 27(2): 55-60.DOI:10.3969/j.issn.1000-7091.2012.02.011.
[31] 阚娟, 刘涛, 金昌海, 等. 硬溶质型桃果实成熟过程中细胞壁多糖降解特性及其相关酶研究[J]. 食品科学, 2011, 32(4): 268-274.
