不同解冻方式对软儿梨果实品质与抗氧化物质含量的影响
2018-02-28马朝玲丁若珺魏永波
张 忠,马朝玲,2,丁若珺,毕 阳,*,王 毅,魏永波
软儿梨,又名消梨、冻梨,属于秋子梨(Pyres ussuriensis Maxim.)系统的主要品种,主要分布在青海、甘肃、宁夏黄河沿岸及甘肃河西走廊等地[1]。软儿梨果形扁圆,形体较小,极耐寒、抗性强,能够适应和抵御各种自然灾害。软儿梨树产果效率高,是具有地方特色的优质梨树。软儿梨一般在九月下旬至十月上旬采收,采收后虽然可食用,但品质不佳,常需后熟后方可食用。软儿梨属于呼吸跃变型果实,通常在室温下经一段时间的后熟后,果实品质显著提升。乙烯利是一种人工合成的植物生长调节剂,能与水或含羟基化合物反应放出乙烯,乙烯作为一种天然植物激素,在跃变型果实成熟衰老过程中发挥重要作用[2]。乙烯利可用于加快呼吸跃变型果实后熟[3-4],提升果实颜色[5]。目前乙烯利已在包括猕猴桃[6]、番茄[7]、芒果[8]和沙梨[9]等多种果实上应用以降低果实硬度,提高成熟度。
与大多数梨的消费形式不一样,地处西北的软儿梨产区的消费者通常将完成后熟的软儿梨进行冷冻,便于贮藏的同时,也提升了果实的食用品质和口感。将经过后熟的果实常进行冻藏,冻藏过程中肉质变成褐色,解冻后果实汁液丰盈,营养丰富,酸甜可口,同时有清肺醒酒的功效[10]。冷冻与解冻对软儿梨果实采后品质形成具有极其重要的作用,传统上消费者解冻软儿梨果实的主要方式包括室温下放置解冻和饮用水水浴解冻两种。上述两种解冻方式的解冻速率不同,同时对果实的品质和卫生等指标产生的影响也不同,而现有文献中对此鲜见报道。以软儿梨为原料,通过测定比较自然后熟与乙烯利催熟后软儿梨果实的品质指标、酚类物质含量和抗氧化能力的变化,探讨两种传统的解冻方式对软儿梨果实品质的不同影响,以期为软儿梨的采后品质控制及加工消费提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
软儿梨于2015年10月采自兰州市皋兰县什川镇,果实商业成熟度采收,装入塑料筐内当天运至本实验室,于(20±3)℃、相对湿度85%~90%条件下贮藏待用。
乙烯利 四川国光农化股份有限公司;标准品(熊果苷、绿原酸、(+)-儿茶素、阿魏酸、咖啡酸、表儿茶素、对香豆酸、芦丁)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 美国Sigma公司。
1.2 仪器与设备
PAL-BX/RI手持折光仪 日本Atago公司;SP60色差计 美国爱色丽公司;UV-2450紫外-可见分光光度仪日本岛津公司;7820A气相色谱仪、1100高效液相色谱仪美国安捷伦科技有限公司;3K30高速冷冻离心机德国Sigma公司;SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司。
1.3 方法
1.3.1 乙烯利催熟处理
实验所用软儿梨运往实验室后,挑选大小、色泽均匀,成熟度一致、无机械损伤和病虫害的果实,用体积分数0.1%的乙烯利浸泡1 min,清水浸泡作为对照,浸泡后晾干果实,立即放入温度(20±3)℃、相对湿度85%~90%的恒温培养箱内,密闭贮藏24 h后打开恒温培养箱进行通风,在之后的16 d内,每天早、中、晚各通风一次,每次通风10 min。
1.3.2 果实冷冻与解冻
将后熟至糖度达到15%的软儿梨果实装入塑料筐内,放入-20 ℃的冰柜中进行冷冻。完全冻结后的果实分别用水浴解冻(10 ℃)和空气解冻两种方式进行解冻,待软儿梨完全解冻后,测定各指标。
1.3.3 果实品质指标的测定
水浴解冻的果实在解冻0.5(解冻初期)、1.0(解冻中期)、1.5 h(完全解冻)取样测定,空气解冻果实在2(解冻初期)、4(解冻中期)、6 h(完全解冻)取样测定。每组用果实9 个,重复3 次。
1.3.3.1 可溶性固形物含量的测定
可溶性固形物(total soluble solid,TSS)含量参照王静等[11]的方法,采用GY-4型手持折光仪测定。在取样当天将梨果实沿赤道部位切开,在其可食部分均匀取3 处果肉组织,将汁液滴于折光仪上,读取并记录数据。
1.3.3.2 可滴定酸含量的测定
可滴定酸(titratable acidity,TA)含量的测定参考曹建康等[12]的方法并略作修改。称取10.0 g果实置于研钵中磨碎,转移到100 mL容量瓶中,用双蒸水定容至刻度线,摇匀,静置30 min后过滤。吸取20.0 mL滤液,转入锥形瓶中,加入2 滴1 mg/100 mL的酚酞,用0.01 mol/L NaOH溶液进行滴定,滴定至溶液初显粉色并在0.5 min内不褪色,记录消耗NaOH溶液的体积。以双蒸水代替滤液作为空白对照,重复测定3 次,以苹果酸溶液为标品绘制NaOH溶液的体积-苹果酸质量浓度标准曲线:y=0.013x-0.001(R2=0.999)。根据式(1)进行计算。
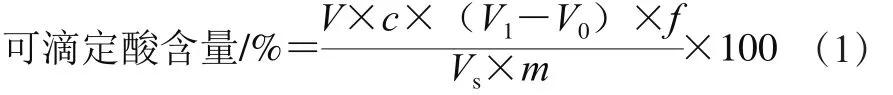
式中:V为所取样品提取液体积/mL;Vs为滴定时所取滤液体积/mL;c为滴定时所用NaOH溶液的浓度/(mol/L);V1为滴定滤液消耗NaOH溶液的体积/mL;V0为滴定蒸馏水消耗NaOH溶液的体积/mL;m表示样品质量/g;f为折算系数/(g/mmol),本实验为0.067(以苹果酸折算)。
1.3.3.3 还原糖含量的测定
参照曹建康等[12]的方法采用3,5-二硝基水杨酸法测定。绘制的葡萄糖标准曲线,得到回归方程为:y=0.84x+0.023(R2=0.997),其中x为葡萄糖溶液质量浓度/(mg/mL),y为510 nm波长处的吸光度。
还原糖的提取:准确称取2.0 g果实组织于研钵中,加入少量蒸馏水。研磨匀浆后转入到25 mL刻度试管中,冲洗研钵,一并转入到试管中,补加蒸馏水至25 mL刻度处,在80 ℃恒温水浴中保温30 min,使还原糖浸出。取出冷却后,过滤浸提液,用20 mL蒸馏水洗涤残渣,再过滤。将2 次滤液全部收集在100 mL的容量瓶中,定容至刻度,混匀后作为还原糖提取液备用。
还原糖含量测定:取10 mL离心管,分别加入0.75 mL还原糖提取液和0.75 mL 3,5-二硝基水杨酸试剂,摇匀,在沸水中加热5 min。取出后立即放入盛有冷水的烧杯中冷却至室温,再以蒸馏水定容至10 mL刻度处,在510 nm波长处测定吸光度,以蒸馏水代替提取液作为空白,重复测定3 次,按式(2)进行计算。
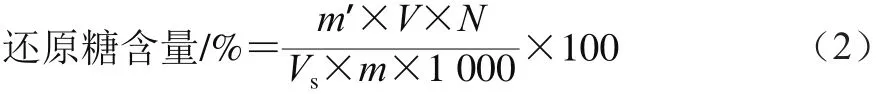
式中:m’为从标准曲线上查得的葡萄糖质量/mg;V为样品总体积/mL;N为样品提取液稀释倍数;Vs为测定时所取样品提取液体积/mL;m为样品质量/g。
1.3.3.4 VC含量的测定
参照张立科等[13]方法并修改。准确称取3.0 g果肉于研钵中,加入2 mL、体积分数1%的盐酸,研钵成匀浆,加2 mL双蒸水,10 000 r/min离心10 min。取0.5 mL上清液,加入盛有0.5 mL、体积分数10%盐酸的离心管中,再加入2 mL双蒸水,混匀,以双蒸水为空白,在243 nm波长处测定吸光度。以还原型抗坏血酸为标准品,绘制标准曲线:y=0.013x-0.001(R2=0.997),按式(3)计算样品中VC含量。
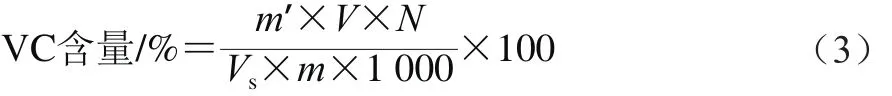
式中:m’为从标准曲线上查得的抗坏血酸质量/mg;V为样品总体积/mL;N为样品提取液稀释倍数;Vs为测定时所取样品提取液体积/mL;m为样品质量/g。
1.3.3.5 石细胞含量的测定
参照聂继云等[14]的方法并修改,采用冷冻法提取石细胞。用削皮刀削去果实外皮,然后纵切4瓣,剔除果心及周围石细胞密集部位。将削好的果肉混在一起后分成3 份,每份100 g。在-20 ℃冰柜中冷冻24 h后取出解冻,并在搅拌机中以2 000 r/min的转速匀浆3 min。将匀浆转移至1 000 mL烧杯中。加水至800 mL,用玻璃棒搅拌1 min,静置3 min,倾出上层悬浮液。如此反复漂洗3~4次。收集沉淀并用粗滤纸过滤得石细胞。将石细胞铺开连同滤纸,于烘箱(60~65 ℃)中烘2 h,取出,干燥器中冷却至室温。收集石细胞,称质量,精准到1 mg,并计算平均数。
1.3.4 抗氧化能力的测定
在果实完成后熟(16 d)、空气解冻完成解冻(6 h)和水浴解冻完成解冻(1.5 h)的3 个工艺点,对乙烯利处理组果实和对照组果实进行抗氧化能力和主要酚类物质的测定。
1.3.4.1 酚类物质的提取
参考袁江等[15]的方法并作修改。取冷冻果肉粉末60 g,加入丙酮30 mL,40 kHz 超声波提取10 min,8 500 r/min离心20 min后,取上清液;残渣重复上述操作2 次,合并上清液,于35 ℃下用氮气吹干去除丙酮;剩余液体用1 mol/L的NaOH溶液调至pH 7.0,转移至梨形分液漏斗中,每次加入等体积(20 mL)乙酸乙酯萃取,分离出酯相,重复1 次;余下的水相用1 mol/L的盐酸溶液调至pH 2.0,再以等体积(20 mL)乙酸乙酯萃取3 次,合并酯相;酯相于35 ℃下氮气吹干后,用2 mL色谱级甲醇溶解附于离心管内部的萃取物,并用有机滤膜(0.2 μm)过滤后即得到酚类物质提取液,保存于-20 ℃冰箱备用。
1.3.4.2 总酚含量的测定
参考Dewanto等[16]的方法,并略作改进。吸取0.125 mL酚类物质提取液,加0.5 mL蒸馏水和0.125 mL福林-肖卡试剂,涡旋混合后室温静置反应6 min,再加入1.25 mL、7 g/100 mL的Na2CO3溶液和1 mL蒸馏水,室温避光条件下静置反应90 min后,于760 nm波长处测其吸光度,并以0.125 mL甲醇代替提取液作为空白对照。配制不同质量浓度梯度的没食子酸标准品溶液,代替提取液,按上述步骤操作测定吸光度,绘制标准曲线,得回归方程为y=0.001x+0.031(R2=0.990)。总酚含量以每千克鲜样所含的没食子酸当量(gallic acid equivalents,GAE)表示,单位为mg GAE/kg。
1.3.4.3 总黄酮含量的测定
参考Jia Zhishen等[17]的方法,并略作改进。吸取0.3 mL酚类物质提取液,加入1.5 mL蒸馏水和0.09 mL、5 g/100 mL的NaNO2溶液,涡旋混合后室温静置反应5 min,加入0.18 mL、10 g/100 mL的AlCl3•6H2O溶液,混合后静置6 min,加入0.6 mL、1 mol/L NaOH溶液和0.33 mL蒸馏水,于510 nm波长处测其吸光度,并以0.3 mL甲醇代替提取液作为空白对照。配制不同质量浓度梯度的儿茶素标准品溶液,代替提取液,按上述步骤操作测定吸光度,绘制标准曲线,得回归方程为y=0.000 9x-0.001 2(R2=0.997 7),其中y为吸光度,x为儿茶素质量浓度/(mg/mL)。总黄酮含量以每千克鲜样所含的儿茶素当量(catechin equivalents,CE)表示,单位为mg CE/kg。
1.3.4.4 亚铁还原能力的测定
亚铁还原能力(fluorescence recovery after photobleaching,FRAP)值的测定参考Benzie等[18]的方法并略作修改。
工作液的配制:将300 mmol/L的醋酸钠缓冲液、20 mmol/L FeCl3•6H2O溶液和10 mmol/L的2,4,6-三(2-吡啶基)三嗪(2,4,6-tri(2-pyridyl)-S-triazine,TPTZ)溶液(准确称取0.312 3 g TPTZ,以40 mmol/L盐酸溶液定容至100 mL)按体积比10∶1∶1的比例混合,混匀后置于37 ℃的水浴锅中避光预热30 min备用,工作液的使用遵循现配现用原则。
测定步骤:取0.2 mL酚类物质提取液,加入2.8 mL工作液,混匀后室温避光静置反应30 min,于593 nm波长处测其吸光度,并以0.2 mL甲醇代替提取液作为空白对照。配制不同质量浓度梯度的Trolox(水溶性VE)标准品溶液,代替提取液,按上述步骤操作测定吸光度,绘制标准曲线,得回归方程为y=0.008x-0.052(R2=0.999)。FRAP值以每千克鲜样所含的Trolox当量(Trolox equivalents,TE)表示,单位为mg TE/kg。
1.3.4.5 ABTS+•清除能力的测定
参考Re等[19]的方法并略作调整。
ABTS工作液准备:将7 mmol/L的ABTS水溶液和一定量的过硫酸钾混合,使过硫酸钾的浓度达到2.45 mmol/L,室温避光条件下静置反应12 h后,用蒸馏水稀释至其在734 nm波长处的吸光度为(0.70±0.02),并于30 ℃水浴锅中避光预热30 min备用。
测定步骤:取0.15 mL稀释后的酚类物质提取液,加入3 mL ABTS工作液,混匀后室温避光静置反应30 min,于734 nm波长处测其吸光度Ai;同时以0.15 mL甲醇代替提取液作为空白对照,测其吸光度A0。配制不同质量浓度梯度的Trolox标准品溶液,代替提取液,按上述步骤操作测定吸光度,并按式(4)计算ABTS+·清除率,绘制清除率-Trolox质量浓度标准曲线,得回归方程为y=0.006x-0.251(R2=0.999)。
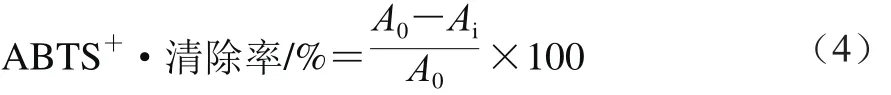
1.3.4.6 DPPH自由基清除能力的测定
参考Locatelli等[20]的方法并略作调整。
DPPH自由基工作液准备:配制70 nmol/L的DPPH甲醇溶液,保存于-20 ℃冰箱,使用前以纯甲醇稀释至其在515.5 nm波长处的吸光度为(0.70±0.02)后备用。
测定步骤:取0.2 mL稀释后的酚类物质提取液,加入2.8 mL DPPH自由基工作液,混匀后室温避光静置反应30 min,于515.5 nm波长处测其吸光度Ai;同时以0.2 mL甲醇代替提取液作为空白对照,测其吸光度A0。配制不同质量浓度梯度的Trolox标准品溶液代替提取液,按上述步骤操作测定吸光度,并按式(5)计算清DPPH自由基清除率,绘制清除率-Trolox质量浓度标准曲线,得回归方程为y=0.007x-0.031(R2=0.999)。
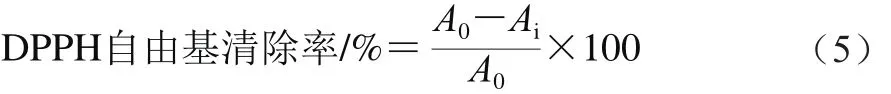
1.3.4.7 抗氧化能力综合指数的计算
引用抗氧化能力综合(antioxidant potency composite,APC)指数综合分析以上3 种方法测定的综合抗氧化能力。APC指数/%=(该方法测定值/该方法测定最大值)×100;APC指数均值=(方法1的APC指数+方法2的APC指数+……方法n的APC指数)/n。
1.3.4.8 不同酚类物质含量的测定
参考潘见等[21]的方法,采用高效液相色谱法测定。绿原酸、咖啡酸、阿魏酸、对香豆酸测定波长为323 nm,熊果苷、儿茶素、表儿茶素测定波长为297 nm。色谱条件:以乙腈(A)和体积分数1%乙酸(D)为流动相,Eclipse Plus C18色谱柱(4.6 mm×150 mm,5 μm),柱温为30 ℃,梯度洗脱程序为:0~5 min,85% D;5~7 min,80% D,流速均为1 mL/min;7 min,80% D,流速为0.6 mL/min;芦丁测定波长为358 nm,梯度洗脱条件为80% D,流速为1 mL/min,7 min,进样体积为20 μL。
1.4 数据处理
用Excel 2007软件处理数据和计算标准偏差,用SPSS 19.0软件进行方差分析和多重差异显著性分析。
2 结果与分析
2.1 解冻方式对软儿梨果实解冻期间品质的影响
2.1.1 解冻方式对解冻期间还原糖、TSS、TA含量和固酸比的影响
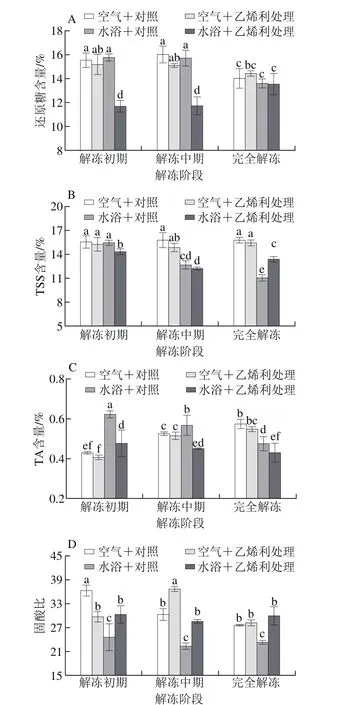
图1 不同解冻方式对自然后熟与乙烯利催熟的软儿梨果实解冻期间还原糖含量(A)、TSS含量(B)、TA含量(C)和固酸比(D)的影响Fig. 1 Effects of different thawing methods on the contents of reducing sugar (A), TSS (B) and TA (C) and TSS/TA ratio (D) of ethephon-treated and natural ripened ‘Ruan’er’ pears
空气解冻期间对照组和处理组果实的TSS含量均无显著性变化,水浴解冻期间,对照组果实TSS含量显著下降(P<0.05),处理组果实TSS含量先降低后升高,差异显著(图1B)(P<0.05)。完全解冻后,空气解冻的果实的TSS含量显著高于水浴解冻的果实,空气解冻后对照组和处理组之间无显著性差异,水浴解冻的处理组TSS含量比对照组高21%。
空气解冻期间,对照组和乙烯利处理组果实的TA含量均显著升高(P<0.05),且解冻时间相同时,两组间TA含量无显著性差异(P>0.05)。水浴解冻期间,对照组果实TA含量逐渐下降,处理组在不同解冻阶段无显著性变化(图1C)。完全解冻后,与解冻初期相比,空气解冻乙烯利处理组的果实的TA含量升高了33%,对照组果实水浴解冻降低了25%,解冻完成后,空气解冻果实显著高于水浴解冻,处理组与对照组之间无显著性差异。
对于空气解冻和水浴解冻期间,所有处理组果实的固酸比的变化不呈现规律性(图1D)。对照组果实水浴解冻后的固酸比显著低于其他3 组,其他3 组之间无显著性差异。
2.1.2 对解冻期间VC和石细胞含量的影响
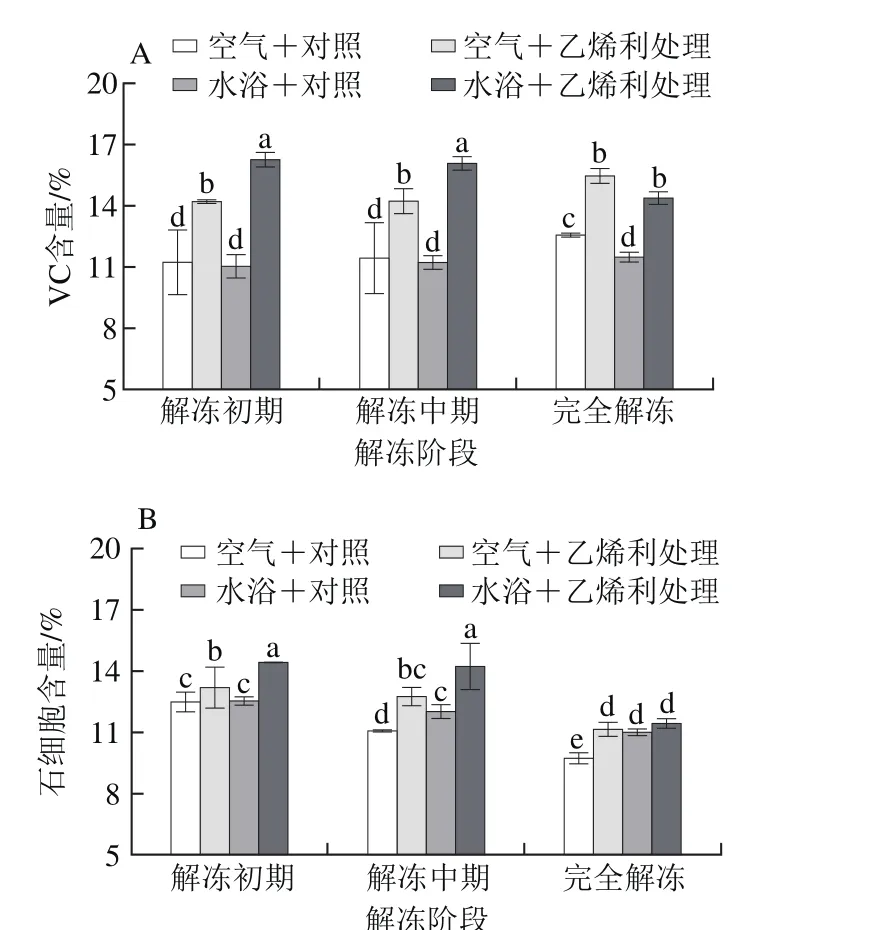
图2 不同解冻方式对自然后熟与乙烯利催熟的软儿梨果实解冻期间VC含量(A)和石细胞含量(B)的影响Fig. 2 Effects of different thawing methods on VC (A) and stone cell (B)contents in ethephon-treated and naturally ripened ‘Ruan’er’ pears
由图2A可知,水浴解冻期间,对照组果实的VC含量无显著变化(P>0.05),乙烯利处理果实在完全解冻后VC含量显著降低(P<0.05)。并且在同一解冻方式下,处理组果实VC含量显著高于解冻时间相同的对照组(P<0.05)。完全解冻后,空气解冻和水浴解冻的处理组分别比对照组高23%和25%,空气解冻对照组比水浴解冻对照组的VC含量高9%。
空气解冻和水浴解冻期间,处理组和对照组果实的石细胞含量均逐渐下降,解冻完成后,空气解冻的处理组和对照组较2 h时分别下降了25%和37%,水浴解冻的处理组和对照组较0.5 h时分别下降32%和21%,完全解冻后,空气解冻的对照组果实石细胞含量显著低于其他处理组(图2B)。
2.2 乙烯利处理及不同解冻方式对软儿梨抗氧化能力的影响
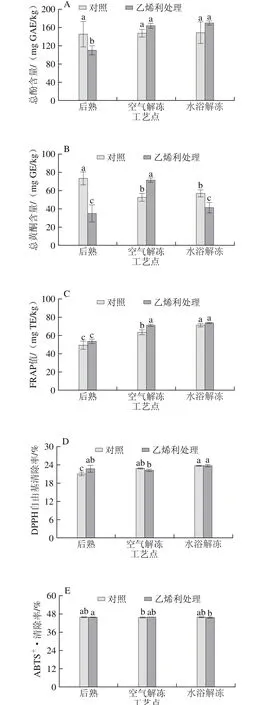
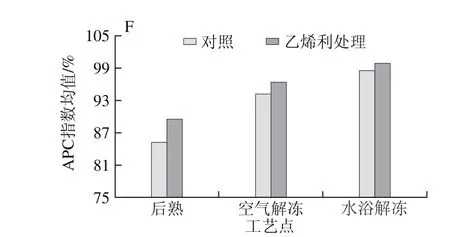
图3 不同解冻方式对自然后熟与乙烯利催熟的软儿梨果实抗氧化能力的影响Fig. 3 Effects of different thawing methods on antioxidant activity of ethephon-treated and naturally ripened ‘Ruan’er’ pears
乙烯利处理显著降低了软儿梨后熟后的总酚含量,解冻对对照组果实的总酚含量无显著性影响,显著提高了处理组果实的总酚含量;对于空气解冻和水浴解冻,解冻后处理组和对照组果实的总酚含量无显著性差异(P>0.05)(图3A);经两种方式解冻后,对照组总黄酮含量均显著降低,且无显著性差异(P>0.05);处理组经空气解冻后总黄酮含量较后熟后上升了104%,而经水浴解冻后的果实总黄酮含量与后熟后无显著差异(P>0.05)(图3B)。
后熟及水浴解冻后处理组和对照组的FRAP值均无显著性差异,与后熟后果实的FARP值相比,对照组果实经空气解冻和水浴解冻后分别提高了29%和45%,而处理组均提高35%(图3C);乙烯利处理组与对照组软儿梨果实在后熟后,空气解冻后和水浴解冻后的ABTS+•清除能力无显著差异(P>0.05)(图3D);与对照组相比,乙烯利处理组的软儿梨在后熟后的DPPH自由基清除能力提高了9%;解冻显著提高了对照组果实的DPPH自由基清除能力,空气解冻和水浴解冻分别提高了8.8%和13.0%,但对处理组果实无显著性影响(图3E)。
FRAP值、ABTS+•清除能力、DPPH自由基清除能力3 种方法测定的抗氧化能力差异较大,故引用APC指数均值判断后熟及解冻后的综合抗氧化能力,其APC指数均值介于85%~99%之间,不同处理阶段后的果实综合抗氧化能力排序为:水浴解冻>空气解冻>后熟,在后熟和解冻后均为:处理组果实>对照组果实。
2.3 乙烯利处理及不同解冻方式对软儿梨酚类物质含量的影响

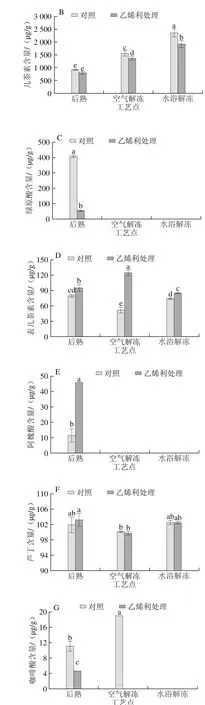
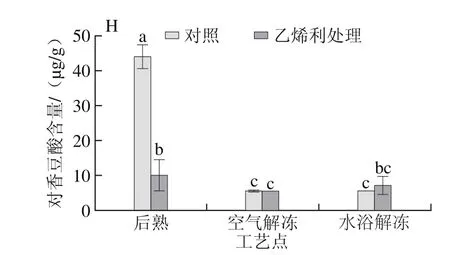
图4 不同解冻方式对自然后熟与乙烯利催熟的软儿梨果实不同酚类物质含量的影响Fig. 4 Effects of different thawing methods on phenolic compound contents in ethephon-treated and naturally ripened ‘Ruan’er’ pears
软儿梨果肉中含量较高的酚类物质主要有熊果苷、儿茶素和绿原酸(图4A~C),其中对照组经水浴解冻后熊果苷的含量最高,可达到6 mg/g。乙烯利处理略微降低了梨果实后熟后熊果苷和儿茶素含量,但差异不显著,乙烯利处理显著降低了后熟后果实绿原酸(图4C)、咖啡酸(图4G)和对香豆酸(图4F)的含量,较对照组果实分别降低了87%、58%和77%;乙烯利处理提高了软儿梨后熟期间阿魏酸(图4E)、表儿茶素(图4D)和芦丁(图4F)的含量,其中阿魏酸含量比对照组果实高3 倍。
经空气和水浴两种方式解冻后,未检测出绿原酸和阿魏酸,只在空气解冻对照组果实中检测到咖啡酸,且其含量较后熟时显著提高了71%,其他组果实中未检测出。两种解冻方式均提高了熊果苷和儿茶素的含量,水浴解冻后处理组和对照组的熊果苷含量较后熟后分别提高了26%和54%,并且显著高于空气解冻;处理组和对照组经空气解冻后儿茶素的含量较后熟后分别提高了72%和68%,水浴解冻后分别提高了1.4 倍和1.5 倍,对照组和处理组水浴解冻后的儿茶素含量均显著高于空气解冻后的(P<0.05);空气解冻显著提高了处理组果实的表儿茶素含量,降低了对照组果实的表儿茶素含量;解冻过程显著降低了对照组对香豆酸的含量,空气解冻和水浴解冻均降低了87%,空气解冻处理组果实降低了47%;在同一解冻方式下,乙烯利处理对芦丁含量的影响不显著。
3 讨 论
解冻是冷冻的逆过程,其目的是使已冷冻的食品内的冰晶融化,并尽可能保持果蔬原有的品质。目前实际生产中常用的解冻方法有传统解冻方法和新型解冻方法,传统方法主要为空气解冻和水浴解冻,新型方法包括超声波解冻、微波解冻[22]、高静水压解冻、真空解冻[23]等。解冻会影响果蔬的微观结构、色泽、营养物质含量等。Delgado等[24]通过扫描电子显微镜观察不同冻融温度下的草莓微观结构发现,解冻会破坏草莓细胞结构的完整性,并且快速解冻比慢速解冻能更好的保持产品品质。Holzwarth等[25]比较了-20 ℃冷冻后的草莓分别在4、20、37 ℃下解冻后果实色泽、VC、花青素和其他酚类物质含量的变化,发现20 ℃解冻有利于花青素保留,而4 ℃解冻的草莓中色素和VC损失最严重。因此解冻温度和解冻方式也能较大程度影响果蔬的品质。
在空气和水浴两种方式解冻过程中,除乙烯利处理组果实水浴解冻后期还原糖含量有所上升,其他果实的还原糖含量均在解冻过程中逐渐下降。冷冻过程中冰晶的形成会破坏果实细胞结构,从而导致在解冻过程中的汁液流失[26]。空气解冻对TSS含量无显著性影响,水浴解冻显著降低了处理组和对照组TSS含量,表明空气解冻能较好地维持软儿梨内TSS含量。空气解冻过程中TA含量逐渐上升,水浴解冻过程中TA含量逐渐下降,与芒果[27]、草莓[22]等果实解冻过程中的变化基本一致,可能与水浴解冻过程中水的作用有关,因为在水浴解冻时果实表面会形成一层较厚的冰层,在一定程度上限制了氧气与果实的充分作用。综合评价可以得出自然后熟果实空气解冻品质优于乙烯催熟空气解冻果实;自然后熟水浴解冻果实品质优于乙烯催熟水浴解冻果实。自然后熟软儿梨果实在水浴解冻过程中VC含量基本保持不变,乙烯利催熟果实水浴解冻时显著降低,但仍表现出处理组显著高于对照组。解冻方式对VC含量影响无明显的规律性,此结果与刘雪梅等[22]报道的水浴解冻较空气解冻延缓草莓VC含量下降不符,可能是由于果实差异所致。
石细胞是细胞次生细胞壁加厚而形成的实心体[28],两种解冻方式解冻时软儿梨的石细胞含量均逐渐下降。石细胞主要由木质素、纤维素和半纤维素组成的,通过苯丙烷代谢产生,有研究表明石细胞含量与苯丙烷解氨酶(phenylalanine ammonia-lyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)活性呈正相关[29]。解冻过程中石细胞含量下降可能是与这两种酶的活性有关,也可能是由于薄壁细胞分裂,膨大,关于石细胞与其他物质的关系还需进一步研究。石细胞的合成与PAL的活性有关,木质素和酚类物质均通过苯丙烷代谢产生,因此能得出乙烯利处理可能降低了软儿梨后熟过程中PAL的活性。然而马杰等[30]用外源乙烯利处理鲜切莴苣,发现乙烯利处理能提高PPO、过氧化物歧化酶等抗氧化酶活性,促使酚类物质和木质素的积累。
酚类物质作为果蔬中重要的次生代谢物质,在果蔬抗病、抗虫、抗逆等方面均具有重要作用[31],并具有良好的抗氧化等生理作用[32],因此,果蔬的抗氧化功效越来越受关注。目前,对苹果[33]、葡萄[34]、草莓[35]等的抗氧化活性研究较多,对梨的研究主要集中在比较不同品种和部位的酚类物质含量和抗氧化活性[32,36]。侯玉茹等[37]报道了软儿梨冷冻贮藏过程中不同部位酚类物质和抗氧化酶的活性变化,但鲜见乙烯利处理和不同解冻方式对软儿梨酚类物质和抗氧化能力影响的报道。软儿梨解冻过程中对照组果实总酚含量无明显变化,但乙烯利处理组果实在两种解冻方式下总酚含量均有不同程度的上升。可能是乙烯利虽然提高了软儿梨的抗氧化酶活性[38],但在解冻过程中温度有所升高后才发挥作用使总酚含量升高。
乙烯利处理组和对照组果实在后熟后均检测到绿原酸、阿魏酸、咖啡酸、儿茶素、表儿茶素、芦丁、对香豆酸和熊果苷,其中熊果苷含量最高,其次是儿茶素、绿原酸等,乙烯利处理显著降低了绿原酸和对香豆酸的含量,提高了阿魏酸含量,对其他酚类物质无明显影响。苯丙烷代谢是酚类物质产生的主要途径[39],也是木质素合成的主要途径[34],在木质素代谢过程中产生的副产物主要有肉桂酸、咖啡酸、香豆酸、阿魏酸、芥子酸,由以上石细胞含量分析乙烯利处理降低了软儿梨后熟后期的PAL活性,故影响了苯丙烷代谢,从而使绿原酸、对香豆酸和阿魏酸含量发生以上变化。经解冻后的果实未检测出绿原酸和咖啡酸。袁江[15]和邹丽红[40]等研究结果显示绿原酸与PPO的结合能力最强,是梨果实酶促褐变的主要底物,冷冻及解冻过程能增大细胞膜透性,使底物与PPO和氧气充分接触,故解冻后未检测出绿原酸。
乙烯利处理对软儿梨后熟期间的FRAP值、ABTS+·清除能力、DPPH自由基清除能力均无影响,解冻可提高处理组和对照组果实的FRAP值,提高对照组果实的DPPH自由基清除能力,对ABTS+·清除能力无影响,结果表明解冻提高了果实的抗氧化能力,乙烯利对解冻期间的抗氧化能力无影响。其原因可能是冷冻过程使梨果实受到冷胁迫,体内产生大量活性氧,能诱导其防御系统抗坏血酸过氧化物酶、过氧化氢酶等相关酶基因表达,提高抗氧化能力[41]。
总之,冷冻和解冻对软儿梨果实品质和抗氧化物质具有较大的影响;不同的解冻方式由于在完成解冻所需要的时间和期间果肉与氧的作用等方面存在差异,由此造成二者对软儿梨果实品质的影响也存在差异。空气解冻过程中果实的TA含量提高,较水浴解冻更多地保留了果实的还原糖和TSS含量,使果实具有较高的固酸比;同时使对照组果实保留了更多的VC,降低了石细胞含量。空气解冻对对照组果实的总酚含量无显著影响,但使处理组果实保留了更多的总黄酮;两种解冻方式对几种主要酚类物质的影响表现各异,但相似的是解冻后果实均不能测出绿原酸和阿魏酸。总体上空气解冻较水浴解冻能更好保持果实品质。
[1] 蒋钦任, 马雅美, 马永强, 等. 软儿梨冷冻贮藏过程生理指标的变化研究[J]. 北方园艺, 2013(3): 139-141.
[2] 张丽萍, 纪淑娟. 冷藏后不同处理对1-MCP处理南果梨酯类物质及乙烯合成关键酶的影响[J]. 食品科学, 2013, 34(24): 285-288.DOI:10.7506/spkx1002-6630-201324059.
[3] SINGH R, DWIVEDI U N. Eあect of Ethrel and 1-methylcyclopropene(1-MCP) on antioxidants in mango (Mangifera indica var. Dashehari)during fruit ripening[J]. Food Chemistry, 2009, 111(4): 951-956.DOI:10.1016/j.foodchem.2008.05.011.
[4] KORSAK T, YONGSEO P. Ethylene metabolism and bioactive compounds in ethylene-treated ‘Hayward’ kiwifruit during ripening[J].Horticulture Environment & Biotechnology, 2010, 51(2): 89-94.DOI:10.1016/j.scienta.2006.01.001.
[5] YANG X T, ZHANG Z Q, JOYCE D, et al. Characterization of chlorophyll degradation in banana and plantain during ripening at high temperature[J]. Food Chemistry, 2009, 114(2): 383-390. DOI:10.1016/j.foodchem.2008.06.006.
[6] ZHANG L H, LI S F, LIU X H, et al. Effects of ethephon on physicochemical and quality properties of kiwifruit during ripening[J].Postharvest Biology & Technology, 2012, 65(3): 69-75. DOI:10.1016/j.foodchem.2008.06.006.
[7] 李新峥, 孔瑾, 张建伟, 等. 乙烯利不同催熟方式对番茄品质影响[J].北方园艺, 2001(2): 23-25.
[8] THIBAULT N, MATHIEU L, MICHEL G, et al. Factors affecting ethylene and carbon dioxide concentrations during ripening: incidence on ベnal dry matter, total soluble solids content and acidity of mango fruit[J]. Journal of Plant Physiology, 2016, 196: 70-78. DOI:10.1016/j.jplph.2016.03.008.
[9] DHILLON W S, MAHAJAN B V C. Ethylene and ethephon induced fruit ripening in pear[J]. Journal of Stored Products & Postharvest Research, 2011, 2(3): 45-51.
[10] 郑淑霞. 青海软儿梨主产区资源调查[J]. 青海大学学报(自然科学版), 2008, 26(2): 68-70. DOI:10.13901/j.cnki.qhwxxbzk.2008.02.018.
[11] 王静, 张辉, 李学文, 等. 贮藏温度对货架期香梨品质和生理活性的影响[J]. 北方园艺, 2009(7): 231-235.
[12] 曹建康, 姜微波. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 88-29.
[13] 张立科, 田水泉, 谢太平, 等. 紫外可见分光光度法测定果蔬中的维生素C[J]. 河北化工, 2009, 32(1): 50-52.
[14] 聂继云, 李静, 杨振锋, 等. 冷冻法测定梨的石细胞含量[J]. 果树学报, 2006, 23(1): 133-135. DOI:10.13925/j.cnki.gsxb.2006.01.032.
[15] 袁江, 张绍铃, 曹玉芬, 等. 梨果实酚类物质与酶促褐变底物的研究[J]. 园艺学报, 2011, 38(1): 7-14. DOI:10.16420/j.issn.0513-353x.2011.01.006.
[16] DEWANTO V, WU X, ADOM K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural & Food Chemistry,2002, 50(10): 3010-3014. DOI:10.1021/jf0115589.
[17] JIA Zhishen, TANG Mengcheng, WU Jianming. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.DOI:10.1016/S0308-8146(98)00102-2.
[18] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”: the FRAP assay[J].Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[19] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology & Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[20] LOCATELLI M, GINDRO R, TRAVAGLIA F, et al. Study of the DPPH-scavenging activity: development of a free software for the correct interpretation of data[J]. Food Chemistry, 2009, 114(3): 889-897. DOI:10.1016/j.foodchem.2008.10.035.
[21] 潘见, 杨毅, 夏潇潇, 等. 高效液相色谱-串联质谱测定砀山酥梨中的酚类物质[J]. 食品科学, 2006, 27(12): 578-581.
[22] 刘雪梅, 孟宪军, 李斌, 等. 不同解冻方法对速冻草莓品质的影响[J].食品科学, 2014, 35(22): 276-281. DOI:10.7506/spkx1002-6630-201422054.
[23] 袁春新, 唐明霞, 王彪, 等. 解冻方法对冷藏部分玻璃态西兰花品质的影响[J]. 江苏农业学报, 2009, 25(3): 660-664.
[24] DELGADO A E, RUBIOLO A C. Microstructural changes in strawberry after freezing and thawing processes[J]. LWT-Food Science and Technology, 2005, 38(2): 135-142. DOI:10.1016/j.lwt.2004.04.015.
[25] HOLZWARTH M, KORHUMMEL S, CARLE R, et al. Evaluation of the effects of different freezing and thawing methods on color,polyphenol and ascorbic acid retention in strawberries ( Fragaria ×ananassa Duch.)[J]. Food Research International, 2012, 48(1): 241-248. DOI:10.1016/j.foodres.2012.04.004.
[26] 何娇. 冷冻对果蔬制品的影响[J]. 农产品加工, 2011(9): 11.
[27] 彭郁, 赵金红, 倪元颖. 不同解冻新技术对芒果品质的影响[J]. 食品工业, 2015, 36(6): 14-18.
[28] 乔勇进, 张绍铃, 陶书田, 等. 梨果实石细胞发育机理的研究进展[J]. 果树学报, 2005, 22(4): 367-371. DOI:10.13925/j.cnki.gsxb.2005.04.017.
[29] QUIDEAU S, DEFFIEUX D, DOUAT-CASASSUS C, et al.Plant polyphenols: chemical properties, biological activities, and synthesis[J]. Angewandte Chemie International Edition, 2011, 50(3):586-621. DOI:10.1002/anie.201000044.
[30] 马杰, 胡文忠, 毕阳, 等. 外源乙烯和茉莉酸甲酯处理对鲜切莴苣活性氧代谢的影响[J]. 食品工业科技, 2013, 34(17): 338-341.DOI:10.13386/j.issn1002-0306.2013.17.047.
[31] LATTANZIO V, LATTANZIO V M T, CARDINALI A, et al. Role of phenolics in the resistance mechanisms of plants against fungal pathogens and insects[J]. Phytochemistr, 2006, 37(2): 23-67.
[32] 李丽梅, 赵哲, 何近刚, 等. 不同品种梨果实酚类物质和抗氧化性能分析[J]. 食品科学, 2014, 35(17): 83-88. DOI:10.7506/spkx1002-6630-201417017.
[33] 丁秀玲, 张京芳, 韩明玉. 不同品种苹果化学成分及抗氧化活性比较[J]. 食品科学, 2011, 32(21): 41-47.
[34] PEINADO J, DE LERMA N L, PERALBO-MOLINA A, et al.Sunlight exposure increases the phenolic content in postharvested white grapes. an evaluation of their antioxidant activity in Saccharomyces cerevisiae[J]. Journal of Functional Foods, 2013, 5(4):1566-1575. DOI:10.1016/j.jあ.2013.06.007.
[35] 罗娅, 唐勇, 冯珊, 等. 6 个草莓品种营养品质与抗氧化能力研究[J].食品科学, 2011, 32(7): 52-56.
[36] 曾少敏, 杨健, 王龙, 等. 梨果实酚类物质含量及抗氧化能力[J]. 果树学报, 2014, 31(1): 39-44. DOI:10.13925/j.cnki.gsxb.2014.01.009.
[37] 侯玉茹, 李文生, 王宝刚, 等. 不同品种梨果实贮藏期间抗氧化活性及品质分析[J]. 食品工业科技, 2015, 36(2): 335-338. DOI:10.13386/j.issn1002-0306.2015.02.064.
[38] 张忠, 马朝玲, 丁若珺, 等. 采后乙烯利处理对软儿梨果实后熟期生理及品质的影响[J]. 食品科学, 2017, 38(21): 252-258. DOI:10.7506s pkx1002-6630-201721040.
[39] 叶梅. 植物组织褐变的研究进展[J]. 重庆工商大学学报(自然科学版), 2005, 22(4): 326-329.
[40] 邹丽红, 张玉星. 砂梨果肉褐变与酚类物质及相关酶活性的相关分析[J]. 果树学报, 2012, 29(6): 1022-1026. DOI:10.13925/j.cnki.gsxb.2012.06.017.
[41] 唐坚, 马丽, 王凯晨, 等. 冰温贮藏对生菜抗氧化能力及贮藏效果的影响[J]. 食品科学, 2015, 36(22): 255-259. DOI:10.7506/spkx1002-6630-201522048.
