不同成熟度橄榄果实冷藏期间细胞壁代谢对采后冷害的响应特性
2018-02-28孔祥佳任思琪林河通林毅雄卓司麒
孔祥佳,任思琪,林河通,*,李 旎,林毅雄,卓司麒
橄榄(Canarium album (Lour.) Raeusch)为橄榄科(Burseraceae)橄榄属(Canarium Linn.)常绿乔木植物,是中国南方亚热带特色药食兼用型果品[1-3]。橄榄果实含有丰富的生物活性成分和较高的药理作用,具有清热解毒、利咽化痰、抗菌消炎、抗氧化、解酒保肝、调节血脂、降血糖等功效[2-9]。福建是我国橄榄分布最多的省份,据统计,2005年福建省橄榄种植面积9 966 hm2,总产量33 714 t,至2015年福建省橄榄种植面积10 761 hm2,总产量88 601 t[10]。随着其种植面积和总产量增加,优质橄榄鲜果的种植收益和消费需求也不断提高,如何延长其贮藏保鲜期成为生产上亟待解决的问题。冷藏可延长橄榄果实的贮存期[11-12],但贮藏温度低于6 ℃时,橄榄果实易发生冷害,果实表面出现凹陷、褐变和水渍状斑点等,不仅降低其食用价值和商品性[11,13-14],还限制橄榄果实的供应期及其发展。因此,研究橄榄果实冷害发生的控制技术以延长其保鲜期具有重要意义。
前人研究表明,冷害导致果实的机能障碍可体现在质地的异常变化[15],而果实质地变化主要取决于果胶、纤维素、半纤维素等细胞壁组分含量以及果胶甲酯酶(pectin methylesterase,PME)、多聚半乳糖醛酸酶(polygalacturonase,PG)、β-半乳糖苷酶(β-galactosidase,β-Gal)和纤维素酶(cellulase,CEL)等细胞壁降解酶活性的变化[16-18];果实冷害时所表现出的表面凹陷、水渍状、果肉絮败、木质化、极度软化等质地变化都与细胞壁物质代谢异常有关,这已在黄瓜[15,19]、西葫芦[20]、桃[21-22]、枇杷[23-24]、猕猴桃[25]等果蔬中得到证实。但目前有关橄榄果实贮藏期间冷害发生与细胞壁代谢的关系鲜见报道。
同时,前期的研究发现,不同成熟度橄榄果实的冷害反应不同,冷害表现差异明显[26],可能引起不同成熟度橄榄果实冷藏期间细胞壁代谢对采后冷害响应的不同。故本实验在前期研究的基础上,分别以白露、寒露、立冬、大雪节气时采摘的‘檀香’橄榄果实为材料,研究不同成熟度橄榄果实采后冷害过程中细胞壁组分及调控细胞壁代谢酶类的变化规律,探讨不同成熟度橄榄果实冷害发生与细胞壁代谢的关系,以期为橄榄果实贮藏保鲜提供参考。
1 材料与方法
1.1 材料与试剂
供试‘檀香’橄榄果实采自福建省闽清县安仁溪橄榄科技示范场,采摘时间分别为2013-09-07(白露)、2013-10-08(寒露)、2013-11-07(立冬)、2013-12-07(大雪);根据前期研究基础及实验的连贯性,分别用Ⅰ、Ⅲ、Ⅴ、Ⅶ表示上述4 个成熟度,其果实感官评价及品质差异见表1[26-27]。果实均于采摘当天运至福建农林大学农产品产后技术研究所(福州),选择大小均匀、无病害、无机械损伤的健康果实进行实验。
乙醇、二甲基亚砜、丙酮、乙二胺四乙酸、NaCl、Na2CO3、NaBH4、KOH、Na2SO3、硫酸、蒽酮、乙酸、乙酸钠、巯基乙醇、聚乙烯吡咯烷酮K30、3,5-二硝基水杨酸 国药集团化学试剂有限公司;果胶、多聚半乳糖醛酸、对硝基苯-β-D-吡喃半乳糖苷、羧甲基纤维素(carboxymethyl cellulose,CMC)、牛血清白蛋白 美国Sigma公司;咔唑、半乳糖醛酸、蔗糖、葡萄糖、考马斯亮蓝G250 上海阿拉丁生化科技股份有限公司。

表1 4 个成熟度的橄榄果实感官评价及品质差异Table 1 Organoleptic evaluation and quality differences of Chinese olive fruits with four different maturities
1.2 仪器与设备
NRY-200全温空气摇床 上海南荣实验室设备有限公司;6173型台式pH氧化还原温度测试仪 上海任氏电子有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;GL-20G-Ⅱ型高速冷冻离心机上海安亭科学仪器厂;HH-4型数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 橄榄果实处理
橄榄果实经清洗、晾干后,用0.015 mm厚的聚乙烯薄膜袋密封包装,每袋装果100 个,每个成熟度重复6 袋,果实包装后在(2±1)℃、相对湿度85%~90%冷库内贮藏。每隔20 d取样1 次,其中3 袋用于冷害分级及冷害指数计算,另外3 袋用于定期取样测定橄榄果实果肉细胞壁组分含量和细胞壁降解酶活力等指标。
1.3.2 指标测定
1.3.2.1 果实冷害分级及冷害指数计算
按照孔祥佳等[13]的方法计算橄榄果实冷害指数,按式(1)计算。

1.3.2.2 果肉细胞壁组分的提取及含量测定
细胞壁组分提取参照Fishman[28]和Brummell[29]等的方法先获得细胞壁物质,再在此基础上依次得到水溶性果胶(water-soluble pectin,WSP)、离子结合型果胶(ionic-soluble pectin,ISP)、共价结合型果胶(covalentsoluble pectin,CSP)、半纤维素和纤维素。分别采用咔唑比色法测定果胶含量,蒽酮比色法测定半纤维素含量,质量法测定纤维素含量,结果均以mg/g表示(以干质量计)。
1.3.2.3 果肉细胞壁降解酶活力测定
细胞壁降解酶液提取参照Andrews等[30]的方法。PME活力测定按照Lin等[31]的方法,底物为果胶,以每小时消耗1 nmol NaOH的酶用量为1 个PME 酶活力单位U,结果以U/mg pro表示;PG活力测定按照Gross[32]的方法,底物为多聚半乳糖醛酸,以每小时生成1 mg葡萄糖的酶用量为1 个PG酶活力单位U,结果以U/mg pro表示;β-Gal活力测定按照Carrington等[33]的方法,底物为对硝基苯-β-D-吡喃半乳糖苷,以每小时生成1 μmol对硝基苯酚的酶用量为1 个β-Gal活力单位U,结果以U/μg pro表示;CEL活力测定按照Andrews等[30]的方法,底物为CMC,以每小时生成1 mg葡萄糖的酶用量为1 个CEL酶活力单位U,结果以U/mg pro表示。
1.3.2.4 果肉可溶性蛋白含量的测定
采用考马斯亮蓝G250染色法测定,以牛血清白蛋白作标准曲线。
1.4 数据处理
以上各指标测定均重复3 次,取其平均值,采用Excel和SPSS 19.0软件进行数据统计和差异显著性(两组间比较采用t检验,多组间比较采用F检验)分析。
2 结果与分析
2.1 不同成熟度橄榄果实冷藏期间冷害指数的变化

图1 不同成熟度橄榄果实冷藏期间冷害指数的变化Fig. 1 Changes in chilling injury index of Chinese olive fruits with different maturities during cold storage
由图1可知,橄榄果实冷害指数随冷藏时间的延长而增加,在整个冷藏期的同一贮藏时间,成熟度Ⅴ的橄榄果实冷害指数均低于成熟度Ⅰ、Ⅲ、Ⅶ,但不同的成熟度变化幅度不同。其中,成熟度Ⅰ的橄榄果实在冷藏0~20 d快速上升,20~40 d缓慢上升,之后快速升高,冷藏至第100天时,其果实出现严重冷害症状,冷害指数达5.55;成熟度Ⅲ的橄榄果实在冷藏0~60 d缓慢上升,60~80 d快速上升,之后缓慢升高,冷藏至第100天时,绝大部分果实出现冷害症状,冷害指数达4.30;成熟度Ⅴ的橄榄果实在冷藏0~60 d略有升高,之后缓慢上升,冷藏至第100天时,其冷害指数仅为2.59;而成熟度Ⅶ的橄榄果实在整个冷藏期间平缓升高,冷藏至第100天时,其冷害指数为3.47;进一步分析发现,冷藏至第100天时,成熟度Ⅴ的橄榄果实冷害指数极显著低于成熟度Ⅰ、Ⅲ(P<0.01),显著低于成熟度Ⅶ(P<0.05)。上述结果表明,与成熟度Ⅰ、Ⅲ、Ⅶ的橄榄果实相比,成熟度Ⅴ可延缓冷害的发生。
2.2 不同成熟度橄榄果实冷藏期间果肉细胞壁各组分含量的变化
由图2可知,采收当天的橄榄果实果肉WSP含量随着成熟度的增加而升高,ISP、半纤维素和纤维素含量随着成熟度的增加而降低。
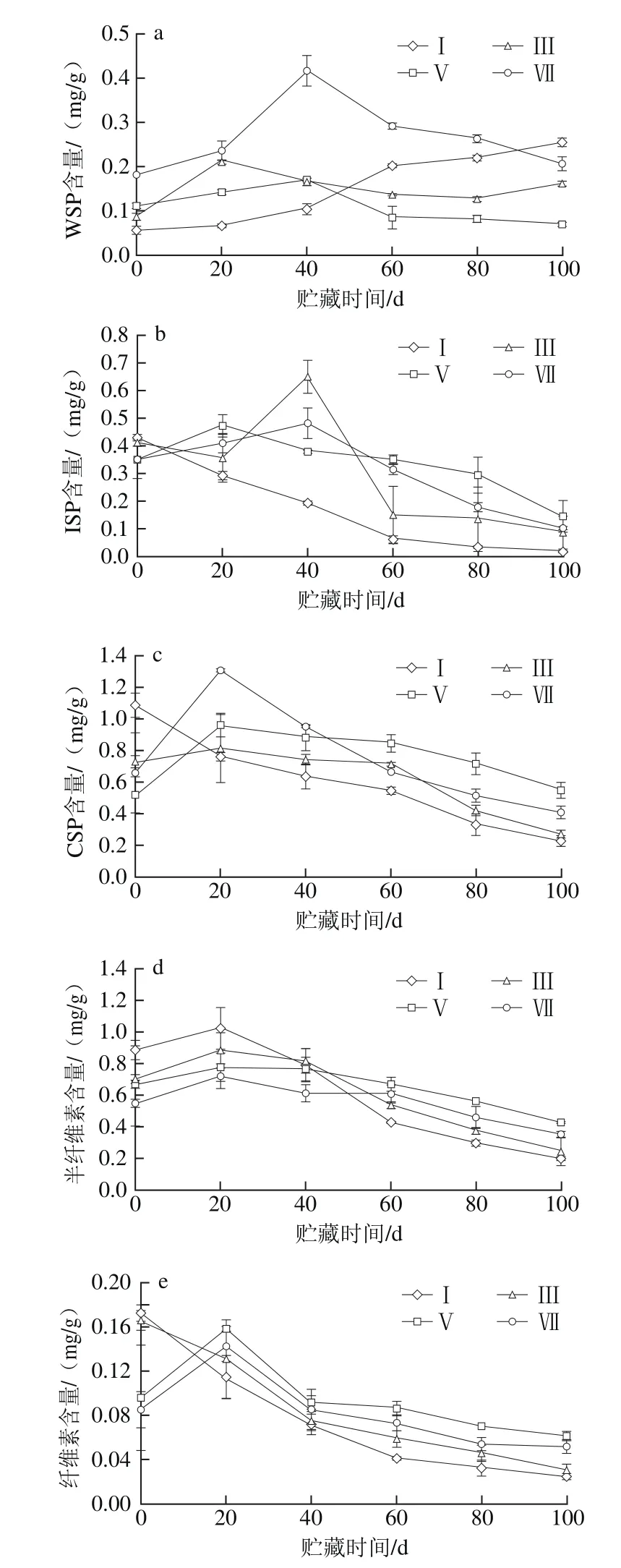
图2 不同成熟度橄榄果实冷藏期间果肉WSP(a)、ISP(b)、CSP(c)、半纤维素(d)和纤维素(e)含量的变化Fig. 2 Changes in contents of WSP (a), ISP (b), CSP (c), semicellulose (d)and cellulose (e) in pulp of Chinese olive fruits with different maturities during cold storage
由图2a可知,成熟度Ⅰ的橄榄果实果肉WSP含量随冷藏时间的延长不断增加,成熟度Ⅲ呈先升后降再升的变化趋势,成熟度Ⅴ和Ⅶ在整个贮藏期间变化趋势相似,均在冷藏的第40天达到峰值。但不同成熟度在同一贮藏时期变化速率不同。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅶ的橄榄果实果肉WSP含量极显著高于成熟度Ⅰ、Ⅲ和Ⅴ(成熟度Ⅰ的第100天除外)(P<0.01),但成熟度Ⅰ、Ⅲ和Ⅴ的橄榄果实果肉WSP含量差异不显著(P>0.05)。进一步比较发现,在冷藏60~100 d内,成熟度Ⅴ的橄榄果实果肉WSP含量极显著低于成熟度Ⅰ和Ⅲ(P<0.01)。
由图2b可知,成熟度Ⅰ的橄榄果实果肉ISP含量随冷藏时间的延长不断下降,成熟度Ⅲ呈先降后升再降的变化趋势,成熟度Ⅴ和Ⅶ呈先升高后下降的变化趋势。在冷藏20~100 d内,成熟度Ⅰ的橄榄果实果肉ISP含量极显著低于成熟度Ⅴ(P<0.01),显著低于成熟度Ⅶ(P<0.05),但与成熟度Ⅲ差异不显著(P>0.05)。进一步比较发现,在冷藏60~100 d内,成熟度Ⅴ的橄榄果实果肉ISP含量高于成熟度Ⅲ和Ⅶ,但彼此间差异不显著(P>0.05)。
由图2c可知,成熟度Ⅰ的橄榄果实果肉CSP含量随冷藏时间的延长不断下降,成熟度Ⅲ、Ⅴ和Ⅶ的橄榄果实果肉CSP含量在整个贮藏期间变化趋势相近,均在冷藏的第20天达到峰值。但不同成熟度在同一贮藏时期变化速率不同。统计分析表明,在冷藏20~100 d内,成熟度Ⅰ的橄榄果实果肉CSP含量显著低于成熟度Ⅲ和Ⅶ(P<0.05),极显著低于成熟度Ⅴ(P<0.01),且成熟度Ⅲ的橄榄果实果肉CSP含量极显著低于成熟度Ⅴ(P<0.01)。进一步比较发现,在冷藏60~100 d内,成熟度Ⅴ的橄榄果实果肉CSP含量显著高于成熟度Ⅶ(P<0.05)。
由图2d可知,成熟度Ⅰ、Ⅲ、Ⅴ和Ⅶ的橄榄果实果肉半纤维素含量在整个贮藏期间变化趋势相近,均在冷藏的第20天达到峰值,但不同成熟度在同一贮藏时期变化速率不同。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅴ的橄榄果实果肉半纤维素含量极显著高于成熟度Ⅶ(P<0.01)。进一步比较发现,在冷藏60~100 d内,成熟度Ⅴ的橄榄果实果肉半纤维素含量极显著高于成熟度Ⅰ(P<0.01),显著高于成熟度Ⅲ(P<0.05)。
由图2e可知,成熟度Ⅰ和Ⅲ的橄榄果实果肉纤维素含量随冷藏时间的延长不断降低,且成熟度Ⅰ的橄榄果实果肉纤维素含量在冷藏20~100 d内显著低于成熟度Ⅲ(P<0.05);成熟度Ⅴ和Ⅶ的橄榄果实变化趋势相近,均在冷藏的第20天达到峰值,统计分析表明,成熟度Ⅶ的橄榄果实果肉纤维素含量在整个贮藏期内的同一贮藏时间极显著低于成熟度Ⅴ(P<0.01)。进一步比较发现,在冷藏20~100 d内,成熟度Ⅰ和Ⅲ的橄榄果实果肉纤维素含量极显著低于成熟度Ⅴ(P<0.01)。
上述结果表明,与成熟度Ⅰ、Ⅲ、Ⅶ的橄榄果实相比,成熟度Ⅴ可延缓橄榄果实果肉贮藏中后期细胞壁各组分含量的降低,较好维持细胞壁结构的完整性。
2.3 不同成熟度橄榄果实冷藏期间果肉细胞壁降解酶活力的变化
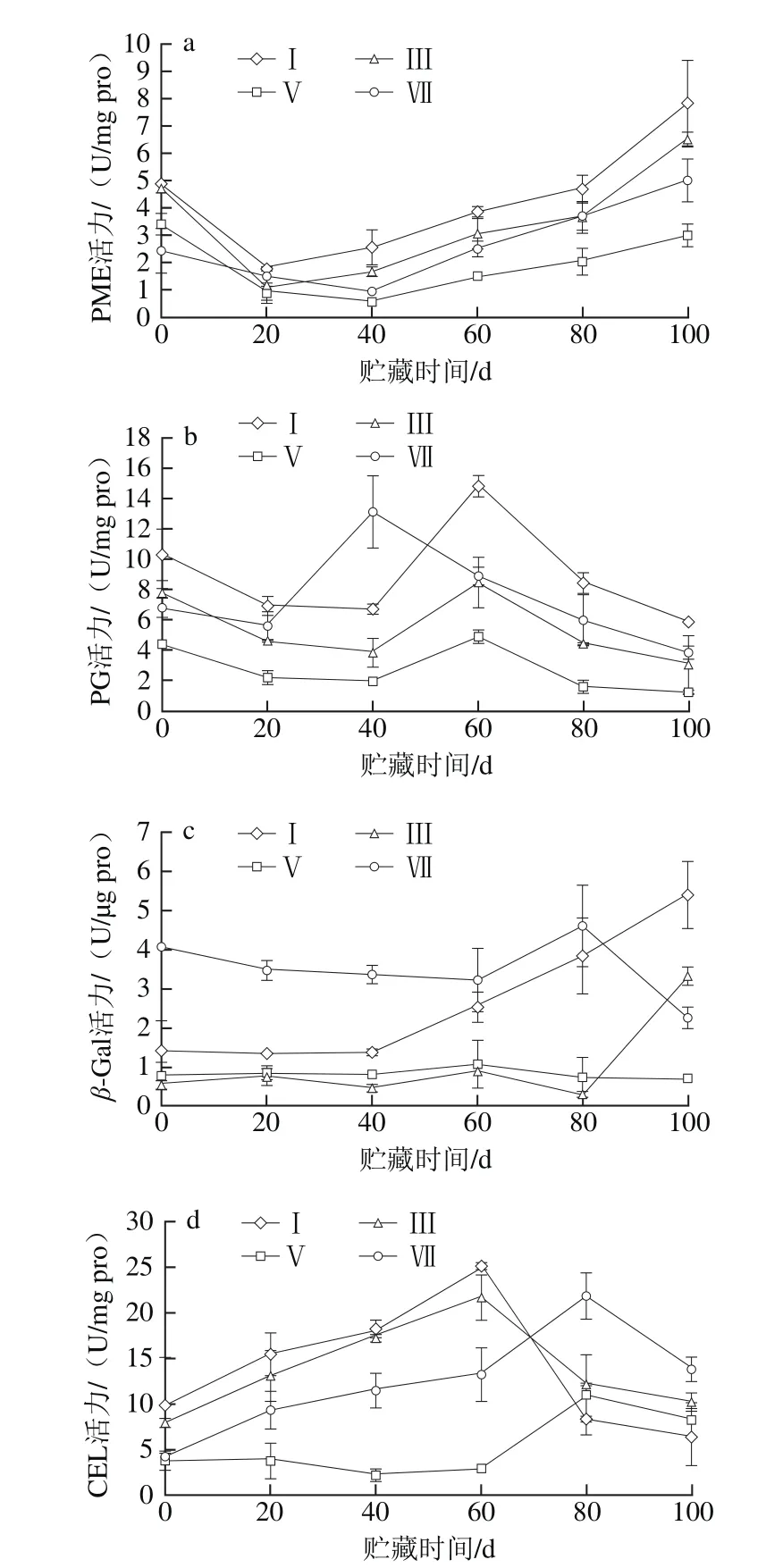
图3 不同成熟度橄榄果实冷藏期间PME(a)、PG(b)、β-Gal(c)和CEL(d)活力的变化Fig. 3 Changes in the activities of PME (a), PG (b), β-Gal (c) and CEL (d)in pulp of Chinese olive fruits with different maturities during cold storage
由图3a可知,采收当天的橄榄果实果肉PME活力随着成熟度的增加而降低。采后贮藏期间,不同成熟度的橄榄果实果肉PME活力变化趋势相似,均随冷藏时间的延长呈先下降后上升的变化趋势,但不同的成熟度变化速率不同。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅴ的橄榄果实果肉PME活力极显著低于成熟度Ⅰ(P<0.01),显著低于成熟度Ⅲ(P<0.05);在冷藏20~100 d内,成熟度Ⅴ的橄榄果实果肉PME活力显著低于成熟度Ⅶ(P<0.05)。
由图3b可知,不同成熟度的橄榄果实果肉PG活力变化趋势相近,均随冷藏时间的延长呈先降后升再降的变化趋势,但不同的成熟度其PG活力达到峰值的时间不一致。其中,成熟度Ⅰ、Ⅲ和Ⅴ的橄榄果实果肉PG活力峰值出现在冷藏的第60天,而成熟度Ⅶ则在冷藏的第40天出现;4 个成熟度的橄榄果实果肉PG活力峰值相比,成熟度Ⅴ的PG活力峰值最小,分别比成熟度Ⅰ、Ⅲ、Ⅶ低66.78%、41.66%、62.45%。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅴ的橄榄果实果肉PG活力极显著低于成熟度Ⅰ和Ⅲ(P<0.01),显著低于成熟度Ⅶ(P<0.05)。
由图3c可知,不同成熟度的橄榄果实果肉β-Gal活力变化趋势不同。其中,成熟度Ⅰ的橄榄果实果肉β-Gal活力在冷藏0~40 d内几乎无变化,之后快速升高;成熟度Ⅲ的橄榄果实果肉β-Gal活力在冷藏0~80 d内变化平缓且略有下降,之后急剧增加;成熟度Ⅴ的橄榄果实果肉β-Gal活力在冷藏0~60 d内略微增加,之后缓慢降低;成熟度Ⅶ的橄榄果实果肉β-Gal活力在冷藏0~60 d内略有下降,60~80 d内快速上升,之后急剧下降;如冷藏至第100天时,成熟度Ⅰ的橄榄果实果肉β-Gal活力分别是成熟度Ⅲ、Ⅴ、Ⅶ的1.62、8.06、2.39倍。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅴ的橄榄果实果肉β-Gal活力显著低于成熟度Ⅰ(P<0.05),极显著低于成熟度Ⅶ(P<0.01)。进一步分析表明,在冷藏0~80 d内,成熟度Ⅴ的橄榄果实果肉β-Gal活力显著高于成熟度Ⅲ(P<0.05),但冷藏至第100天时,成熟度Ⅴ极显著低于成熟度Ⅲ(P<0.01)。
由图3d可知,成熟度Ⅰ、Ⅲ和Ⅶ的橄榄果实果肉CEL活力变化趋势相似,均呈先升高后降低的变化趋势,但不同的成熟度其CEL活力达到峰值的时间不一致;其中,成熟度Ⅰ和Ⅲ的橄榄果实果肉CEL活力峰值出现在冷藏的第60天,成熟度Ⅶ则在冷藏的第80天出现。而成熟度Ⅴ的橄榄果实果肉CEL活力在冷藏0~20 d内几乎无变化,20~40 d内略有下降,40~60 d内略有升高,60~80 d内快速上升,至第80天时达到峰值,之后降低。统计分析表明,在整个贮藏期内的同一贮藏时间,成熟度Ⅴ的橄榄果实果肉CEL活力显著低于成熟度Ⅲ(P<0.05),极显著低于成熟度Ⅶ(P<0.01)。进一步分析表明,在冷藏0~60 d内,成熟度Ⅴ的橄榄果实果肉CEL活力显著低于成熟度Ⅰ(P<0.05);在冷藏80~100 d内,成熟度Ⅴ的橄榄果实果肉CEL活力高于成熟度Ⅰ,但两者差异不显著(P>0.05)。
上述结果表明,与成熟度Ⅰ、Ⅲ、Ⅶ的橄榄果实相比,成熟度Ⅴ可抑制橄榄果实果肉细胞壁降解酶活力的上升,延缓其对细胞壁组分的降解。
3 讨 论
采后果实冷害的发生与细胞壁物质代谢异常有关[15-16,19-25],但细胞壁物质代谢对采后冷害的响应因果蔬冷害症状不同而异。Carvajal等[20]对西葫芦研究表明,其冷害症状表现为果实表面凹陷和外果皮组织区域损伤,冷藏增加西葫芦PME、PG和CEL活力,提高WSP含量,降低纤维素和半纤维素含量,说明西葫芦冷害症状的出现与其细胞壁降解有关;而Cao Shifeng等[24]对枇杷果实的研究表明,其冷害症状表现为木质化败坏,冷藏破坏枇杷果实PME和PG活力变化的平衡,维持较低的WSP、ISP含量及较高的CSP含量,促进半纤维素和纤维素含量增加,导致果实出汁率下降、硬度升高,说明枇杷果实冷害现象的发生与其木质素积累和细胞壁多糖可溶性降低有关。
本研究结果表明,不同成熟度橄榄果实的冷害症状均表现为表面出现凹陷、褐变和水渍状斑点等,并随着冷藏时间延长,冷害指数不断上升,但不同成熟度橄榄果实上升幅度不同。同时,不同成熟度的橄榄果实果肉细胞壁组分含量变化趋势不同。其中,成熟度Ⅰ的橄榄果实果肉在冷藏期间由于结合态果胶(ISP、CSP)不断转化为WSP,使WSP含量不断增加,ISP和CSP含量不断减少(图2a~c),并且整个冷藏期间纤维素含量和20~100 d内半纤维素含量急剧下降(图2d~e),致使细胞壁果胶-纤维素-半纤维素结构破坏,加速果胶物质外露,使其更易被细胞壁降解酶作用,进一步加剧细胞壁组分的解聚,从而导致冷害症状过早出现。成熟度Ⅲ的橄榄果实果肉在冷藏期间由于结合态果胶(ISP、CSP)含量出现短暂的增加,故延缓其转化为WSP(图2a~c),但整个贮藏期间纤维素含量和20~100 d内半纤维素含量快速下降(图2d~e),致使细胞壁纤维素微纤丝-半纤维素交联网络结构破坏,导致冷藏中后期细胞壁组分的大量分解而造成冷害。成熟度Ⅴ和Ⅶ的橄榄果实果肉在冷藏前期由于细胞壁合成能力增强,使WSP、ISP、CSP、半纤维素和纤维素含量增加来适应低温环境并抵御冷胁迫(图2a~e);但随着冷藏时间延长,细胞壁中纤维素和半纤维素含量减少,结合态果胶不断解离和解聚,使ISP、CSP含量下降并随之转化为WSP;而在冷藏后期,成熟度Ⅴ和Ⅶ的橄榄果实果肉WSP含量未见升高反而降低可能与WSP作为呼吸底物被消耗有关。相关分析表明,成熟度Ⅰ的橄榄果实冷害指数与WSP含量呈极显著正相关(P<0.01),与ISP、CSP含量呈极显著负相关(P<0.01),与半纤维素、纤维素含量呈显著负相关(P<0.05),相关系数分别为RⅠ=0.946、-0.930、-0.978、-0.901、-0.911;成熟度Ⅲ的橄榄果实冷害指数与CSP含量呈极显著负相关(P<0.01),与半纤维素、纤维素含量呈显著负相关(P<0.05),相关系数分别为RⅢ=-0.925、-0.904、-0.911;成熟度Ⅴ和Ⅶ的橄榄果实冷害指数与ISP、半纤维素含量呈显著负相关(P<0.05),相关系数分别为RⅤ=-0.862和-0.865、RⅦ=-0.865和-0.817,在冷藏20~100 d内冷害指数与CSP含量呈极显著负相关(P<0.01),相关系数RⅤ=-0.997、RⅦ=-0.923,在冷藏40~100 d内冷害指数与纤维素含量呈极显著负相关(P<0.01),相关系数RⅤ=-0.991、RⅦ=-0.951。因此,不同成熟度橄榄果实冷藏期间冷害发生与其细胞壁组分降解密切相关,这与沈丽雯等[19]在黄瓜、Carvajal等[20]在西葫芦上的研究结果相似。
PME通过去除果胶中糖醛酸残基上的甲氧基,催化果胶甲酯酸转化为果胶酸,以利于PG催化果胶及果胶酸的降解[18,34-35];β-Gal通过去除果胶多聚醛酸侧链的半乳糖残基,使果胶解聚或溶解[18,34];CEL通过降解纤维素和半纤维素中的木葡聚糖,使细胞壁果胶-纤维素-半纤维素结构破坏。本研究发现,在冷藏初期,不同成熟度的橄榄果实果肉PME和PG活力均降低,表现出低温降低果实细胞壁代谢的进程,但随着冷藏时间延长,果实冷害症状出现,导致不同成熟度的橄榄果实果肉PME活力上升而PG活力呈先升后降的变化趋势,尤其是在冷藏后期,较高的PME活力和较低的PG活力造成低甲氧基果胶的积累(图3c和图2b),从而加速橄榄果实质地的异常变化;这表明PME和PG活力变化的不平衡是导致橄榄果实细胞壁果胶物质代谢异常,并产生凹陷、水渍状斑点等冷害症状的主要原因。本研究还发现,不同成熟度的橄榄果实果肉β-Gal和CEL活力变化趋势不同。其中,成熟度Ⅰ的橄榄果实果肉β-Gal活力与WSP含量呈显著正相关(P<0.05),相关系数RⅠ=0.914;成熟度Ⅶ的橄榄果实在冷藏前期果肉β-Gal活力最高,其WSP含量也最高(图3c和图2a);这说明β-Gal也是导致橄榄果实冷藏期间质地异常变化、冷害出现的主要酶类之一。同时,成熟度低(Ⅰ、Ⅲ)的橄榄果实果肉CEL活力上升较早、较快,活力高峰出现在冷藏的第60天,而成熟度高(Ⅴ、Ⅶ)的橄榄果实果肉CEL活力上升较慢,至冷藏的第80天才达到最大值(图3d);这表示不同成熟度的橄榄果实在冷藏期间由于CEL活力提高,使其积极参与到细胞壁的降解过程,导致细胞壁果胶-纤维素-半纤维素结构破坏,从而加剧橄榄果实冷害的发生。因此,PME、PG、β-Gal和CEL等细胞壁降解酶的活力变化不平衡或活力提高是导致冷藏橄榄果实细胞壁结构解体、细胞壁代谢异常、冷害发生的主要原因。
进一步比较发现,与成熟度Ⅰ、Ⅲ和Ⅶ的橄榄果实相比,成熟度Ⅴ保持较低的果实冷害指数和果肉PME、PG、β-Gal和CEL活力(图1、3a~d),延缓冷藏中后期果肉WSP含量升高及ISP、CSP、半纤维素和纤维素含量降低(图2a~e)。因此认为,成熟度Ⅴ的橄榄果实在冷藏期间可降低果肉细胞壁降解酶活力,延缓冷藏中后期细胞壁组分降解,较好维持细胞壁结构的完整性,有效减轻冷害发生。
[1] 国家药典委员会. 中华人民共和国药典2015年版(一部)[M]. 北京: 中国医药科技出版社, 2015: 197-198.
[2] 林玉芳, 陈清西. 橄榄功能成分及其抗氧化作用研究进展[J]. 热带作物学报, 2010, 31(1): 158-163. DOI:10.3969/j.issn.1000-2561.2010.01.030.
[3] 常强, 苏明华, 陈清西. 橄榄化学成分与药理活性研究进展[J]. 热带作物学报, 2013, 34(8): 1610-1616. DOI:10.3969/j.issn.1000-2561.2013.08.035.
[4] 王恒, 宋良科, 汤昊, 等. 不同种质青果清热利咽化学组分的研究[J].中国中药杂志, 2010, 35(6): 669-672. DOI:10.4268/cjcmm20100601.
[5] ZHANG L L, LIN Y M. Tannins from Canarium album with potent antioxidant activity[J]. Journal of Zhejiang University Science B, 2008,9(5): 407-415.
[6] XIANG Z B, CHEN H S, JIN Y S, et al. Phenolic constituents of Canarium album[J]. Chemistry of Natural Compounds, 2010, 46(1): 119-120. DOI:10.1007/s10600-010-9543-3.
[7] KUO C T, LIU T H, HSU T H, et al. Antioxidant and antiglycation properties of different solvent extracts from Chinese olive (Canarium album L.) fruit[J]. Asian Pacific Journal of Tropical Medicine, 2015,8(12): 987-995. DOI:10.1016/j.apjtm.2015.11.013.
[8] 朱良, 赵冠欣, 沈耀威, 等. 橄榄总黄酮对小鼠急性酒精性肝损伤的保护作用[J]. 食品与机械, 2010, 26(3): 91-93. DOI:10.3969/j.issn.1003-5788.2010.03.026.
[9] 张怡, 李玲望, 曾红亮, 等. 橄榄汁保肝作用及其功效成分的研究[J]. 营养学报, 2012, 34(4): 379-383. DOI:10.13325/j.cnki.acta.nutr.sin.2012.04.018.
[10] 福建省统计局. 福建统计年鉴—2016 [DB/OL]. (2016-08-30)[2016-11-18]. http://www.stats-fj.gov.cn/tongjinianjian/dz2016/index-cn.htm.
[11] 林河通, 傅虬声, 洪启征. 橄榄果实的冷藏适温与冷害初报[J]. 福建农业大学学报, 1996, 25(4): 485-489.
[12] 孔祥佳, 林河通, 陈雅平, 等. 低温贮藏对“长营”橄榄果实采后生理和品质的影响[J]. 包装与食品机械, 2011, 29(2): 1-5. DOI:10.3969/j.issn.1005-1295.2011.02.001.
[13] 孔祥佳, 林河通, 郑俊峰, 等. 诱导冷藏橄榄果实抗冷性的适宜热空气处理条件优化[J]. 农业工程学报, 2011, 27(8): 371-376.DOI:10.3969/j.issn.1002-6819.2011.08.065.
[14] 孔祥佳, 林河通, 郑俊峰, 等. 热空气处理诱导冷藏橄榄果实抗冷性及其与膜脂代谢的关系[J]. 中国农业科学, 2012, 45(4): 752-760.DOI:10.3864/j.issn.0578-1752.2012.04.016.
[15] 千春录. 黄瓜果实成熟度与耐冷性的关系及其生理机制研究[D]. 杭州: 浙江大学, 2012: 101-113.
[16] 金鹏, 王静, 朱虹, 等. 果蔬采后冷害控制技术及机制研究进展[J]. 南京农业大学学报, 2012, 35(5): 167-174. DOI:10.7685/j.issn.1000-2030.2012.05.018.
[17] 王聘, 郜海燕, 周拥军, 等. 减压处理对新疆白杏果实软化和细胞壁代谢的影响[J]. 农业工程学报, 2012, 28(16): 254-258. DOI:10.3969/j.issn.1002-6819.2012.16.039.
[18] 赵云峰, 林河通, 王静, 等. 热处理抑制采后龙眼果肉自溶及细胞壁物质降解[J]. 农业工程学报, 2014, 30(11): 268-275. DOI:10.3969/j.issn.1002-6819.2014.11.033.
[19] 沈丽雯, 刘娟, 董红敏, 等. 热激处理减轻黄瓜冷害与细胞壁代谢的关系[J]. 食品工业科技, 2015, 36(23): 329-332; 338. DOI:10.13386/j.issn1002-0306.2015.23.060.
[20] CARVAJAL F, PALMA F, JAMILENA M, et al. Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J]. Postharvest Biology and Technology, 2015, 108:68-77. DOI:10.1016/j.postharvbio.2015.05.013.
[21] JIN P, SHANG H T, CHEN J J, et al. Effect of 1-methylcyclopropene on chilling injury and quality of peach fruit during cold storage[J].Journal of Food Science, 2011, 76(8): 5485-5491. DOI:10.1111/j.1750-3841.2011.02349.x.
[22] 尚海涛. 桃果实絮败和木质化两种冷害症状形成机理研究[D]. 南京: 南京农业大学, 2011: 33-42.
[23] 曹士锋. 枇杷果实采后品质劣变调控及其机理研究[D]. 南京: 南京农业大学, 2008: 6-7.
[24] CAO Shifeng, ZHENG Yonghua, WANG Kaituo, et al. Effect of methyl jasmonate on cell wall modiベcation of loquat fruit in relation to chilling injury after harvest[J]. Food Chemistry, 2010, 118(3): 641-647.DOI:10.1016/j.foodchem.2009.05.047.
[25] SFAKIOTAKIS E, CHLIOUMIS G, GERASOPOULOS D.Preharvest chilling reduces low temperature breakdown incidence of kiwifruit[J]. Postharvest Biology and Technology, 2005, 38(2): 169-174.DOI:10.1016/j.postharvbio.2005.06.010.
[26] 孔祥佳, 周鹤, 林河通, 等. 采收期对冷藏橄榄果实贮藏期间冷害的影响[J]. 食品科学, 2016, 37(22): 255-262. DOI:10.7506/spkx1002-6630-201622039.
[27] 孔祥佳, 林河通, 周鹤, 等. 鲜食橄榄果实的适宜采收期及其品质评价参数的研究[J]. 保鲜与加工, 2016, 16(2): 6-14. DOI:10.3969/j.issn.1009-6221.2016.02.002.
[28] FISHMAN M L, LEVAJ B, GILLESPIE D, et al. Changes in the physico-chemical properties of peach fruit pectin during on-tree ripening and storage[J]. Journal of the American Society for Horticultural Science,1993, 118(3): 343-349.
[29] BRUMMELL D A, DAL C V, CRISOSTO C H, et al. Cell wall metabolism during maturation, ripening and senescence of peach fruit[J]. Journal of Experimental Botany, 2004, 55: 2029-2039.DOI:10.1109/20.560112.
[30] ANDREWS P K, LI S L. Cell wall hydrolytic enzyme activity during development of nonclimacteric sweet cherry (Prunus avium L.)fruit[J]. Journal of Horticultural Science, 1995, 70(4): 561-567. DOI:10.1080/14620316.1995.11515327.
[31] LIN T P, LIU C C, CHEN S W, et al. Puriベcation and characterization of pectinmethylesterase from Ficus awkeotsang Makino achenes[J].Plant Physiology, 1989, 91(4): 1445-1453.
[32] GROSS K C. A rapid and sensitive spectrophotometric method for assaying polygalacturonase using 2-cyanoacetamide[J]. Journal of Horticultural Science and Biotechnology, 1982, 17(6): 933-934.
[33] CARRINGTON C M S, GREVE L C, LABAVITCH J M. Cell wall metabolism in ripening fruit (VI. effect of the antisense polygalacturonase gene on cell wall changes accompanying ripening in transgenic tomatoes)[J]. Plant Physiology, 1993, 103(2): 429-434.
[34] WEI J M, MA F W, SHI S G, et al. Changes and postharvest regulation of activity and gene expression of enzymes related to cell wall degradation in ripening apple fruit[J]. Postharvest Biology and Technology, 2010,56(2): 147-154. DOI:10.1016/j.postharvbio.2009.12.003.
[35] SUN X K, YANG Q, GUO W D, et al. Modiベcation of cell wall polysaccharide during ripening of Chinese bayberry fruit[J].Scientia Horticulturae, 2013, 160(3): 155-162. DOI:10.1016/j.scienta.2013.05.048.
