氨基葡萄糖和骨碎补联用对大鼠慢性骨关节炎的干预作用及机制
2018-02-28周艳丽陈世杰劳文艳朱杨雄赵晓红
周艳丽,陈世杰,劳文艳,3,朱杨雄,赵晓红,3,*
骨关节炎(osteoarthritis,OA)是一类多见于中老年人的以关节软骨慢性退变为主、软骨下骨改变和滑膜慢性炎症为特征的关节疾病。随着老龄化社会的到来,OA已成为导致老年人功能障碍,影响老年人生活质量的常见疾病之一,因此对它的发病机制和有效预防措施的研究,已成为重要的公共卫生课题。
OA是一种由多种因素共同作用而导致的疾病。其发生机理与衰老、创伤、过度劳损、肥胖、遗传、关节营养的降低、自由基损伤、自身免疫损伤反应、生物力学异常等多种因素有关[1]。关节软骨由细胞外基质(extracellularmatrix,EMC)和软骨细胞组成,基质主要由蛋白多糖和胶原纤维组成。胶原纤维是关节软骨基质的重要组成成分,其中Ⅱ型胶原含量约占胶原总量的90%。而胶原纤维是关节软骨形态结构的主要维持者,同时也是关节软骨力学功能的主要承担者[2]。软骨破坏是OA发病的中心环节,主要由软骨EMC降解与合成明显失衡而引起[3],细胞因子、基质金属蛋白酶、自由基和细胞调亡等多种因素都涉及软骨退行性变的发病机制[4-6]。
目前,针对OA的治疗临床上缺乏根治措施,长期使用非甾体抗炎药不能阻止OA的病理发展且可导致软骨损伤及严重的胃肠道不良反应等[7]。近年来,已有用硫酸软骨素[8]、氨基葡萄糖(glucosamine,GLU)[9]、维生素、矿物质及一些植物提取物类,如鹿茸多肽[10]、骨碎补(drynaria rhizome,DR)[11]和虾青素[12]等的单独作用以及透明质酸钠和硫酸氨基葡萄糖(1 500 mg/d)[13]的联合作用来预防和治疗OA,在一定程度上均能够减轻软骨损伤,抑制OA病理进程,且无明显毒副作用。此外,GLU能刺激软骨基质的合成[14],而DR则抑制其降解[15],两者联用治疗OA能否取得更好的效果,目前鲜见报道。
诱发OA动物模型有多种,有急性的、慢性的。关节腔注射诱发模型造模时间短,为最快形成的OA动物模型[16],但是此类模型造成急性关节破坏,与人类OA病理进程稍有差别,而运动性损伤模型通过过度运动导致关节损伤,关节的修复能力较差,一旦损伤即可造成永久性病变[17]。Lee等[18]通过迫使Wistar大鼠进行跑台运动成功诱导了大鼠OA模型,其组织病理学变化与早期OA病理改变一致,此类模型符合人类退行性OA的病理发展过程,可作为研究OA的一种慢性模型。但将两种造模方法联合采用建立的OA模型鲜见报道。
因此,本研究采用关节腔注射白陶土-鹿角菜胶诱发各组大鼠急性骨关节损伤,结合跑台运动,建立大鼠慢性OA模型,研究GLU和DR联用的干预作用及机制,为进一步开展预防和治疗OA的研究工作提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
选用6 周龄的160~180 g的SD雄性大鼠(SPF级),饲养于北京联合大学应用文理学院保健食品功能检测中心SPF级动物室(许可证号:SYXK(京)2012-0031)。基础饲料由北京华阜康生物科技股份有限公司(许可证号:SCXK(京)2014-012)生产。
DR提取物 北京绿色金可生物技术股份有限公司;GLU、双氯芬酸钠(diclofenac sodium,DS)、白陶土、λ-鹿角菜胶、番红-O-固绿(saffron-O-solid green,SOFG)染料、苏木精-伊红(hematoxylin eosin,HE) 美国Sigma公司;中性树胶 北京国药集团化学试剂有限公司;柠檬酸抗原修复液(pH 6.0)、Tween 20 北京鼎国昌盛生物技术有限责任公司;水合氯醛 上海阿拉丁生化科技股份有限公司;一氧化氮(nitric oxide,NO)、超氧化物歧化酶(superoxide dismutase,SOD) 南京建成生物工程研究所;大鼠白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、金属基质蛋白酶-3(matrix metalloproteinase-3,MMP-3)、金属基质蛋白酶抑制剂-1(tissue inhibitor of metalloproteinases inhibitor-1,TIMP-1)、诱导型一氧化氮合酶(inducible nitric oxidesynthase,iNOS)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒武汉华美生物科技有限公司;大鼠Ⅱ型胶原免疫组化检测试剂盒 上海雅吉生物科技有限公司。
1.2 仪器与设备
ZH-PT动物实验跑台 安徽正华生物仪器设备有限公司;数显卡尺 上海宝琴工具有限公司;UV-2450型紫外-可见分光光度计 日本岛津公司;多功能酶标仪美国赛默飞世尔公司;MQX200微板分光光度计 美国伯腾仪器有限公司;病理制片系统 德国徕卡仪器有限公司。
1.3 方法
1.3.1 大鼠慢性OA模型的建立与实验设计
造模方法:采用关节腔注射白陶土-鹿角菜胶诱发大鼠急性骨关节损伤[19]。方法如下:大鼠经水合氯醛(350 mg/kg mb)腹腔注射麻醉后,右后肢膝关节部位常规消毒,然后用1 mL注射针穿过髌骨韧带向膝关节腔内注入灭菌生理盐水配制的40 mg/mL白陶土与20 mg/mL λ-鹿角菜胶的混悬液0.1 mL,并缓慢曲伸关节持续5 min。术后大鼠休息2 d,第3天各组大鼠在跑台上以10~20 m/min慢速跑步30 min以适应跑道。5 d后开始正式运动,20 m/min,60 min/d,跑台坡度为5°,运动6 周后结束。空白组笼内饲养,自由活动。
实验设计:造模前开始按10 mL/kg mb灌胃给药。单独给药分别为GLU单独作用组(750 mg/kg GLU)、DR单独作用组(150 mg/kg DR);联合给药分别为高剂量组(750 mg/kg GLU+150 mg/kg DR)、中剂量组(250 mg/kg GLU+50 mg/kg DR)和低剂量组(125 mg/kg GLU+25 mg/kg DR),同时设空白组和模型组(无菌水)以及阳性对照组(2 mg/kg DS),每天1 次,直至6 周跑台运动结束。各受试物的人体推荐剂量:标准体质量60 kg,1 500 mg/d GLU,300 mg/d DR;低、中、高剂量分别按人体推荐剂量的5、10、30 倍;单独作用剂量为人体推荐剂量的30 倍。
1.3.2 动物处理与样本采集
实验结束后,100 mg/mL水合氯醛麻醉大鼠(4 mL/kg mb),股动脉取血后处死。取各组大鼠完整的右膝关节,修剪去除相连的软组织,放入体积分数10%中性缓冲福尔马林中固定。全血标本于室温静置30 min后,3 000 r/min离心15 min,取上清液,用于细胞因子检测,若不能及时检测,应储存于-20 ℃或-80 ℃。但应避免反复冻融,解冻后的样品应再次离心,然后检测。
1.3.3 大鼠膝关节肿胀度的测量
在造模后的第1~7周末,每天定时测量。用游标卡尺测量每组大鼠右膝关节横向直径/mm,计算膝关节肿胀度/%[19]。
1.3.4 组织病理学检查及评分
取出固定的大鼠右膝关节,用体积分数5%甲酸-福尔马林脱钙,每日更换新鲜液,直至组织软化为止,约为3~4 d。脱钙完成后流水冲洗24 h(除酸),进行常规脱水、透明、浸蜡、切片。分别进行HE[20]和SOFG[21]染色。显微镜下观察关节软骨细胞及EMC的染色情况和结构的完整性。评分项目及标准参考文献[19]。
1.3.5 指标测定
用ELISA法测定大鼠血清中IL-1β、TNF-α、MMP-3、TIMP-1质量浓度和iNOS活力。采用黄嘌呤氧化酶法测定血清中SOD活力。采用硝酸还原酶法检测血清中NO浓度。实验操作严格按照试剂盒说明书进行。
使用大鼠胶原ELISA试剂盒检测关节软骨组织Ⅱ型胶原纤维表达。采用Image-Pro plus 6.0图像分析软件,测定单位面积软骨组织切片Ⅱ型胶原纤维免疫组化染色平均光密度值。
1.4 数据统计分析
2 结果与分析
2.1 GLU和DR联用对大鼠关节肿胀度的影响
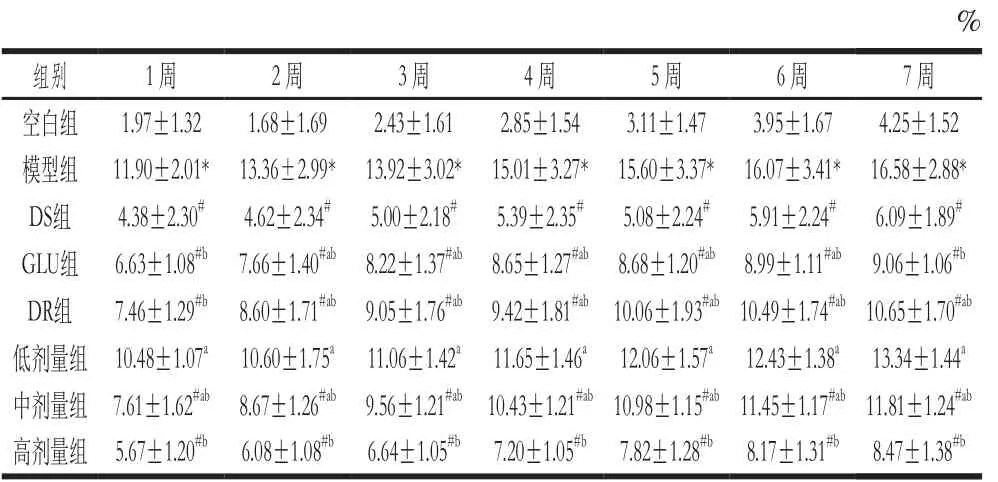
表1 不同处理对大鼠关节肿胀度的影响(n= 6)Table 1 Effect of GLU and DR on arthroncus in rats (n= 6)
由表1可知,第1~7周,与空白组相比,模型组大鼠关节肿胀度显著增加,表明模型诱导成功;与模型组相比,DS组显著降低,除了低剂量组外,其他各受试物组均显著降低(P<0.05)。以上结果表明,GLU和DR单独及联合作用均能减轻大鼠关节肿胀损伤,单独作用时GLU的作用效果优于DR,联合作用时高剂量的效果最好,且优于2 种物质单独作用时的效果,中剂量的作用效果比DR略差一些,低剂量减轻关节肿胀损伤效果不明显。
2.2 GLU和DR联用对大鼠关节软骨组织病理学改变的影响
2.2.1 HE染色的组织病理学征象
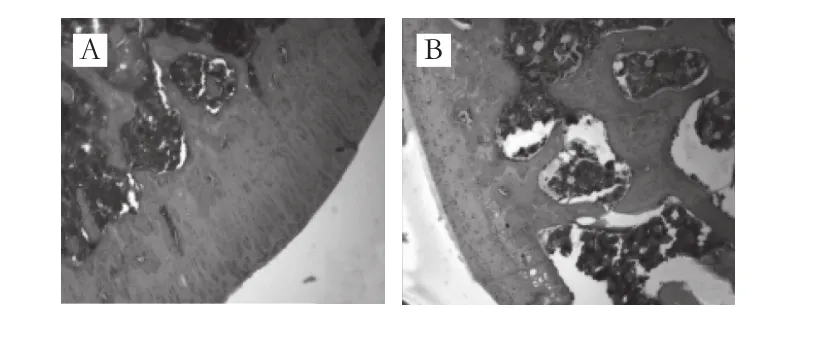
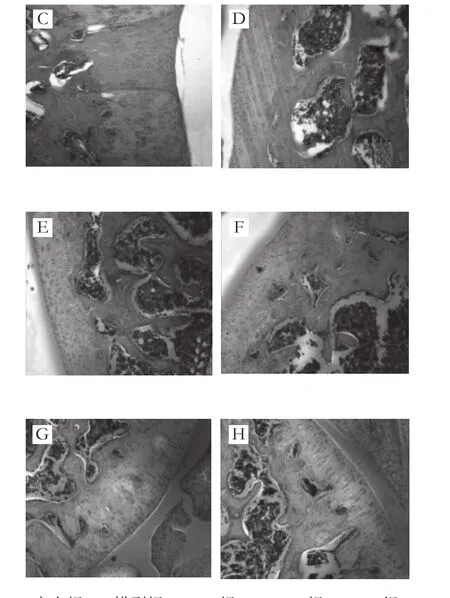
图1 大鼠膝关节HE染色的组织病理学征象(×100)Fig. 1 Representative pathological features of knee joints in rats by HE staining (× 100)
由图1可见,空白组关节软骨表面光滑、完整,软骨层无裂缝、侵蚀;软骨细胞规则排列于软骨陷窝内,呈柱状排列,软骨细胞数量、形态无异常。模型组关节软骨表面粗糙、不平整,有裂缝,可深达放射层及钙化层,部分软骨层脱落,大范围骨侵蚀和软骨破坏;表层内的软骨细胞明显减少,细胞排列紊乱,放射层细胞则明显增多,钙化层可见肥大的软骨细胞,有细胞团存在,部分有血管翳形成。DS组的组织病理学所见则明显轻于模型组,表现为关节软骨侵蚀较轻,细胞排列较规则,肥大样细胞减少。各受试物组除低剂量组外大鼠关节软骨组织病理学征象均明显轻于模型组,其中,高剂量组组织病理学征象减轻最明显,其次为GLU组、DR组和中剂量组。
2.2.2 SOFG染色观察关节软骨蛋白聚糖含量的变化
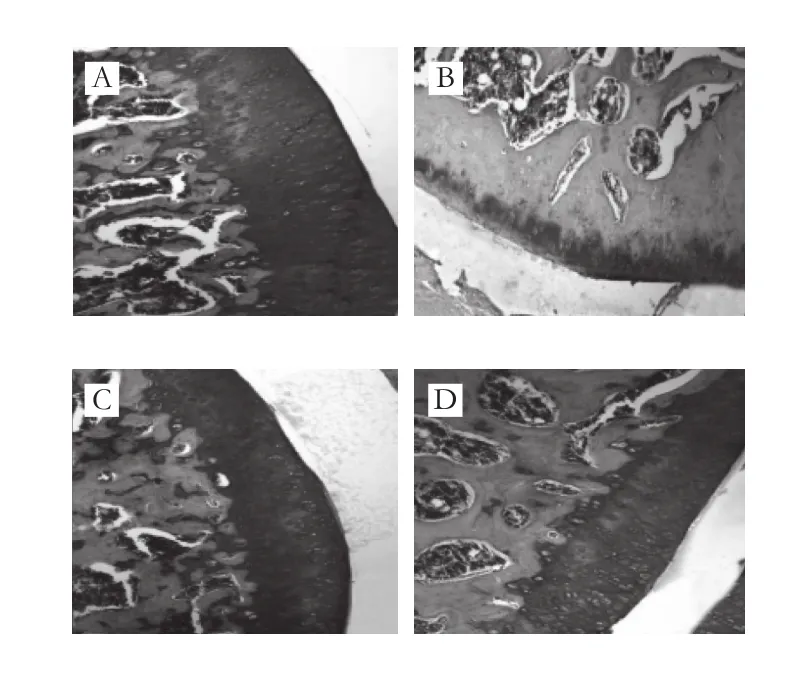
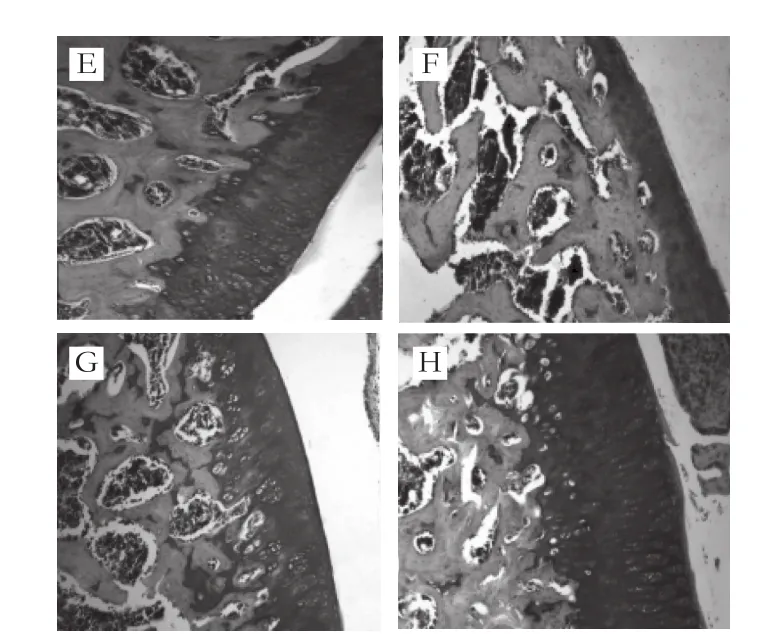
图2 大鼠膝关节SOFG染色组织病理学征象(×100)Fig. 2 Representative pathological features of knee joints in rats by SOFG staining (× 100)
由图2可知,空白组关节软骨蛋白聚糖染色正常(颜色鲜红且均匀);模型组关节软骨基质中蛋白聚糖染色重度减退,说明造模后大鼠关节软骨EMC中蛋白聚糖含量明显降低,模型诱导成功;与模型组相比,DS组蛋白聚糖染色缺失现象明显减轻,各受试物组除低剂量组外,蛋白聚糖染色缺失现象均明显改善。
2.2.3 组织病理学评分结果
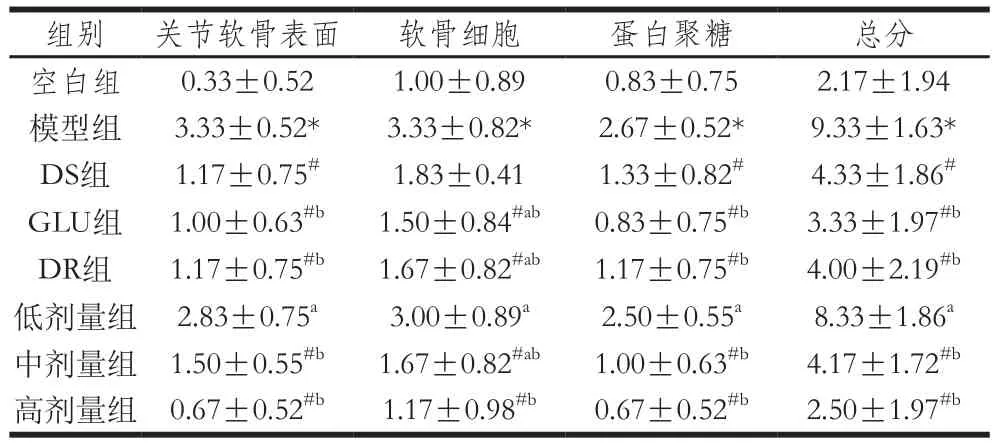
表2 大鼠膝关节切片的组织病理学评分结果(n= 6)Table 2 Histopathological scores of knee joints in rats (n= 6)
由表2可见,模型组大鼠关节软骨的各项组织病理学评分均显著高于空白组(P<0.05)。DS组的各项评分除软骨细胞外均显著低于模型组(P<0.05)。GLU组、DR组、中、高剂量组各项评分均显著低于模型组(P<0.05)。低剂量组各项评分与模型组相比有所降低,但差异不明显。以上结果表明,GLU和DR单独及联合作用均能改善大鼠组织病理学异常现象,单独作用时GLU的改善效果更好,联合作用时高剂量的效果最好,优于2 种物质单独作用时的效果,中剂量的改善效果比DR略差一些,低剂量对大鼠组织病理学异常现象的改善效果不明显。
2.3 GLU和DR联用对MMP-3、TIMP-1水平的影响
如图3A、B所示,与空白组相比,模型组大鼠血清中MMP-3和TIMP-1质量浓度明显升高;与模型组相比,DS组、GLU组、DR组、中、高剂量组MMP-3和TIMP-1质量浓度均明显降低,低剂量组MMP-3质量浓度也有所降低,但差异不明显。说明大鼠骨关节损伤时血清MMP-3表达增高,模型诱导成功,GLU和DR单独和联合作用对MMP-3和TIMP-1质量浓度的升高均具有一定的抑制作用,单独作用时GLU的抑制作用更明显,联合作用时高剂量组抑制作用最明显,优于DS组及其他受试物组。
如图3C所示,与空白组相比,模型组大鼠血清MMP-3/TIMP-1质量浓度比值明显降低;与模型组相比,DS、DR组和低剂量组有所降低,但差异不明显,其余各受试物组均明显小于模型对照组。说明大鼠发生OA时血清TIMP-1、MMP-3表达均升高,但两者升高幅度不平行,导致MMP-3与TIMP-1质量浓度失衡,GLU和DR单独作用对MMP-3与TIMP-1之间失衡都有调节作用,联合作用时中、高剂量调节作用较明显,低剂量没有明显调节作用。
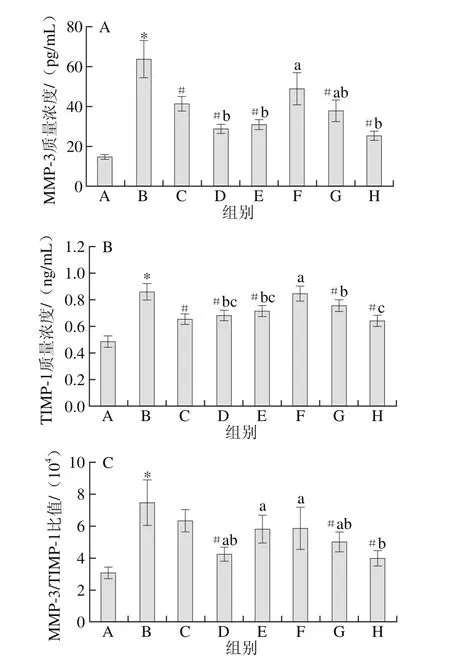
图3 各组大鼠血清MMP-3(A)、TIMP-1(B)质量浓度和MMP-3/TIMP-1质量浓度比值(C)的比较Fig. 3 Comparison of the levels of MMP-3 (A) and TIMP-1 (B) and MMP-3/TIMP-1 ratio (C) in serum of rats
2.4 GLU和DR联用对iNOS活力和NO浓度的影响
如图4所示,与空白组相比,模型组大鼠血清中iNOS活力和NO浓度显著增加;与模型组相比,除低剂量组外,DS组和各受试物组iNOS活力和NO浓度均明显降低;各受试物组相比,GLU和DR单独作用和联合作用中、高剂量组大鼠血清iNOS活力和NO浓度均明显低于低剂量组(P<0.05)。说明GLU和DR单独和联合作用对OA大鼠血清iNOS活力和NO浓度的升高均具有一定的抑制作用,联合作用时,中、高剂量组有明显的降低作用,低剂量组的作用效果不明显。
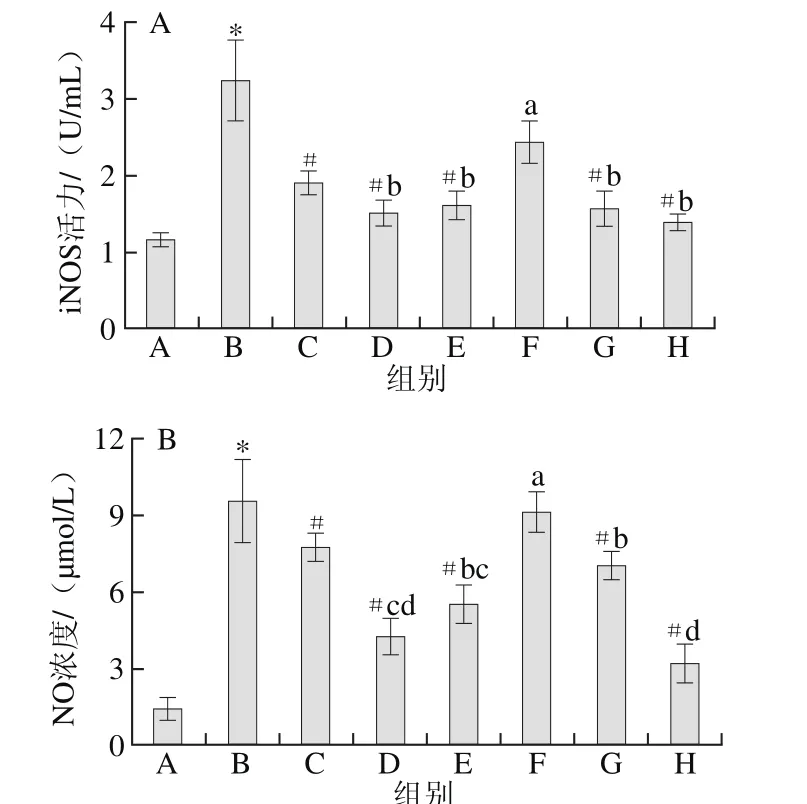
图4 各组大鼠血清iNOS活力(A)和NO浓度(B)的比较Fig. 4 Comparison of iNOS activity (A) and NO level (B) in serum of rats
2.5 GLU和DR联用对SOD活力的影响
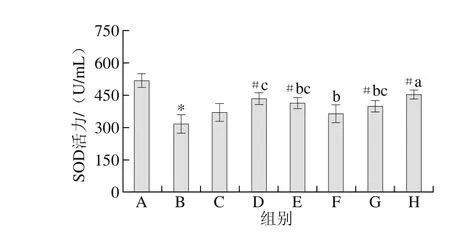
图5 各组大鼠血清SOD活力的比较Fig. 5 Comparison of SOD activity in serum of rats
如图5所示,与空白组相比,模型组大鼠血清SOD活力明显降低;与模型组相比,DS组SOD活力升高,但不明显,除低剂量组外,其他各受试物组SOD活力明显升高;说明关节腔注射联合跑台运动诱发大鼠发生氧化损伤,GLU和DR单独和联合作用对OA大鼠血清SOD活力的降低均具有一定的抑制作用,其中高剂量的作用效果最明显,其次为GLU、DR和中剂量,低剂量的作用效果不显著。
2.6 GLU和DR联用对关节软骨组织Ⅱ型胶原含量的影响
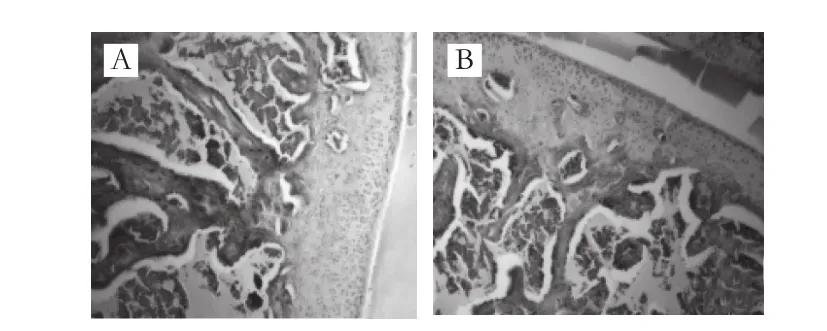
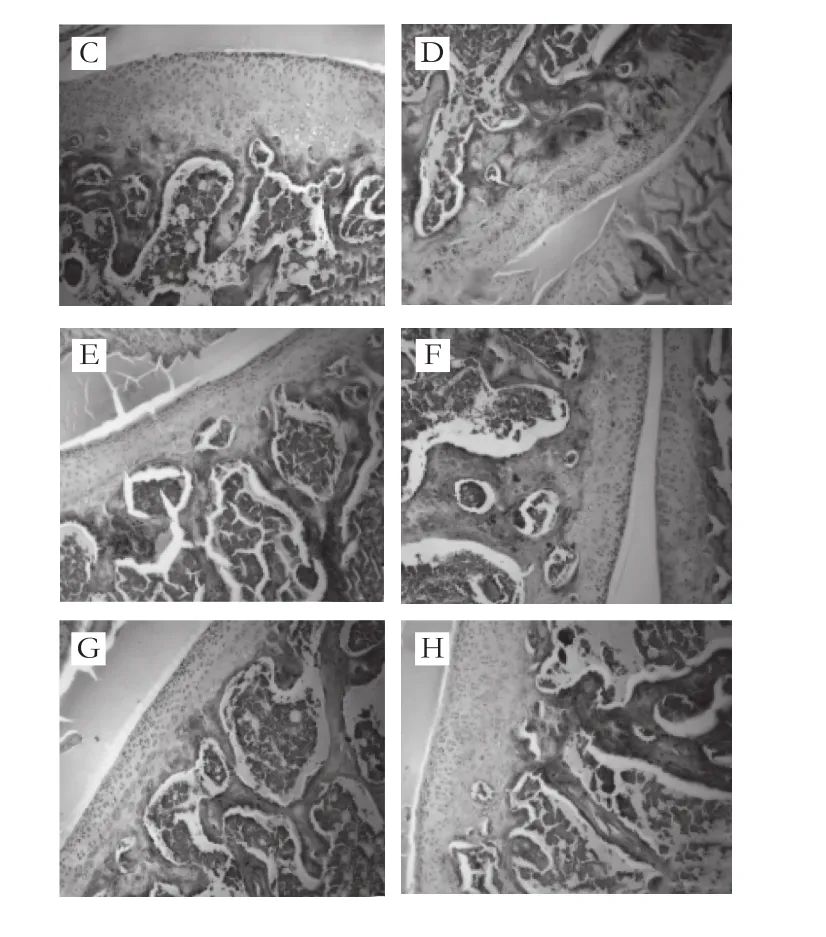
图6 大鼠关节软骨Ⅱ型胶原免疫组化染色观察(×100)Fig. 6 Immunohistochemical staining of type Ⅱ collagen of articular lamella in rats (× 100)
如图6所示,空白组大鼠关节软骨EMCⅡ型胶原染色呈棕色,阳性染色面积广泛,均匀分布于关节软骨各层,软骨层可见软骨细胞染色阳性;模型组大鼠关节软骨层变薄,表浅层出现缺损,EMC染色浅,阳性染色面积显著减少,且分布不均匀,软骨细胞少量着色。与模型组相比,DS组大鼠关节软骨EMC染色加深,染色面积增大,软骨层可见阳性细胞增多;各受试物组大鼠关节软骨细胞阳性染色增多,EMC染色面积增大,染色有不同程度加深。

图7 各组大鼠关节软骨Ⅱ型胶原表达的比较Fig. 7 Comparison of average optical density of type Ⅱ collagen in articular cartilage of rats
如图7所示,与空白组相比,模型组大鼠关节软骨Ⅱ型胶原平均光密度值明显降低。与模型组相比,DS组Ⅱ型胶原平均光密度值明显升高;各受试物组除低剂量组外Ⅱ型胶原平均光密度值均明显升高;说明大鼠发生OA时关节软骨Ⅱ型胶原含量明显减少,GLU和DR对OA大鼠关节软骨Ⅱ型胶原含量的减少均具有明显改善作用,单独作用时GLU的改善效果更明显,优于DR和DS,联合作用时高剂量的效果最优,且优于GLU,低剂量的改善效果不明显。
2.7 GLU和DR联用对炎性细胞因子质量浓度的影响
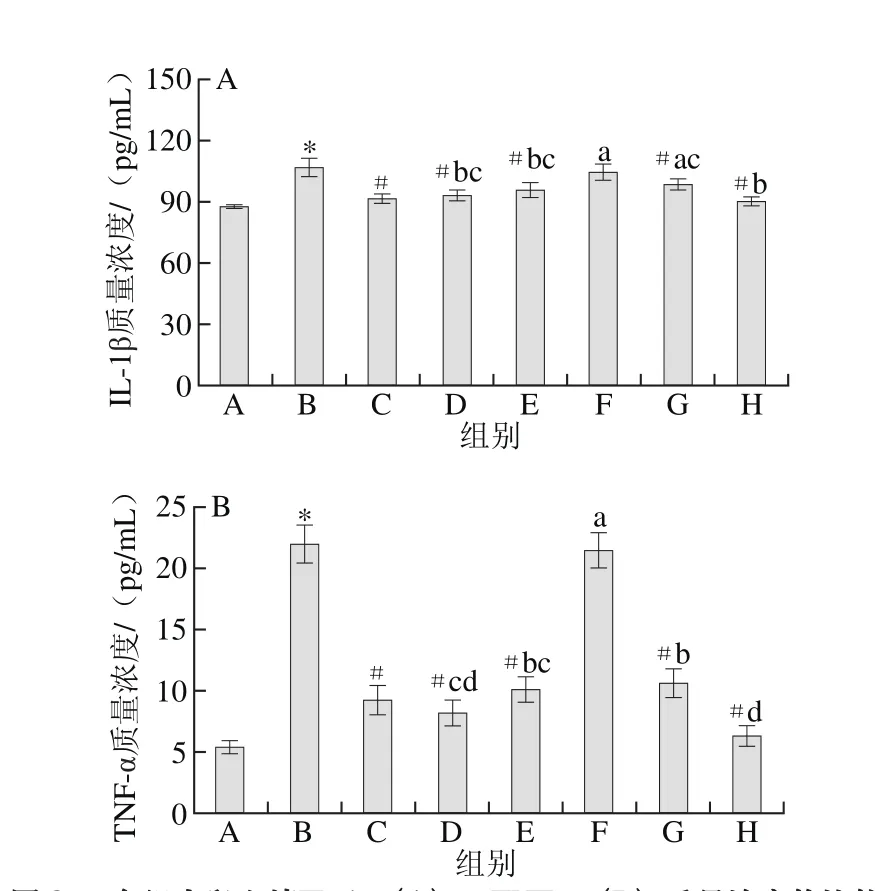
图8 各组大鼠血清IL-1β(A)、TNF-α(B)质量浓度的比较Fig. 8 Comparison of IL-1β (A) and TNF-α (B) concentration in serum of rats from all groups
由图8可见,与空白组相比,模型组大鼠血清中TNF-α和IL-1β质量浓度均明显升高。与模型组相比,DS组TNF-α和IL-1β质量浓度明显降低;除低剂量组外,各受试物组血清TNF-α和IL-1β质量浓度均明显降低;低剂量组血清TNF-α、IL-1β质量浓度有所降低,但差异不显著。说明诱发大鼠OA后,大鼠产生炎症反应,血清炎性因子TNF-α和IL-1β水平明显升高,GLU和DR均能明显降低大鼠血清炎性因子IL-1β、TNF-α水平,GLU的降低效果更明显,联合作用时高剂量的效果最明显,且优于2种物质单独作用效果,低剂量组的作用效果不明显。
3 讨 论
OA为一种退行性骨关节病,其病变的核心是关节软骨破坏[22]。OA的发病机制与软骨细胞、EMC及软骨下骨三者降解和合成失衡有关[3],这种失衡与炎性因子介导、细胞凋亡和压力机制等密切相关。GLU是一种天然的氨基单糖,可刺激软骨细胞合成蛋白聚糖以补充软骨基质的流失,刺激关节软骨细胞的再生,从而改善关节软骨结构,促进软骨组织的修复[4],同时可抑制炎症因子的生成,阻断炎性物质的扩散途径,在一定程度上延缓OA的病理进程[23]。DR是水龙骨科多年生蕨类植物,具有补肾坚骨、活血止痛的功效[24],能改善软骨细胞的生理病理状态,有效抑制关节滑膜细胞凋亡,促进关节软骨组织形态的恢复,从而缓解关节软骨的退行性改变[25]。本实验发现,模型组关节软骨组织可见炎性细胞浸润、滑膜细胞与纤维组织增生以及关节软骨与骨破坏,关节软骨基质中蛋白聚糖染色重度减退。灌胃受试物组,除了低剂量组外,大鼠关节软骨组织病理学征象均明显轻于模型组,其中,高剂量组减轻最明显,其次为GLU组、DR组和中剂量组。说明GLU和DR单独和联用均可抑制缓解软骨破坏。
目前普遍认为,多种MMPs对关节软骨EMC有降解作用,使关节软骨肿胀,抗外力作用下降。Freemont等[26]发现MMP-1主要在软骨表层表达增高,而MMP-3与-9则在软骨深层表达较高,其中MMP-9在OA的早期表达增高明显,而MMP-3则在OA的早期和晚期表达增高明显。软骨细胞分泌的MMP-3底物广泛[27],可降解基质中的蛋白多糖及其Ⅱ型胶原纤维[28]。蛋白多糖和Ⅱ型胶原的质和量的改变是引起关节软骨退变继而发生OA的直接原因,可作为反映软骨基质损伤的良好指标[29]。目前发现的TIMP中,TIMP-1的分布最为广泛,是MMPs最为主要的拮抗剂。MMP-3和TIMP-1关系失衡促进关节细胞降减,软骨退变,导致OA的发生[30]。Liu Qingguo等[31]发现,在关节软骨急剧退变兔中,血清MMP-3浓度明显上升。在OA患者的关节软骨组织中TIMPs与MMPs的失衡,会导致关节功能的严重损害[32]。在本实验中,与空白组相比,模型组血清中MMP-3和TIMP-1的质量浓度增加,MMP-3/TIMP-1失衡,而且基质中蛋白多糖和Ⅱ型胶原含量下降。而受试物组MMP-3和TIMP-1的质量浓度下降,说明GLU和DR单独作用对MMP-3与TIMP-1之间失衡都有调节作用,联合作用时中、高剂量调节作用更为明显,低剂量没有明显的调节作用。
IL-1β、TNF-α都是机体免疫系统调节骨代谢的主要蛋白质因子,是参与OA发病进程中的重要介质,是炎症反应的始动因素。IL-1β和TNF-α可以起到协同作用,介导关节组织的破坏,并与OA软骨破坏严重程度相关[33-35]。细胞因子IL-1β、TNF-α通过刺激软骨细胞退变,刺激滑膜细胞分泌前列腺素E2,引起基质降解酶尤其是MMPs家族的产生,抑制Ⅱ型胶原的合成[36-37],在OA发病和进展中起着关键作用。IL-1β也可以刺激产生IL-1β本身和TNF-α,引起一系列的生物学效应[38]。何忠斌等[39]研究发现盐酸氨基葡萄糖能抑制膝关节炎患者血清IL-1β、TNF-α和MMP-9的表达,改善膝关节功能,达到治疗的作用。本实验发现,诱发大鼠OA后,大鼠产生炎症反应,血清炎性因子TNF-α和IL-1β水平明显升高,GLU和DR均能明显降低大鼠血清炎性因子IL-1β、TNF-α水平,GLU的降低效果更明显,联合作用时高剂量的效果最明显,且优于2种物质单独作用效果,低剂量组的作用效果不明显。
自由基可以加重和延长炎症过程,在炎症的发展过程中起重要作用。NO是活泼的自由基分子,参与多种组织的代谢调节。研究证实关节炎软骨表达iNOS mRNA并导致NO过量释放,而过量NO可增加胶原酶和金属蛋白酶的活性,抑制基质蛋白多糖的合成,增加Ⅱ型胶原的裂解,而且增加的NO又具有协同各种细胞因子的作用,从而造成关节软骨的损伤[40-41]。NO是IL-1β作用于软骨细胞最主要的效应分子,又具有神经递质和第二信使的功能,参与多种生理和病理过程[42]。SOD作为体内抗氧化酶之一,可清除氧自由基和其分解产物,能修复自由基对软骨细胞的损伤,可作为评价OA防治效果的客观指标[43]。郝小金等[44]通过观察比较功效不同的4组补肾活血“对药”在OA病变过程中存在的作用差异,发现牛膝+泽兰组、补骨脂+DR组及联合组均可降低细胞因子IL-1β、TNF-α、自由基NO浓度及提高SOD活性,熟地+鹿角组效果不明显,而牛膝、泽兰组作用优于其他各组,说明在膝OA早期炎症、局部血液循环障碍,可能是重要的致病因素。本实验发现,与空白组相比,模型组大鼠血清中iNOS活力和NO浓度增加;SOD活力降低。给予受试物后,iNOS活力和NO浓度减少,SOD活力增加。说明GLU和DR可以通过减轻氧化损伤、减缓关节损伤。
在本实验中,研究GLU和DR联合作用对大鼠OA的干预作用及机制。研究发现:GLU和DR单独和联合作用均能减轻大鼠关节肿胀损伤,改善大鼠组织病理学异常现象;抑制大鼠血清MMP-3和TIMP-1质量浓度的升高,调节MMP-3/TIMP-1失衡;抑制iNOS活力和NO、IL-1β、TNF-α水平的增加;抑制关节软骨Ⅱ型胶原含量和SOD活力的降低。单独作用以GLU的效果较好。GLU和DR联合作用时高剂量的效果最好,优于单独作用效果,低剂量的效果最差。2 种物质单独作用时,按人体推荐量的30 倍给药;联合作用时,按人体推荐量的30、10、5 倍给药。说明GLU和DR单独和联合作用都能够减轻骨关节损伤,联合作用需要达到有效作用剂量才有明显的抑制作用。其作用机制与调节软骨EMC合成、降解失衡(MMP-3、TIMP-1质量浓度降低,蛋白多糖和Ⅱ型胶原含量增加),减轻大鼠滑膜组织氧化损伤(NO浓度、iNOS活力降低,SOD活力增加)及炎性损伤(IL-1β、TNF-α质量浓度降低)有关。这些研究为预防和治疗OA功能性食品的研发提供了理论依据。
[1] 丰哲, 肖茜, 练克俭. Wnt信号通路与骨关节炎的研究进展[J]. 吉林医学, 2017, 38(2): 383-386. DOI:10.3969/j.issn.1004-0412.2017.02.093.
[2] VILAR J M, RUBIO M, SPINELLA G, et al. Serum collagen type Ⅱcleavage epitope and serum hyaluronic acid as biomarkers for treatment monitoring of dogs with hip osteoarthritis[J]. PLoS ONE, 2016, 11(2):e0149472. DOI:10.1371/journal.pone.0149472.
[3] STOCK M, MENGES S, EITZINGER N, et al. A dual role for UCMA in osteoarthritis-inhibition of aggrecanases and promotion of bone turnover[J]. Arthritis & Rheumatology, 2017, 69(6): 1233-1245.DOI:10.1002/art.40042.
[4] CHAN D D, XIAO W F, LI J, et al. Deベciency of hyaluronan synthase 1(Has1) results in chronic joint inflammation and widespread intraarticular fibrosis in a murine model of knee joint cartilage damage[J].Osteoarthritis and Cartilage, 2015, 23(11): 1879-1889. DOI:10.1016/j.joca.2015.06.021.
[5] JOO H E, LEE H J, SHIN E A, et al. c-Jun N-terminal kinase-dependent endoplasmic reticulum stress pathway is critically involved in arjunic acid induced apoptosis in non-small cell lung cancer cells[J]. Phytotherapy Research, 2016, 30(4): 596-603. DOI:10.1002/ptr.5563.
[6] TAKAHASHI K, HASHIMOTO S, KUROSAKI H, et al. A pilot study comparing the efficacy of radiofrequency and microwave diathermy in combination with intra-articular injection of hyaluronic acid in knee osteoarthritis[J]. Journal of Physical Therapy Science, 2016, 28(2): 525-529. DOI:10.1589/jpts.28.525.
[7] BALMACEDA C M. Evolving guidelines in the use of topical nonsteroidal anti-inぼammatory drugs in the treatment of osteoarthritis[J].BMC Musculoskeletal Disorders, 2014, 15(1): 27. DOI:10.1186/1471-2474-15-27.
[8] RAILHAC J J, ZAIM M, SAUREL A S, et al. Effect of 12 months treatment with chondroitin sulfate on cartilage volume in knee osteoarthritis patients: a randomized, double-blind, placebo-controlled pilot study using MRI[J]. Clinical Rheumatology, 2012, 31(9): 1347-1357.DOI:10.1007/s10067-012-2022-4.
[9] HENROTIN Y, MOBASHERI A, MARTY M. Is there any scientific evidence for the use of glucosamine in the management of human osteoarthritis?[J]. Arthritis Research & Therapy, 2012, 14(1): 201.DOI:10.1186/ar3657.
[10] 修忠标, 孙磊. 鹿茸多肽对实验性膝骨性关节炎软骨细胞凋亡及相关细胞因子的影响[J]. 中国骨伤, 2012, 25(5): 418-423. DOI:10.3969/j.issn.1003-0034.2012.05.017.
[11] WONG R W K, RABIE A B M. Systemic effect of crude extract from rhizome of drynaria fortunei on bone formation in mice[J]. Phytotherapy Research, 2006, 20(4): 313-315. DOI:10.1002/ptr.1842.
[12] HUANG L J, CHEN W P. Astaxanthin ameliorates cartilage damage in experimental osteoarthritis[J]. Japanese Journal of Rheumatology, 2015,25(5): 768-771. DOI:10.3109/14397595.2015.1008724.
[13] 王亚丽. 透明质酸钠联合硫酸氨基葡萄糖治疗膝骨关节炎的临床观察[J]. 中国医药导报, 2011, 8(20): 121-122. DOI:10.3969/j.issn.1673-7210.2011.20.056.
[14] 傅欣, 林霖, 魏学磊, 等. 氨基葡萄糖和硫酸软骨素联合用药对兔骨关节炎治疗作用实验研究[J]. 中国运动医学杂志, 2008, 27(5): 588-592. DOI:10.3969/j.issn.1000-6710.2008.05.011.
[15] 秦楚, 李沛. 补肾中药干预骨关节炎的机理研究进展[J]. 中医学报,2012, 27(1): 76-78. DOI:10.16368/j.issn.1674-8999.2012.01.055.
[16] AIGNER T, COOK J L, GERWIN N, et al. Histopathology atlas of animal model systems: overview of guiding principles[J]. Osteoarthritis and Cartilage, 2010, 18 (Suppl 3): 2-6. DOI:10.1016/j.joca.2010.07.013.
[17] NI G X, LEI L, ZHOU Y Z. Intensity-dependent effect of treadmill running on lubricin metabolism of rat articular cartilage[J]. Arthritis Research and Therapy, 2012, 14(6): 256. DOI:10.1186/ar4101.
[18] LEE Y J, PARK J A, YANG S H, et al. Evaluation of osteoarthritis induced by treadmill-running exercise using the modiベed mankin and the new OARSI assessment system[J]. Rheumatology International, 2011,31(12): 1571-1576. DOI:10.1007/s00296-010-1520-4 .
[19] 陈世杰, 劳文艳, 周艳丽, 等. 氨基葡萄糖、骨碎补和虾青素对大鼠急性骨关节炎的干预研究[J]. 食品工业科技, 2017, 38(4): 365-369;378. DOI:10.13386/j.issn1002-0306.2017.04.061.
[20] 刘志翔, 张柳, 张楠. 降钙素对兔骨关节炎软骨基质金属蛋白酶1的影响[J]. 中国矫形外科杂志, 2006, 14(22): 1741-1743; 1764.DOI:10.3969/j.issn.1005-8478.2006.22.020.
[21] MASUHARA K, NAKAI T, YAMAGUCHI K, et al. Signiベcant increases in serum and plasma concentrations of matrix metalloproteinases 3 and 9 in patients with rapidly destructive osteoarthritis of the hip[J]. Arthritis &Rheumatism, 2002, 46(10): 2625-2631. DOI:10.1002/art.10547.
[22] HEIJINK A, VANHEES M, VAN DEN ENDE K, et al. Biomechanical considerations in the pathogenesis of osteoarthritis of the elbow[J]. Knee Surgery Sports Traumatology Arthroscopy, 2016, 24(7): 2313-2318.DOI:10.1007/s00167-015-3518-7.
[23] KANZAKI N, SAITO K, MAEDA A, et al. Effect of a dietary supplement containing glucosamine hydrochloride, chondroitin sulfate and quercetin glycosides on symptomatic knee osteoarthritis: a randomized, double-blind, placebo-controlled study[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 862-869. DOI:10.1002/jsfa.4660.
[24] 陈瑶, 刘忠良, 赵勇. 骨碎补化学成分和药理作用研究进展[J]. 解放军药学学报, 2012, 28(5): 454-457. DOI:10.3969/j.issn.1008-9926.2012.05.24.
[25] 郑忠辉. 骨碎补对骨性关节炎家兔实验研究[D]. 沈阳: 辽宁中医药大学, 2015: 23-25.
[26] FREEMONT A J, HAMPSON V, TILMAN R, et al. Gene expression of matrix metallc: proteinases 1, 3 and 9 by chondrocytes in osteoarthritie human knee articular cartilage is zone and grade speciベc[J]. Annals of the Rheumatic Diseases, 1997, 56(9): 542-548. DOI:10.1136/ard.56.9.542.
[27] 谈志龙, 邢国胜, 李德达, 等. 细胞因子对关节软骨细胞作用的研究[J]. 骨与关节损伤杂志, 2003, 18(5): 316-318. DOI:10.3969/j.issn.1672-9935.2003.05.012.
[28] LOHMANDER L S, BRANDT K D, MAZZUCA S A, et al. Use of the plasma stromelysin (matrix metalloproteinase 3) concentration to predict joint space narrowing in knee osteoarthritis[J]. Arthritis & Rheumatism,2005, 52(10): 3160-3167. DOI:10.1002/art.21345.
[29] TCHETVERIKOV I, LOHMANDER L S, VERZIJL N, et al. MMP protein and activity levels in synovial ぼuid from patients with joint injury,inflammatory arthritis, and osteoarthritis[J]. Annals of the Rheumatic Diseases, 2005, 64(5): 694-698. DOI:10.1136/ard.2004.022434.
[30] ZHANG J S, CHENG Y Y, LIU J. The changes and correlations of MMP-3, TIMP-1 in knee osteoarthritis patients[J]. Acta Universitatis Medicinalis Anhui, 2012, 15 (3): 3989-4006.
[31] LIU Qingguo, JI Bo, QIN Weilan, et al. Effect of acupotomy lysis on serum matrix metalloproteinase (MMP)-3 and MMP-13 contents in osteoarthritis rabbits[J]. Acupuncture Research, 2008, 33(5): 306-309.
[32] REMST D F, BLOM A B, VITTERS E L, et al. Gene expression analysis of osteoarthritis synovium reveals elevation of transforming growth factor-beta responsive genes in osteoarthritis-related ベbrosis[J]. Arthritis& Rheumatology, 2014, 66(3): 647-656. DOI:10.1002/art.38266.
[33] 帅明, 林荔军, 林昭伟, 等. IL-1β、HIF-1α和VEGF在兔膝关节骨性关节炎模型滑膜中的表达[J]. 中国老年学杂志, 2013, 33(10): 2311-2313. DOI:10.3969/j.issn.1005-9202.2013.10.036.
[34] 叶茂, 黄敬东, 吴新兴, 等. 鹿瓜多肽注射液治疗膝关节骨性关节炎疗效及对血清中TNF-α和IL-23的影响[J]. 现代诊断与治疗, 2013,24(6): 1204-1205. DOI:10.3969/j.issn.1001-8174.013.06.003.
[35] 王雷, 齐磊, 辛荣超. 盐酸氨基葡萄糖对兔膝骨关节炎模型关节液中白细胞介素1和白细胞介素6及肿瘤坏死因子水平的影响[J]. 中国医药, 2017, 12(1): 126-129. DOI:10.3760/cma.j.issn.1673-4777.2017.01.030.
[36] HULEIOVÁH, BARESOVÁV, KLÉZL Z, et al. Increased level of cytokines and matrix metalloproteinase in osteoarthritic subchondral bone[J]. Cytokine, 2007, 38(3): 151-156. DOI:10.1016/j.cyto.2007.06.001.
[37] 张铁峰, 李景峰. 细胞因子IL-1β和TNF-α在骨关节炎软骨中mRNA表达的变化及意义[J]. 中国现代医生, 2008, 46(15): 116-117.DOI:10.3969/j.issn.1673-9701.2008.15.050.
[38] ZWERINA J, REDLICH K, POLZER K, et al. TNF-induced structural joint damage is mediated by IL-1[J]. Proceeding of the National Academy of Sciences of the United States of American, 2007, 104(28): 11742-11747. DOI:10.1073/pnas.0610812104.
[39] 何忠斌, 朱海波. 盐酸氨基葡萄糖对膝骨关节炎患者血清IL-1β、MMP-9和TNF-α表达的影响和临床疗效[J]. 医学理论与实践, 2015,28(12): 1566-1567; 1570.
[40] LOTZ M. The role of nitric oxide in articular cartilage damage[J].Rheumatic Disease Clinics of North America, 1999, 25(2): 269-282.DOI:10.1016/S0889-857X(05)70067-3.
[41] 金大地, 孙炜, 王吉兴, 等. 一氧化氮合酶抑制剂对骨关节炎的潜在治疗意义[J]. 中华骨科杂志, 2002, 22(6): 367-371. DOI:10.3760/j.issn:0253-2352.2002.06.013.
[42] 莘晓陶, 张志纯. 一氧化氮在骨缺损愈合中的作用[J]. 社区医学杂志, 2007, 5(11): 68-70. DOI:10.3969/j.issn.1672-4208.2007.11.042.
[43] HENROTIN Y, KURZ B. Antioxidant to treat osteoarthritis:dream or reality?[J]. Current Drug Targets, 2007, 8(2): 347-357.DOI:10.2174/138945007779940151.
[44] 郝小金, 冯文进, 郝华, 等. 补肾活血“对药”对兔膝骨关节炎NO、SOD、IL-1和TNF-α水平的影响[J]. 北京中医药, 2010, 29(5): 380-381.
