榛仁免疫活性肽分离纯化及结构鉴定
2018-02-28王明爽刘春雷刘秀奇闵伟红
王 鹏,王明爽,刘春雷,方 丽,王 辑,刘秀奇,闵伟红*
榛子(Corylus heterophylla Fisch.)为桦木科榛属植物的果实,含油脂、蛋白质、碳水化合物、不饱和脂肪酸、纤维等多种营养成分[1]。榛仁中蛋白质含量约占20%,氨基酸比例均衡,可满足成年人对各种氨基酸的需要[2-3]。生物活性肽是蛋白质中天然氨基酸以不同组成和排列方式构成的从二肽到复杂的线性或环形的分子质量不同的肽类总称,是源于蛋白质的多功能化合物[4]。目前,对榛仁蛋白质开发利用主要集中于蛋白质提取及肽的制备工艺等方面,对于其生物活性研究较少,而利用酶水解蛋白质获得的多肽具有多种生理活性,例如促进人体生长发育[5]、降低胆固醇[6]、抑菌[7]、降低高血压[8]、调节免疫功能[9]等。
免疫系统是疾病预防的第一道防线,人们不健康的生活方式、饮食等皆可导致免疫力下降从而引发各种疾病。免疫活性肽是通过酶水解获得具有免疫调节作用的肽段,一般为小分子物质,不具有免疫原性,进入机体后不能诱发免疫排斥反应,且分子质量在2 000 Da以下[10]。免疫活性肽能增强巨噬细胞吞噬功能和促进淋巴细胞增殖等,提高机体抵抗入侵病原体的能力[11-12]。目前,免疫活性肽主要研究酪蛋白[13]、小麦蛋白[14]、大豆蛋白[15]、大米蛋白[16]等。免疫活性肽以分子质量小、活性和稳定性强、生物活性高的优势,已经引起人们的重视。食源性免疫活性肽跟传统药物相比无毒副作用,人们通过食用免疫活性肽来提高自身免疫力,日渐成为主流趋势[17]。王明爽等[18]以水解度为指标,用碱性蛋白酶制备榛仁水解肽,发现水解度为38.08%的榛仁水解肽能提高小鼠免疫调节功能。Ren Dayong等[19]利用超滤将榛仁水解肽分成3 个组分,短期喂养小鼠,发现低分子质量榛仁水解肽有免疫调节作用。
本研究在确定分子质量小于3 kDa的多肽具有较好免疫调节活性的基础上,通过凝胶色谱、反相高效液相色谱(reversed-phase high-performance liquid chromatography,RP-HPLC)和飞行质谱对其进行分离纯化和结构鉴定,并对获得的六肽进行验证,为榛仁免疫活性肽的开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
脱脂榛仁粕购买于长白山地区;榛仁分离蛋白酶解后经超滤获得的分子质量小于3 kDa组分,经冻干获得粉状物。
噻唑蓝(3-(4,5-dimethylthiazd-2-yl)-2,5-diphenylentrazolium bromide,MTT)、脂多糖(lipopolysaccharide,LPS)、二甲基亚砜(dimethyl sulfoxide,DMSO)、伴刀豆蛋白A(concanavalin A,ConA)、Sephadex G-25、Sephadex G-15 美国Sigma公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;小鼠肿瘤坏死因子(tumor necrosis factor alpha,TNF-α)和白介素-6(interleukin-6,IL-6)的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 美国Research and Development公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FD-1B-50型冷冻干燥机 北京博医康仪器有限公司;RSA224S型分析天平 北京赛多利斯科学仪器有限公司;DBS全自动部分收集器 上海嘉鹏科技有限公司;BT-100恒流泵、HD-21-88紫外检测器 上海琪特分析仪器有限公司;CB150型CO2培养箱 德国BINDER公司;AE31倒置显微镜 麦克奥迪实业集团有限公司;1200型快速分离液相色谱系统 美国Agilent公司;SPECTRA-MAX190型酶标仪 美国Molecular Devices公司;Q Exactive四极杆-轨道阱高分辨质谱仪美国Thermo Fisher Scientiベc公司。
1.3 方法
1.3.1 Sephadex G-25凝胶层析
将分子质量3 kDa肽粉配成35 mg/mL溶液,过膜后用Sephadex G-25进行分离。洗脱液为蒸馏水,洗脱流速0.6 mL/min,上样量3 mL,紫外检测波长280 nm。收集各组分,浓缩、冻干。
1.3.2 Sephadex G-15凝胶层析
将Sephadex G-25得到的2 个组分利用Sephadex G-15进一步分离纯化。洗脱液为蒸馏水,洗脱流速0.6 mL/min,样品质量浓度35 mg/mL,上样量3 mL,于280 nm波长处检测。收集各组分,浓缩、冻干备用。
1.3.3 不同组分对小鼠巨噬细胞RAW264.7分泌细胞因子的影响
1.3.3.1 不同组分对小鼠巨噬细胞RAW264.7的毒性
细胞的分组及处理:RAW264.7巨噬细胞调整密度为4×105个/mL,每孔100 µL接种于96 孔培养板,于37 ℃、5% CO2培养箱中培养3 h,用不同质量浓度样品刺激。空白组:培养液;LPS组:加入终质量浓度10 mg/L LPS;样品组:加入终质量浓度分别为10、50、100 mg/L的样品;LPS+样品组:LPS终质量浓度10 mg/L+同样品组。
MTT法测定细胞活力:上述各处理组细胞孵育24 h后,每孔加入20 μL的5 mg/mL MTT,在相同条件下继续孵育4 h,于1 000×g离心10 min,弃去孔内液体,加入100 μL DMSO,振荡10 min。酶标仪测定OD570nm值。
1.3.3.2 不同组分对RAW264.7巨噬细胞分泌TNF-α和IL-6细胞因子的影响
细胞分组同1.3.3.1节,按试剂盒说明书采用ELISA法测定TNF-α和IL-6含量。
1.3.4 RP-HPLC分析
将免疫活性较好的组分冻干收集,经RP-HPLC分离纯化。样品质量浓度10 mg/mL,上样量40 μL,色谱柱为ZORBAX Eclipse Plus C18(250 mm×4.6 mm,5 μm),检测波长220 nm。流动相A:0.1%(质量分数,下同)三氟乙酸水溶液,流动相B:含0.1%三氟乙酸的乙腈。洗脱梯度:0~30 min,95%~75% A(线性梯度);30~40 min,75% A(等量洗脱);40~60 min,95% A(线性梯度)。将分离得到的组分收集,验证其为单一峰,大量分离收集冻干。
1.3.5 ESI MS/MS鉴定
电喷雾串联质谱(electrospray tandem mass spectrometer,ESI MS/MS)条件:采用电喷雾正离子扫描模式;质量扫描范围m/z 50~750;鞘气为N2,压力为40 au;辅助气为N2,压力为5 au;喷雾压力为4.5 kV;传输毛细管温度350 ℃;二级质谱碰撞电压15 eV。
1.3.6 榛仁免疫活性肽的合成
采用标准的固相化学合成方法,合成多肽,其纯度为99.52%。由北京中科亚光生物科技有限公司合成。
1.3.7 细胞毒性实验
细胞的分组及处理:空白组:培养液;LPS组:加入终质量浓度1 μg/mL LPS;样品组:加入终浓度分别为12.5、25.0、50.0、100.0 μmol/L的样品。MTT法测定细胞活力方法同1.3.3.1节。
1.3.8 小鼠脾淋巴细胞增殖实验
[20]制备细胞悬液,小鼠脱颈处死,小鼠脾脏用无菌注射器芯挤压研磨,并用1640培养液冲洗筛网,200 目尼龙网过滤到EP管中,制成细胞悬液。1 800 r/min离心6 min,弃上清液。细胞沉淀中加入红细胞裂解液,静置5 min。1 800 r/min离心6 min,弃上清液。加入1640培养液(10%胎牛血清),吹打均匀,计数,调整细胞浓度为2×106个/mL。向每个孔内加入100 μL淋巴细胞悬浮液,再加100 μL样品,5% CO2、37 ℃条件下培养72 h。刺激组样品与10 μL ConA(终质量浓度5 μg/mL)同时加入。结束前4 h,向每孔中加20 μL 5 mg/mL MTT。培养结束后,弃掉细胞液,向每孔中加100 μL DMSO,显色10 min。酶标仪测定OD570nm值。按式(1)计算淋巴细胞增殖率。

1.3.9 PEDEFR对小鼠RAW264.7巨噬细胞吞噬中性红功能的影响
根据苏娣等[21]实验方法测定小鼠RAW264.7巨噬细胞的吞噬中性红能力,酶标仪测定OD540nm值。按式(2)计算中性红吞噬率。

1.4 数据统计分析
2 结果与分析
2.1 Sephadex G-25分离
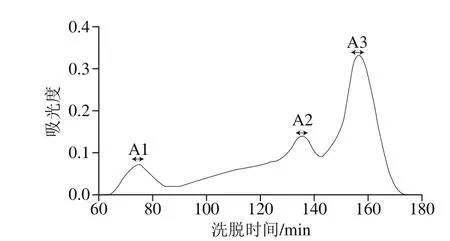
图1 Sephadex G-25葡聚糖凝胶层析图谱Fig. 1 Sephadex G-25 chromatogram
由图1可知,分子质量小于3 k D a的组分经Sephadex G-25分离后得到A1、A2和A3,共3 个组分。A1组分样品太少,不足以进行后续分析,故对A2和A3两个组分进一步分离纯化。
2.2 Sephadex G-15分离
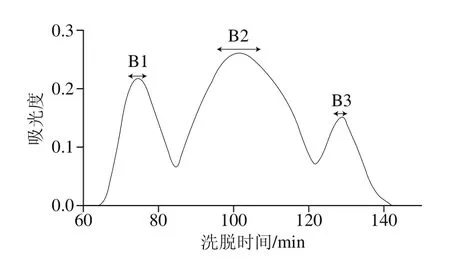
图2 组分A2的Sephadex G-15分离图谱Fig. 2 Chromatogram of A2 separated on a column of Sephadex G-15

图3 组分A3 Sephadex G-15分离图谱Fig. 3 Chromatogram of A3 separated on a column of Sephadex G-15
图2中A2组分经Sephadex G-15分离,得到B1、B2和B3,共3 个组分,图3中A3组分经分离后得到B4、B5、B6和B7,共4 个组分。收集冻干,测定其免疫活性。
2.3 Sephadex G-15凝胶层析组分细胞毒理性
MTT法检测原理为活细胞中的氧化还原酶使MTT还原为不溶性物质甲瓒沉淀于细胞中,是一种广泛应用于检测细胞增殖、生存能力和药物毒性的方法[22]。图4结果显示,与LPS相比,B5、B6、B7组分单独处理RAW264.7巨噬细胞后在一定质量浓度下能显著提高细胞活性,其他组分对细胞活性影响不显著(P>0.05)。由图5可知,与空白组和LPS组相比,B1~B7组分,在不同质量浓度下经LPS共同刺激RAW264.7巨噬细胞后,细胞活性没有显著差异(P>0.05)。说明样品在质量浓度为10、50、100 mg/L时对细胞没有明显毒性,选此质量浓度进行后续实验。
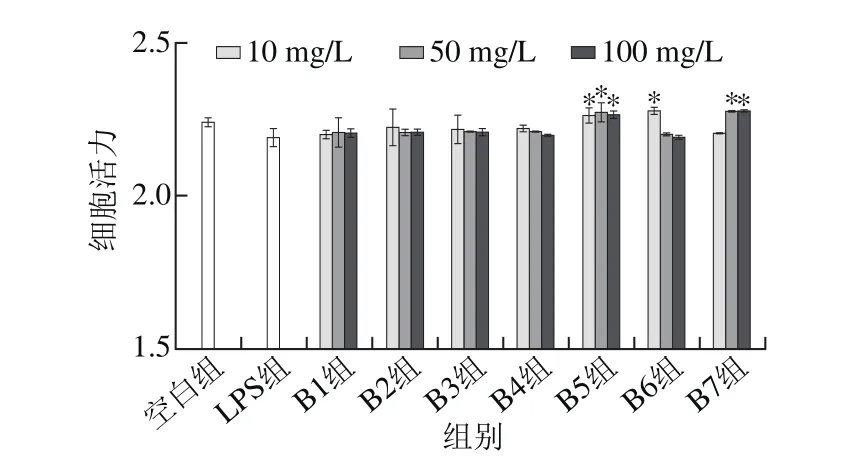
图4 不同组分对小鼠RAW264.7巨噬细胞活性影响Fig. 4 Effects of different peptide fractions on the phagocytosis of RAW264.7 cells
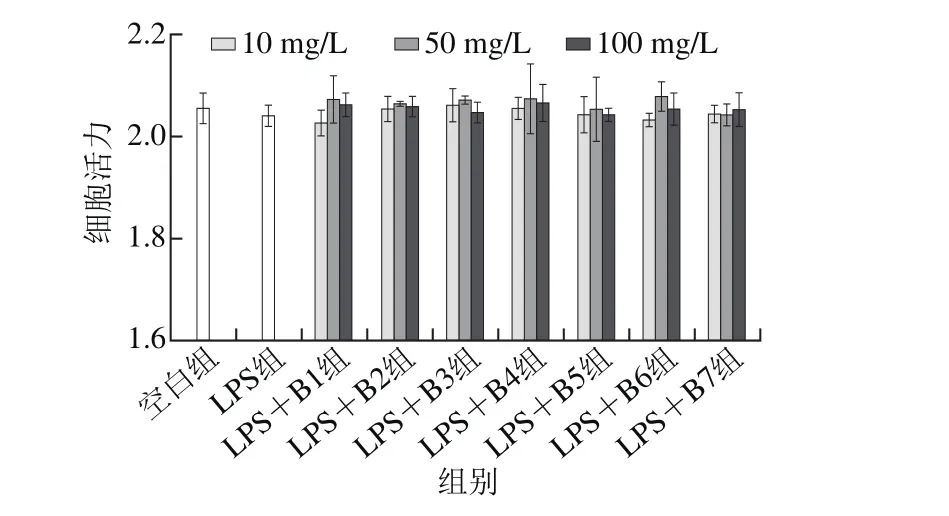
图5 不同组分与LPS共同作用对小鼠RAW264.7巨噬细胞活性影响Fig. 5 Effects of different peptide fractions combined with LPS on the phagocytosis of RAW264.7 cells
2.4 Sephadex G-15凝胶层析组分对体外LPS诱导的RAW264.7巨噬细胞分泌TNF-α、IL-6的影响
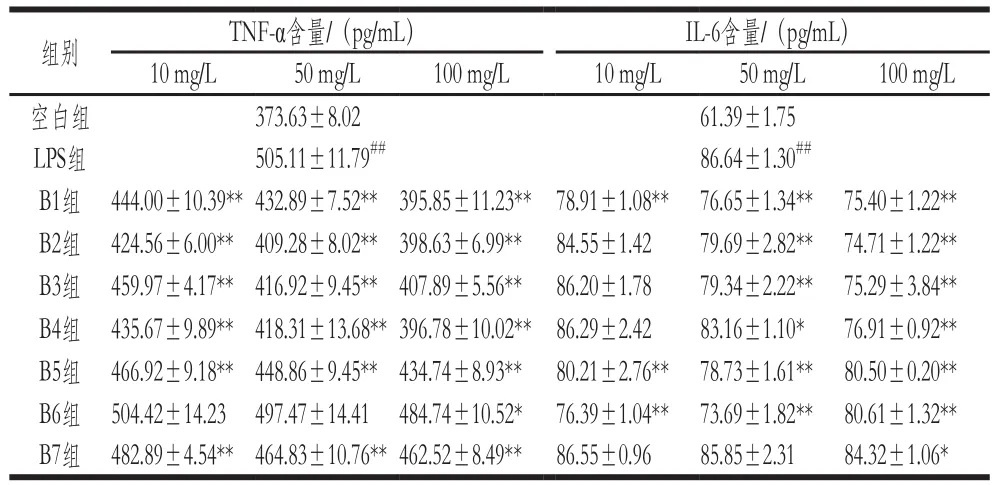
表1 不同组分对小鼠RAW264.7巨噬细胞分泌TNF-α、IL-6的影响(n=3)Table 1 Effects of peptide fractions on the production of TNF-α and IL-6 in RAW264.7 cells (n= 3)
TNF-α是由活化的巨噬细胞分泌的关键促炎因子,它对机体的免疫功能和炎症反应发挥重要作用[23]。由表1可知,与空白组相比,各组分细胞因子TNF-α的分泌量随着质量浓度的增加而降低。与LPS组相比,除B6组外,各组分在高质量浓度极显著地抑制巨噬细胞分泌的TNF-α的产生(P<0.01)。研究发现,其他蛋白水解物也有类似的效果,如杏仁水解蛋白和紫贻贝水解蛋白能有效抑制TNF-α的产生,抑制率分别为64.53%、58.90%[24-25]。
IL-6是多功能炎症细胞因子,它通过参与炎症反应发挥免疫功能[26]。由表1可知,与LPS组相比,B1、B5、B6组分对LPS活化后的巨噬细胞分泌的IL-6含量均有极显著地抑制作用(P<0.01);B2、B3、B4组分在100 mg/L时对LPS诱导的RAW264.7巨噬细胞产生IL-6分泌量有极显著地降低作用(P<0.01);而B7组分在100 mg/L时,对IL-6的分泌量有显著地降低作用(P<0.05)。结果表明,B1、B5、B6组分在该质量浓度范围内能极显著抑制IL-6的产生(P<0.01),进而调节机理免疫功能。在其他文献中也有植物蛋白对IL-6的产生有抑制作用的报道,Toopcham等[27]发现豌豆水解物比豌豆蛋白能更显著抑制IL-6的产生。
由以上得出,B1组分免疫活性较好,对其进行RPHPLC分离纯化。
2.5 榛仁免疫活性肽的RP-HPLC分离与ESI MS/MS鉴定
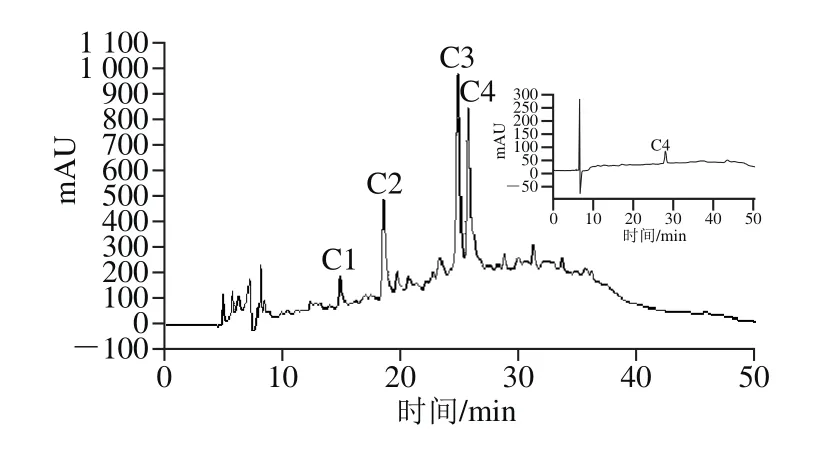
图6 C4组分的RP-HPLC图谱Fig. 6 RP-HPLC analysis of fraction C4
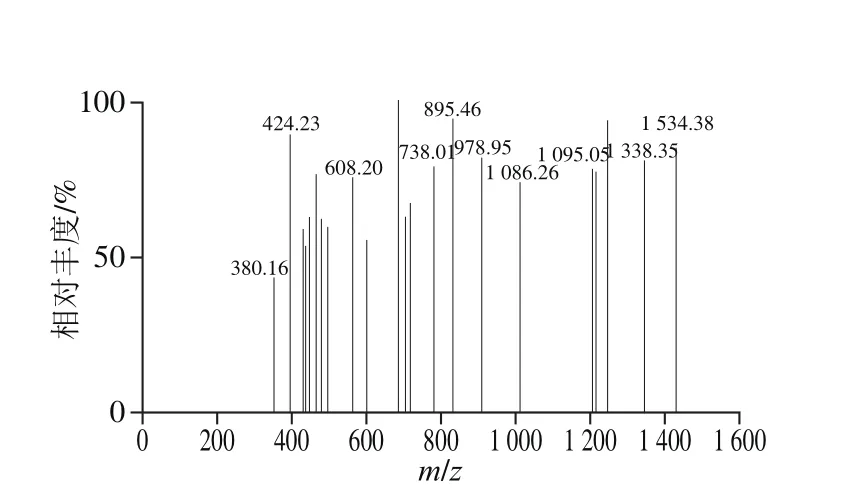
图7 C4组分一级质谱图Fig. 7 Mass spectrum of fraction C4
图6为组分B1经RP-HPLC分离后,得到C1、C2、C3和C4,共4 个组分。将C4收集后,经一级质谱(图7)和二级质谱(图8)鉴定获得多肽氨基酸序列。根据质谱结果和肽段序列可信度及构效关系筛选出1 个多肽,分子质量为791.82 Da,氨基酸序列Pro-Glu-Asp-Glu-Phe-Arg。
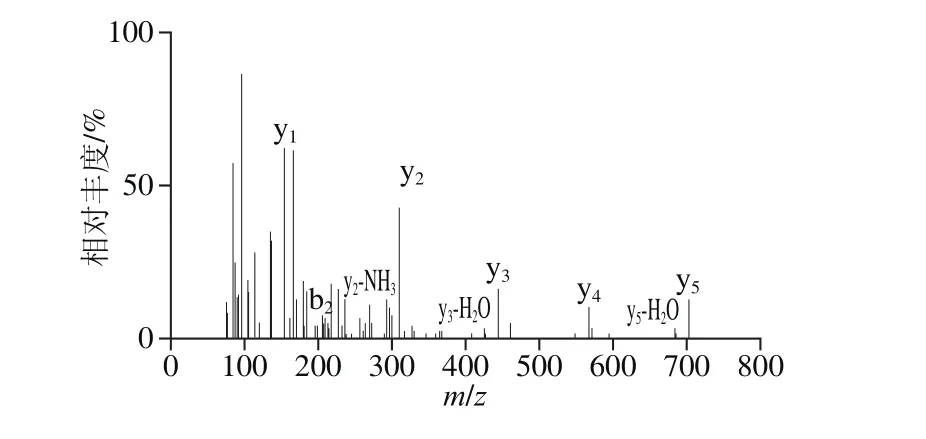
图8 PEDEFR的二级质谱图Fig. 8 Tandem mass spectrum of PEDEFR
2.6 PEDEFR对小鼠RAW264.7巨噬细胞增殖能力和吞噬能力的影响
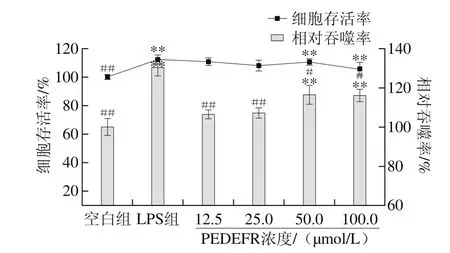
图9 PEDEFR对小鼠RAW264.7巨噬细胞增殖能力和吞噬能力的影响Fig. 9 Effect of PEDEFR on the proliferation and phagocytosis of RAW264.7 cells
由图9可知,与LPS组相比,PEDEFR在该浓度范围内对细胞存活率无显著性差异(P>0.05),说明PEDEFR对细胞无毒害作用,因此选择12.5、25.0、50.0、100.0 μmol/L进行下一步实验。
巨噬细胞通过直接吞噬和细胞内杀伤病原体参与机体免疫反应,其吞噬能力与机体免疫应答能力密切相关[28-29]。由图9可知,与空白组相比,PEDEFR在50 μmol/L和100 μmol/L时可以极显著促进巨噬细胞吞噬中性红(P<0.01),且表现为浓度依赖关系。这与Yoshikawa等[30]从大米清蛋白酶解物中获得的Gly-Tyr-Pro-Met-Tyr-Pro-Leu-Arg类似,免疫活性可能是由于疏水性氨基酸占比较大。Yang Ruiyue等[31]从马哈鱼蛋白水解多肽发现其能促进巨噬细胞增殖和促进淋巴增殖,经检测发现多肽中富含Glu、Asp、Lys和Leu。其中疏水性氨基酸和碱性氨基酸所占比例较大,与PEDEFR氨基酸组成类似。
2.7 PEDEFR对脾淋巴细胞增殖能力的影响
由图10A可知,与100 μmol/L PEDEFR相比,50 μmol/L对淋巴细胞增殖率的影响无显著性差异(P>0.05),与低浓度(<50 μmol/L)相比差异极显著(P<0.01)。各个浓度PEDEFR对淋巴细胞增殖均有促进作用,并呈浓度依赖性,在100 μmol/L时,增殖率达到44.21%。由图10B可知,与100 μmol/L PEDEFR和ConA共同作用相比,50 μmol/L对淋巴细胞增殖率的影响无显著性差异(P>0.05),与低浓度(<50 μmol/L)相比差异极显著(P<0.01),在100 μmol/L时增殖率达到53.22%。在ConA刺激下淋巴细胞增殖能力显著提高(P<0.01)。结果表明,PEDEFR能刺激淋巴细胞增殖,并呈一定浓度依赖性,且高浓度比低浓度效果明显。与对淋巴细胞增殖率为35.92%的相同浓度鳕鱼肽Asn-Gly-Met-Thr-Tyr相比,增殖作用明显[20]。Sütas等[32]对K-酪蛋白酶解后分离出肽段Phe-Phe-Ser-Asp-Lys,在10 μg/mL时能显著促进淋巴细胞增殖(P<0.01),该肽段中疏水性氨基氮和碱性氨基酸所占比例为60%。Cian等[33]用肽链内切酶和肽链外切酶将海藻酶解得到酶解物Phorphyra columbina(PcRH),其中富含Asp、Ala和Glu,能促进大鼠淋巴细胞增殖。
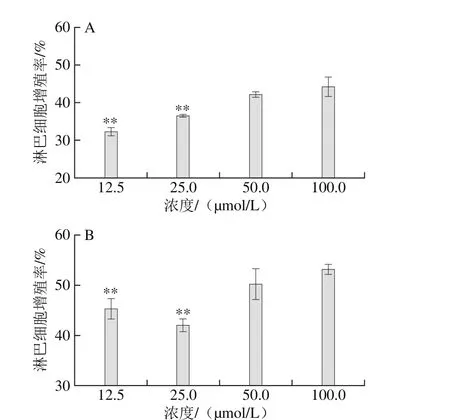
图10 PEDEFR对脾淋巴细胞增殖能力的影响Fig. 10 Effect of PEDEFR on the proliferation of spleen lymphocytes
3 结 论
本研究中,从榛仁分子质量小于3 kDa的水解肽中得到免疫活性肽Pro-Glu-Asp-Glu-Phe-Arg(PEDEFR),分子质量为791.82 Da,这与报道的免疫活性肽分子质量小于2 000 Da结果相符。研究利用小鼠细胞进行体外免疫活性实验,结果表明,PEDEFR具有良好的细胞吞噬能力,在浓度50~100 μmol/L时,随着浓度的升高,促进巨噬细胞吞噬中性红能力升高。这与马哈鱼蛋白水解肽所报道的结果类似,其氨基酸组成都含有氨基酸Glu、Asp。而大米清蛋白酶解物中含有与PEDEFR相同的氨基酸Pro、Arg。由此推测,巨噬细胞吞噬中性红能力可能与氨基酸组成存在一定联系。利用小鼠脾细胞进行脾淋巴细胞增殖实验,实验表明经PEDEFR处理的脾细胞,其细胞增殖率达到44.21%,在ConA共同作用下增殖率达到53.22%,与鳕鱼来源的免疫活性肽Asn-Gly-Met-Thr-Tyr相比,其促进淋巴细胞增殖效果更好。
综上所述,PEDEFR可以提高巨噬细胞吞噬能力和促进ConA诱导的淋巴细胞增殖,从而提高小鼠细胞免疫活性。PEDEFR在细胞水平有良好的免疫活性,为榛仁免疫活性肽研究提供一定参考依据。
参考文献:
[1] 田文翰, 梁丽松, 王贵禧. 不同品种榛子种仁营养成分含量分析[J].食品科学, 2012, 33(8): 265-269.
[2] 杜艳萍, 刘春雷, 闵伟红, 等. 长白山榛仁分离蛋白及其主要组分的功能性质研究[J]. 现代食品科技, 2015, 31(5): 109-115.DOI:10.13982/j.mfst.1673-9078.2015.5.018.
[3] HOSSEINPOUR A, SEIFI E, JAVADI D, et al. Nut and kernel characteristics of twelve hazelnut cultivars grown in Iran[J].Scientia Horticulturae, 2013, 150(2): 410-413. DOI:10.1016/j.scienta.2012.11.028.
[4] 赵谋明, 任娇艳. 食源性生物活性肽结构特征与生理活性的研究现状与趋势[J]. 中国食品学报, 2011, 11(9): 69-81. DOI:10.16429/j.1009-7848.2011.09.023.
[5] AYDEMIR L Y, GÖKBULUT A A, BARAN Y, et al. Bioactive,functional and edible film-forming properties of isolated hazelnut(Corylus avellana L.) meal proteins[J]. Food Hydrocolloids, 2014, 36:130-142. DOI:10.1016/j.foodhyd.2013.09.014.
[6] 程媛, 曹慧, 徐斐, 等. 食源性蛋白中免疫活性肽的研究进展[J].食品科学, 2015, 36(17): 296-299. DOI:10.7506/spkx1002-6630-201517054.
[7] AGYEI D, ONGKUDON C M, WEI C Y, et al. Bioprocess challenges to the isolation and purification of bioactive peptides[J]. Food and Bioproducts Processing, 2016, 98: 244-256. DOI:10.1016/j.fbp.2016.02.003.
[8] CUCU T, PLATTEAU C, TAVERNIERS I, et al. Effect of partial hydrolysis on the hazelnut and soybean protein detectability by ELISA[J]. Food Control, 2013, 30(2): 497-503. DOI:10.1016/j.foodcont.2012.07.017.
[9] GE P Z, ZHOU C Q, AMP E. Research progress in the preparation,separation and puriベcation of bioactive peptide derived from food[J].Science and Technology of Food Industry, 2014, 35(4): 363-368.DOI:10.13386/j.issn1002-0306.2014.04.039.
[10] 王秋韫, 庞广昌, 陈庆森. 免疫活性肽的研究进展与展望[J]. 食品科学, 2002, 23(7): 136-139.
[11] 卜汉萍, 王璐, 许宙, 等. 免疫活性肽的酶法制备及其活性机制研究进展[J]. 食品与机械, 2014, 30(3): 244-248.
[12] SUI X N, JIANG L Z, LI Y, et al. The study on extracting protein from hazelnut kernel by aqueous enzymatic extraction method[J]. Procedia Engineering, 2011, 15: 4661-4672. DOI:10.1016/j.proeng.2011.08.874.
[13] KAWASAKI Y, ISODA H, TANIMOTO M, et al. Inhibition by lactoferrin and κ-casein glycomacropeptide of binding of cholera toxin to its receptor[J]. Bioscience, Biotechnology and Biochemistry, 1992, 56(2):195-198. DOI:10.1271/bbb.56.195.
[14] HIRAI S, HORII S, MATSUZAKI Y, et al. Anti-inぼammatory eあect of pyroglutamyl-leucine on lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. Life Sciences, 2014, 117(1): 1-6. DOI:10.1016/j.lfs.2014.08.017.
[15] CHEN J R, SUETSUNA K, YAMAUCHI F. Isolation and characterization of immunostimulative peptides from soybean[J].Journal of Nutritional Biochemistry, 1995, 6(6): 310-313.DOI:10.1016/0955-2863(95)00022-r.
[16] 王志超, 安玉会. 生物活性肽的研究进展[J]. 河南医学研究, 2004,13(4): 353-356.
[17] 曹靖文, 黄占旺, 吴少福, 等. 纳豆菌糖肽对RAW264.7巨噬细胞的免疫调节作用[J]. 现代食品科技, 2015, 31(9): 61-67. DOI:10.13982/j.mfst.1673-9078.2015.9.011.
[18] 王明爽, 闵伟红, 沈明浩, 等. 长白山榛仁(Corylus heterophylla Fisch.)蛋白酶解物对小鼠免疫功能的影响[J]. 现代食品科技, 2016,32(2): 1-6; 45. DOI:10.13982/j.mfst.1673-9078.2016.2.001.
[19] REN Dayong, WANG Mingshuang, SHEN Minghao, et al. In vivo assessment of immunomodulatory activity of hydrolysed peptides from Corylus heterophylla Fisch[J]. Journal of the Science of Food and Agriculture, 2016, 96(10): 3508-3014. DOI:10.1002/jsfa.7535.
[20] HOU H, FAN Y, LI B, et al. Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J]. Food Chemistry, 2012, 134(2): 821-828.DOI:10.1016/j.foodchem.2012.02.186.
[21] 苏娣, 张芸, 戴竹青, 等. 毛蕊花糖对巨噬细胞RAW264.7的免疫调节作用[J]. 食品科学, 2013, 34(7): 250-253.
[22] STEPANENKO A A, DMITRENKO V V. Pitfalls of the MTT assay: direct and off-target effects of inhibitors can result in over/underestimation of cell viability[J]. Gene, 2015, 574(2): 193-203.DOI:10.1016/j.gene.2015.08.009.
[23] HAM Y M, KO Y J, SONG S M, et al. Anti-inflammatory effect of litsenolide B2 isolated from Litsea japonica, fruit via suppressing NF-κB and MAPK pathways in LPS-induced RAW264.7 cells[J]. Journal of Functional Foods, 2015, 13: 80-88. DOI:10.1016/j.jff.2014.12.031.
[24] AHN C B, JE J Y, CHO Y S. Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J]. Food Research International, 2012, 49(1): 92-98.DOI:10.1016/j.foodres.2012.08.002.
[25] KIM Y S, AHN C B, JE J Y. Anti-inぼammatory action of high molecular weight Mytilus edulis hydrolysates fraction in LPS-induced RAW264.7 macrophage via NF-κB and MAPK pathways[J]. Food Chemistry, 2016,202: 9-14. DOI:10.1016/j.foodchem.2016.01.114.
[26] YU Q, ZENG K W, MA X L, et al. Resokaempferol-mediated antiinflammatory effects on activated macrophages via the inhibition of JAK2/STAT3, NF-κB and JNK/p38 MAPK signaling pathways[J].International Immunopharmacology, 2016, 38: 104-114. DOI:10.1016/j.intimp.2016.05.010.
[27] TOOPCHAM T, MES J J, WICHERS H J, et al. Immunomodulatory activity of protein hydrolysates derived from Virgibacillus halodenitrificans, SK1-3-7 proteinase[J]. Food Chemistry, 2017, 224:320-328. DOI:10.1016/j.foodchem.2016.12.041.
[28] HUNTER M, WANG Y, EUBANK T, et al. Survival of monocytes and macrophages and their role in health and disease[J]. Frontiers in Bioscience, 2009, 14: 4079-4102. DOI:10.2741/3514.
[29] PARIHAR A, EUBANK T D, DOSEFF A I. Monocytes and macrophages regulate immunity through dynamic networks of survival and cell death[J]. Journal of Innate Immunity, 2010, 2(3): 204-215.DOI:10.1159/000296507.
[30] YOSHIKAWA M, KISHI K, TAKAHASHI M, et al. Immunostimulating peptide derived from soybean protein[J]. Annals of the New York Academy of Sciences, 1993, 685(1): 375-376. DOI:10.1111/j.1749-6632.1993.tb35892.
[31] YANG Ruiyue, ZHANG Zhaofeng, PEI Xinrong, et al.Immunomodulatory effects of marine oligopeptide preparation from chum salmon (Oncorhynchus keta) in mice[J]. Food Chemistry, 2009,113(2): 464-470. DOI:10.1016/j.foodchem.2008.07.086.
[32] SÜTAS Y, SOPPI E, KORHONEN H, et al. Suppression of lymphocyte proliferation in vitro by bovine caseins hydrolyzed with Lactobacillus casei GG-derived enzymes[J]. Journal of Allergy and Clinical Immunology, 1996, 98(1): 216-224. DOI:10.1016/S0091-6749(96)70245-2.
[33] CIAN R E, LÓPEZ-POSADAS R, DRAGO S R, et al. A Porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB, and p38 and JNK dependent mechanism[J]. Food Chemistry, 2012, 134(4): 1982-1990. DOI:10.1016/j.foodchem.2012.03.134.
