绿豆皮可溶性膳食纤维的抗氧化作用
2018-02-28王雅琪马丽苹朱文学姬青华关宁宁薛依涵
罗 磊,王雅琪,马丽苹,朱文学*,张 宽,姬青华,关宁宁,薛依涵
(河南科技大学食品与生物工程学院,河南省食品原料工程技术研究中心,河南 洛阳 471023)
绿豆(Phaseolus radiatus L.)在我国有两千多年的栽培历史,有清凉解毒、止泻利尿、消热解暑等功效。绿豆皮是指泡发绿豆后揉搓下来的种皮,中医称为绿豆衣,有报道指出绿豆的食疗保健功能主要来自其种皮[1],但目前绿豆皮多作为废渣或饲料,而未被充分利用。绿豆皮中富含膳食纤维(dietary fiber,DF)、黄酮和生物碱等生物活性物质,其中DF含量高达65.85%[2],有研究人员对绿豆皮中DF的提取[3]及结构[4]进行了研究。袁艳娟等[5]发现绿豆皮DF有较好的持水力和溶胀力;王倩等[6]研究了绿豆皮不溶性DF的提取及理化性质。而迄今为止,国内外对绿豆皮DF尤其是可溶性膳食纤维(soluble dietary fiber,SDF)功能性质方面的研究鲜见报道。
机体在代谢的过程中会产生大量的氧自由基,包括过氧化氢、羟自由基(·OH)、超氧阴离子自由基(O2-·)等[7],这些自由基使多种生物大分子氧化损伤,对基因的表达和调节系统产生影响,导致细胞转录水平降低而引起衰老甚至造成免疫失调。因此,研究如何有效清除或抑制自由基的产生对延缓衰老和预防疾病有重要的意义。Zhu Fengmei等[8]指出青稞麸皮DF具有抗氧化活性;王磊等[9]发现椪柑渣中SDF对·OH、O2-·和1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基均表现出较强清除能力;另外,豆渣[10]和米糠[11]SDF的体外抗氧化活性均已得到证实,而针对绿豆皮中SDF抗氧化作用的研究鲜有报道。故本研究在对绿豆皮SDF体外清除自由基能力研究的同时,采用皮下注射D-半乳糖的方法诱导小鼠衰老模型[12]来研究绿豆皮SDF在体内的抗氧化作用,为绿豆皮SDF开发利用提供科学依据和理论依据。
1 材料与方法
1.1 材料与试剂
绿豆皮由洛阳新农村豆芽厂提供。
SPF级BALB/c小鼠共50 只,鼠龄8周,体质量(20±2)g,雌雄各半,由河南科技大学医学院实验动物中心从华中科技大学同济医学院实验动物中心代购,许可证号:SCXK-(鄂)2010-0009。
DPPH 上海伊卡生物技术有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒、过氧化氢酶(catalase,CAT)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总蛋白含量测定(二喹啉甲酸(bicinchoninic acid,BCA)法)试剂盒 南京建成生物工程研究所;冰醋酸、醋酸钠、无水乙醇、VC、三氯乙酸、氯化铁、硫酸亚铁、铁氰化钾、磷酸二氢钠、磷酸氢二钠、过氧化氢、水杨酸、D-半乳糖、氯化钠等常用试剂均为国产分析纯。
1.2 仪器与设备
HC-1000Y2高速多功能粉碎机 永康市天祺盛世工贸有限公司;HMB-701超微粉碎机 北京环亚天元机械技术有限公司;TDZ5-WS台式低速离心机、TGL-20M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;PHS-3C pH计 上海越平科学仪器有限公司;101-2-BS电热恒温鼓风干燥箱 上海跃进医疗器械厂;UV2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;HH-S恒温水浴锅 江苏金坛市亿通电子有限公司;FA1004型电子分析天平 上海上平仪器公司;电子天平 常熟市金羊砝码仪器有限公司;微型漩涡混合仪 上海沪西分析仪器厂有限公司;立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;玻璃匀浆器 江阴市精英玻璃制品厂。
1.3 方法
1.3.1 绿豆皮SDF的制备
绿豆皮经蒸馏水反复清洗、除杂后,在室温下干燥至恒质量,后经高速粉碎机粉碎后过50 目筛,得到绿豆皮粗粉,然后放入超微粉碎机(1.5 kW)中粉碎,过400 目筛得到绿豆皮超微粉(此时样品通过400 目筛而未通过500 目筛,粒径为38~25 μm)。根据GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》[13]进行绿豆皮SDF制备,所得绿豆皮SDF固体放在40 ℃电热鼓风干燥箱中干燥,称质量,得到绿豆皮SDF得率为9.52%,略高于李积华[14]采用改良的Southgate法测定绿豆皮SDF的含量(9.063%)。
1.3.2 绿豆皮SDF体外抗氧化作用1.3.2.1 还原力的测定
采用铁氰化钾法[15]进行还原力的测定。用移液枪量取0.4 mL不同质量浓度(0.062 5~4.000 0 mg/mL)的样品溶液,加入2.5 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL质量分数为1%的铁氰化钾溶液,混匀后在50 ℃水浴锅中反应20 min,快速置于冰水中冷却。再加入2.5 mL质量分数为10%的三氯乙酸溶液,混匀,3 000 r/min离心10 min。取上清液,加入2.5 mL蒸馏水和质量分数为1%的FeCl3溶液0.5 mL,混匀后静置10 min,在700 nm波长处测定其吸光度。用蒸馏水代替样品做相同操作并以此为空白对照,VC作为阳性对照,做3 次平行实验。
1.3.2.2 DPPH自由基清除率计算
参考朱文学等[16]的方法,并稍作改动,配制不同质量浓度(0.062 5~4.000 0 mg/mL)的绿豆皮SDF溶液,用蒸馏水作为空白对照,在517 nm波长处检测吸光度。以VC作为阳性对照,重复3 组取平均值。按式(1)计算DPPH自由基清除率。
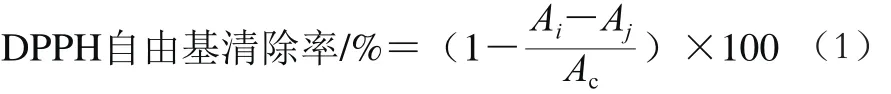
式中:Ai为DPPH溶液和不同质量浓度的样品或VC混合溶液的吸光度;Aj为无水乙醇和不同质量浓度的样品或VC混合溶液吸光度;Ac为DPPH溶液和蒸馏水混合溶液的吸光度。
1.3.2.3 ·OH清除率计算
参考Lai Furao等[17]的方法,并稍作改动,配制不同质量浓度(0.062 5~4.000 0 mg/mL)的绿豆皮SDF溶液,用蒸馏水作为空白对照,在510 nm波长处检测吸光度。以VC作为阳性对照,设3 组平行,取平均值。按式(2)计算·OH清除率。
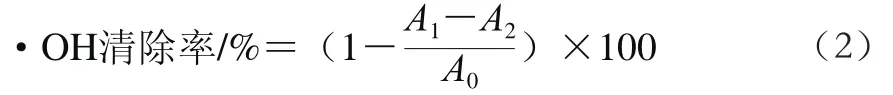
式中:A1为FeSO4溶液、不同质量浓度的样品或VC溶液、30% H2O2溶液(质量分数,下同)、水杨酸混合溶液的吸光度;A2为FeSO4溶液、不同质量浓度的样品或VC溶液、30% H2O2溶液、无水乙醇混合溶液的吸光度;A0为FeSO4溶液、蒸馏水、30% H2O2溶液、水杨酸混合溶液的吸光度。
1.3.3 绿豆皮SDF对小鼠体内抗氧化作用
1.3.3.1 动物分组、造模与给药
实验期间,50 只小鼠分笼饲喂普通饲料,自由摄食和饮水,适应性培养1 周后随机分为5 组:正常对照组、模型组、绿豆皮SDF低剂量组(200 μg/g)、中剂量组(400 μg/g)、高剂量组(600 μg/g),每组10 只,雌雄各半,模型组和绿豆皮SDF各剂量组小鼠颈背部皮下注射D-半乳糖(200 mg/kg体质量)构建衰老小鼠模型,正常对照组注射等体积的生理盐水。每日给药1 次,连续给药30 d,绿豆皮SDF各剂量组灌胃绿豆皮SDF溶液,灌胃体积为20 mL/kg体质量[18],正常对照组和模型组灌胃等体积的生理盐水。
1.3.3.2 小鼠血清及肝组织样品制备
给药第30天小鼠空腹过夜,各组小鼠称体质量后眼眶采血,4 ℃、3 000 r/min离心15 min分离血清,取上清液,-20 ℃保存待测。小鼠取血后颈椎脱臼处死,快速取出肝脏,以冰生理盐水洗去浮血,滤纸吸干,迅速称质量。加入9 倍组织质量的已预冷生理盐水(9 mg/mL),冰水浴条件下用玻璃匀浆器迅速研磨匀浆,4 ℃、3 500 r/min离心15 min,取上清液,-20 ℃保存待测。
1.3.3.3 检测指标测定
按照相应试剂盒说明书分别对小鼠血清和肝组织总蛋白含量(BCA法)、T-AOC水平、CAT和T-SOD活力、MDA含量以及小鼠肝组织GSH-Px活力进行测定。T-AOC测定采用Fe3+还原法,CAT活力测定采用钼酸铵比色法,T-SOD活力通过黄嘌呤氧化酶法测定,MDA含量通过硫代巴比妥酸比色法进行测定,GSH-Px活力测定采用二硫对硝基苯甲酸法。
1.4 数据统计分析
2 结果与分析
2.1 体外抗氧化作用
2.1.1 还原力测定结果
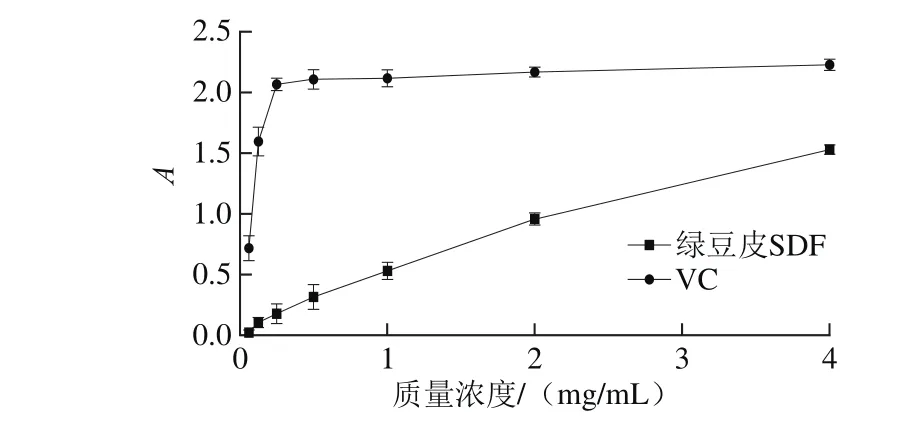
图1 绿豆皮SDF还原力Fig. 1 Reducing power of SDF from mung bean hull
吸光度越高,还原力越强。由图1可以看出,VC的还原力在质量浓度为250 μg/mL时已达到了2.063,之后无明显变化。而绿豆皮SDF的还原力在0.062 5~4.000 0 mg/mL范围内随着质量浓度的增加而增大,当质量浓度为4 mg/mL时,还原力为1.526。在所考察的质量浓度范围内,绿豆皮SDF的还原力不如VC。但与唐孝青等[19]通过浸提法得到梨渣SDF在质量浓度为4 mg/mL时的还原力0.845相比,绿豆皮SDF的还原力较强。
2.1.2 DPPH自由基清除效果
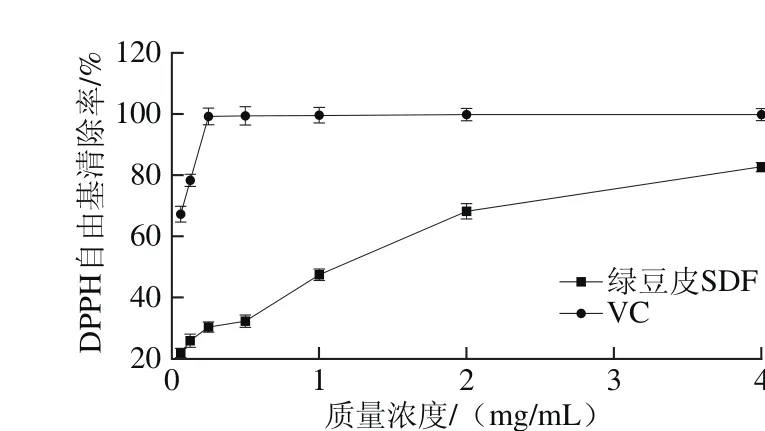
图2 绿豆皮SDF对DPPH自由基的清除作用Fig. 2 Scavenging effect of SDF from mung bean hull against DPPH radicals
由图2可知,V C对D P P H自由基的清除率在250 μg/mL时为99.32%,随着质量浓度的增大其清除率逐渐趋于100%。绿豆皮SDF对DPPH自由基的清除能力呈现出剂量依赖性。当质量浓度为62.5 μg/mL和4 mg/mL时,其清除率分别为21.81%和82.65%。Yan Xiaoguang等[20]通过蒸汽爆破处理小麦麸皮后制备的SDF在5 mg/mL时对DPPH的清除率为87.15%,因此绿豆皮SDF表现出较强的DPPH自由基的清除能力。
2.1.3 ·OH清除效果
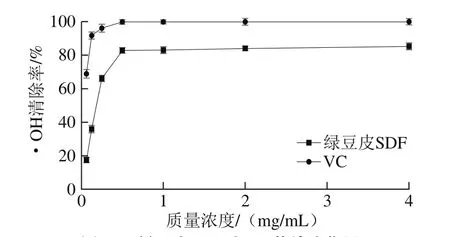
图3 绿豆皮SDF对•OH的清除作用Fig. 3 Scavenging effect of SDF from mung bean hull against hydroxyl radicals
绿豆皮SDF对·OH清除能力结果如图3所示,在质量浓度为0.062 5~4.000 0 mg/mL范围内其清除率与质量浓度有明显的量效关系。随着SDF质量浓度的增大,绿豆皮SDF的·OH清除率也逐渐增大,从62.5 μg/mL时的17.45%到4 mg/mL时的85.16%,而VC的·OH清除率在500 μg/mL时已几乎达到了100%。高辰等[21]利用喷雾剂压结合酶对豆渣SDF进行提取并得出豆渣SDF在4 mg/mL时对·OH清除率为80%左右,进一步证实绿豆皮SDF具有较强清除·OH能力。
2.2 绿豆皮SDF对小鼠的抗氧化作用
2.2.1 绿豆皮SDF对小鼠血清和肝组织中T-AOC水平的影响

表1 绿豆皮SDF对小鼠血清和肝组织中T-AOC水平的影响Table 1 Effect of SDF from mung bean hull on T-AOC in serum and liver tissue of mice
绿豆皮SDF对小鼠T-AOC水平的影响如表1所示,模型组小鼠肝组织和血清T-AOC水平均极显著低于正常对照组(P<0.01),血清中SDF低、中剂量组也极显著低于正常组,肝组织中只有SDF低剂量组极显著低于正常组;与模型组相比,除SDF低剂量组小鼠血清T-AOC水平低于其模型组外,其余小鼠肝组织和血清中各剂量组T-AOC水平均极显著高于模型组,说明中、高剂量的SDF能有效提高小鼠体内T-AOC水平。
2.2.2 绿豆皮SDF对小鼠血清和肝组织中T-SOD活力的影响
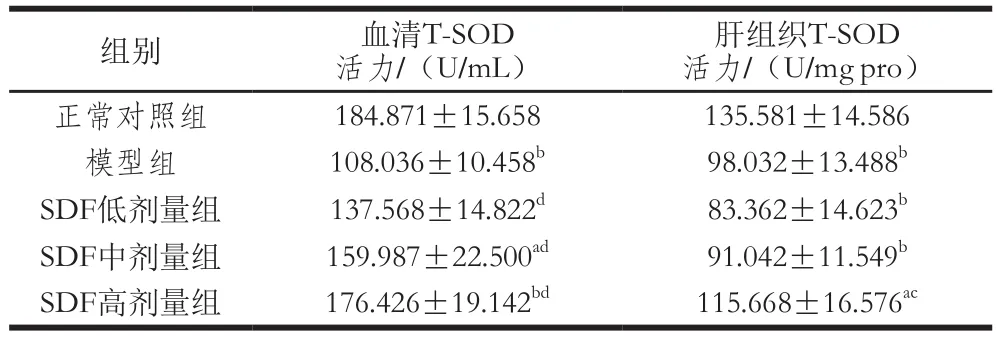
表2 绿豆皮SDF对小鼠血清和肝组织中T-SOD活力的影响Table 2 Effect of SDF from mung bean hull on T-SOD in serum and liver tissue of mice
由表2可知,模型组小鼠肝组织和血清T-SOD活力均极显著低于正常对照组(P<0.01);与模型组相比,小鼠SDF低、中剂量组肝组织中T-SOD活力降低,但差异不显著(P>0.05),其余小鼠血清、肝组织中SDF各剂量组T-SOD活力均提高,其中小鼠SDF各剂量组血清中T-SOD活力与模型组差异极显著(P<0.01),小鼠SDF高剂量组肝组织中T-SOD活力与模型组差异显著(P<0.05)。
2.2.3 绿豆皮SDF对小鼠血清和肝组织中CAT活力的影响

表3 绿豆皮SDF对小鼠血清和肝组织中CAT活力的影响Table 3 Effect of SDF from mung bean hull on CAT activity in serum and liver tissue of mice
表3表明,模型组和SDF低剂量组小鼠肝组织和血清CAT活力均极显著低于正常对照组(P<0.01);小鼠SDF各剂量组与模型组相比CAT活力均有一定的升高,除小鼠血清SDF高剂量组具显著性(P<0.05)外,其他各组小鼠SDF各剂量组与模型组无显著差异(P>0.05)。
2.2.4 绿豆皮SDF对小鼠血清和肝组织中MDA含量的影响

表4 绿豆皮SDF对小鼠血清和肝组织中MDA含量的影响Table 4 Effect of SDF from mung bean hull on MDA content in serumand liver tissue of mice
从表4可以看出,与正常对照组相比,模型组小鼠肝组织和血清MDA含量均极显著增加(P<0.01),SDF低、中剂量组小鼠肝组织中MDA含量升高且有极显著、显著差异;SDF各剂量组小鼠血清MDA含量较模型组均极显著或显著减少。
2.2.5 绿豆皮SDF对小鼠肝组织中GSH-Px活力的影响

表5 绿豆皮SDF对小鼠肝组织中GSH-Px活力的影响Table 5 Effect of SDF from mung bean hull on GSH-Px activity in liver tissue of mice
由表5可知,与正常对照组相比,模型组小鼠肝组织中GSH-Px活力均有所降低,但都不具显著性差异(P>0.05),小鼠SDF高剂量组GSH-Px活力较模型组差异显著(P<0.05)。
2.2.6 模型分析与讨论
皮下注射大剂量的D-半乳糖使机体细胞内半乳糖质量浓度增高,在醛糖还原酶的催化下生成半乳糖醇,这种物质不能被细胞进一步代谢并不断堆积,从而影响细胞渗透压,导致细胞肿胀、功能丧失和代谢紊乱,最终导致衰老的发生[22-23]。机体通过酶系统和非酶系统产生氧自由基,酶系统中最主要的抗氧化酶T-SOD能够催化O2-·发生歧化反应[24],并能有效地清除自由基反应的启动因子(O2-·)来抑制和阻断自由基反应,降低自由基代谢产物(如MDA)的生成,从而达到清除自由基、抗衰老的作用[25];CAT虽然不能直接清除·OH,但其可以分解体内·OH的前体过氧化氢,生成对人体无害的水来降低过氧化氢的浓度[26],从而起到延缓衰老的作用;GSH-Px是一种重要的催化过氧化氢分解的酶,对活性氧和组织产生的·OH及过氧化氢有较强的清除能力[27],GSH-Px通过硒代半胱氨酸的形式发挥作用,以谷胱甘肽为还原剂来分解体内的脂质过氧化物,因此它可以使细胞膜与其他生物组织免受过氧化损伤[28],GSH-Px也可与CAT协同作用,加速过氧化氢的分解来达到减少自由基和过氧化脂质形成的作用[29];非酶系统中MDA能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用形成脂质过氧化物。氧自由基不但通过生物膜中多不饱和脂肪酸的过氧化引起细胞损伤,还能通过脂类过氧化物的分解产物引起细胞损伤,因此MDA含量可反映机体内脂质过氧化的程度,间接反映出细胞损伤即机体受自由基攻击的严重程度[30]。
本研究通过D-半乳糖皮下注射(200 mg/kg)构建衰老动物模型来评估绿豆皮SDF粗提物的抗氧化活性。结果显示与正常对照组相比,模型组小鼠血清和肝组织中总蛋白含量、T-AOC水平以及T-SOD、CAT、GSH-Px活力均有所降低,MDA含量大幅升高,且大部分差异显著或极显著,因此说明本研究衰老动物模型构建基本成功。
在衰老模型的基础上进行绿豆皮SDF各剂量组对小鼠血清及肝组织的抗氧化能力影响的研究。综合表1~5分析,与模型组比较,SDF各剂量组不同性别小鼠血清和肝组织中MDA含量表现出不同程度的降低,SDF低、中、高剂量组小鼠血清MDA含量分别降低了23.0%、25.5%、30.0%,肝组织中分别降低了14.4%、26.0%、48.3%,这可能是由于绿豆皮SDF能够稳定细胞膜结构、抑制脂质过氧化从而有效地降低小鼠体内MDA含量。灌胃一定剂量的绿豆皮SDF后,小鼠低剂量组血清T-AOC水平、肝组织T-SOD活力及中剂量组肝组织T-SOD活力低于模型组,但均无显著差异,这可能是由于低剂量的SDF对机体抗氧化作用不明显且小鼠之间存在较大个体差异。随着绿豆皮SDF剂量不断增加,高SDF剂量组小鼠血清和肝组织T-AOC水平以及T-SOD、CAT、GSH-Px活力均显著高于模型组,其中高剂量组小鼠血清T-AOC水平以及T-SOD、CAT活力分别提高了121%、63.3%、59.7%,而肝组织中血清T-AOC水平、T-SOD、CAT活力以及GSH-Px活力较模型组相比分别提高了104%、18.0%、63.0%、45.0%。同时,各剂量组小鼠血清和肝组织中T-AOC水平以及T-SOD、CAT、GSH-Px活力呈现出剂量相关性。由此可以看出,绿豆皮SDF尤其是高剂量的SDF具有一定的提高D-半乳糖衰老模型小鼠血清和肝组织中T-AOC水平以及T-SOD、CAT、GSH-Px活力和降低MDA含量的作用。
3 结 论
体外抗氧化实验表明,绿豆皮SDF在质量浓度为4 mg/mL时,还原力为1.526,对DPPH自由基和·OH均表现出较强的清除率,分别为82.65%和85.16%。体内抗氧化实验结果显示,与正常对照组相比,不同性别模型组小鼠血清和肝组织中总蛋白含量、T-AOC水平以及T-SOD、CAT、GSH-Px活力均有所降低,MDA含量大幅升高,且大部分差异显著(P<0.05),说明本研究衰老动物模型构建基本成功;与模型组相比,各剂量组小鼠血清和肝组织中总蛋白含量、T-AOC水平以及T-SOD、CAT、GSH-Px活力呈现出剂量相关性。结果表明绿豆皮SDF能有效提高小鼠血清和肝组织中总蛋白含量、降低MDA含量,高剂量SDF可显著提高小鼠血清和肝组织T-AOC水平以及T-SOD、CAT、GSH-Px活力。
综上所述,绿豆皮SDF具有较强的清除自由基的能力,一定量的绿豆皮SDF能够有效增强机体清除自由基的能力,因此绿豆皮SDF具有良好的抗氧化和延缓衰老的作用。
[1] 卫莉, 钟秀珍, 张宝才, 等. 绿豆皮中黄酮类化合物的提取及定量测定[J]. 郑州轻工业学院学报(自然科学版), 2001, 16(1): 58-62.DOI:10.3969/j.issn.1004-1478.2001.01.017.
[2] 邓志汇, 王娟. 绿豆皮与绿豆仁的营养成分分析及对比[J]. 现代食品科技, 2010, 26(6): 656-659.
[3] 张洪微, 冯传威, 陶园钊, 等. 绿豆皮膳食纤维提取的研究[J].农产品加工(学刊), 2006(7): 38-40. DOI:10.3969/j.issn.1671-9646-B.2006.07.011.
[4] 王大为, 赵鑫, 董欣, 等. 发芽对绿豆皮膳食纤维结构及性质的影响[J].食品科学, 2016, 37(23): 111-117. DOI:10.7506/spkx1002-6630-201623019.
[5] 袁艳娟, 金苗, 赵珺, 等. 响应曲面法优化绿豆皮中膳食纤维的提取工艺[J]. 安徽农业科学, 2008, 36(23): 9900-9901; 9986. DOI:10.3969 /j.issn.0517-6611.2008.23.017.
[6] 王倩, 马丽苹, 焦昆鹏, 等. 绿豆皮不溶性膳食纤维提取及其性质研究[J]. 农产品加工(上半月), 2015(7): 12-15. DOI:10.3969/j.issn.1671-9646(X).2015.07.032.
[7] HARMAN D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300. DOI:10.1093/geronj/11.3.298.
[8] ZHU Fengmei, DU Bin, XU Baojun. Superfine grinding improves functional properties and antioxidant capacities of bran dietary fibre from Qingke (hull-less barley) grown in Qinghai-Tibet Plateau, China[J].Journal of Cereal Science, 2015, 65: 43-47. DOI:10.1016/j.jcs.2015.06.006.
[9] 王磊, 袁芳, 向俊, 等. 响应面法优化高压均质提取椪柑渣中可溶性膳食纤维及抗氧化活性研究[J]. 中国食品学报, 2015, 15(5): 82-89.DOI:10.16429/j.1009-7848.2015.05.011.
[10] 龚思思, 汤小明, 郑俊, 等. 酶法制备的豆渣可溶性膳食纤维组成分析及其抗氧化性能研究[J]. 食品工业科技, 2016, 37(16): 117-121; 126.DOI:10.13386/j.issn1002-0306.2016.16.015.
[11] 钱海峰, 黄冬云, 苑华宁, 等. 纤维素酶对米糠可溶性膳食纤维含量及抗氧化性的影响[J]. 食品工业科技, 2014, 35(15): 112-115; 120.DOI:10.13386/j.issn1002-0306.2014.15.014.
[12] 秦红兵, 杨朝晔, 范忆江, 等. D-半乳糖诱导衰老小鼠模型的建立与评价[J]. 中国组织工程研究与临床康复, 2009, 13(7): 1275-1278.
[13] 国家卫生和计划生育委员会. 食品安全国家标准 食品中膳食纤维的测定: GB 5009.88—2014[S]. 北京: 中国标准出版社, 2014: 5-8.
[14] 李积华. 绿豆酶法水解特性及全绿豆新型饮品的开发研究[D]. 南昌: 南昌大学, 2007: 34-35. DOI:10.7666/d.y1152012.
[15] 郑义, 王卫东, 李勇, 等. 高良姜多糖提取工艺优化及其抗氧化活性[J].食品科学, 2014, 35(2): 126-131. DOI:10.7506/spkx1002-6630-201402023.
[16] 朱文学, 焦昆鹏, 罗磊, 等. 绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性[J]. 食品科学, 2015, 36(16): 12-17. DOI:10.7506/spkx1002-6630-201516003.
[17] LAI Furao, WEN Qibiao, LI Lin, et al. Antioxidant activities of watersoluble polysaccharide extracted from mung bean (Vigna radiata L.) hull with ultrasonic assisted treatment[J]. Carbohydrate Polymers, 2010, 81(2):323-329. DOI:10.1016/j.carbpol.2010.02.011.
[18] 马新方, 李勇. 鱼腥草多糖体内抗氧化活性研究[J]. 中医研究, 2011,24(2): 19-20. DOI:10.3969/j.issn.1001-6910.2011.02.008.
[19] 唐孝青, 焦凌霞, 樊明涛, 等. 梨渣可溶性膳食纤维的提取及抗氧化特性[J]. 西北农业学报, 2010, 19(9): 93-98. DOI:10.3969/j.issn.1004-1389.2010.09.019.
[20] YAN Xiaoguang, YE Ran, CHEN Ye. Blasting extrusion processing: the increase of soluble dietary ベber content and extraction of soluble-ベber polysaccharides from wheat bran[J]. Food Chemistry, 2015, 180: 106-115.DOI:10.1016/j.foodchem.2015.01.127.
[21] 高辰, 朱杰, 王明芳, 等. 豆渣可溶性膳食纤维的提取分析及抗氧化研究[J]. 食品研究与开发, 2013, 34(10): 23-27. DOI:10.3969/j.issn.1005-6521.2013.010.007.
[22] 鞠文博, 于春艳, 陈建光, 等. D-半乳糖致衰老小鼠模型的实验研究[J].北华大学学报(自然科学版), 2015(2): 199-202. DOI:10.11713/j.issn.1009-4822.2015.02.014.
[23] 关萍, 郭搏, 王惠, 等. D-半乳糖促小鼠衰老模型的衰老程度与自然生长鼠龄的比较[J]. 动物医学进展, 2013, 34(1): 71-74. DOI:10.3969/j.issn.1007-5038.2013.01.016.
[24] WANG Mi, MENG Xinyu, YANG Ruile, et al. Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J]. Carbohydrate Polymers, 2012, 89(2): 461-466. DOI:10.1016/j.carbpol.2012.03.029.
[25] CUI Junjian, YUAN Jiangfeng, ZHANG Zhiqi. Anti-oxidation activity of the crude polysaccharides isolated from Polygonum cillinerve (Nakai)Ohwi in immunosuppressed mice[J]. Journal of Ethnopharmacology,2010, 132(2): 512-517. DOI:10.1016/j.jep.2010.08.052.
[26] 刘梦杰, 王飞, 张燕, 等. 黄芩多糖的体内抗氧化活性[J]. 中国食品学报, 2016, 16(7): 52-58. DOI:10.16429/j.1009-7848.2016.07.008.
[27] 刘乔, 管晓辉, 黄翠菊, 等. GA的提取分离工艺优化及其体内抗氧化活性作用[J]. 食品科学, 2015, 36(24): 89-94. DOI:10.7506/spkx1002-6630-201524015.
[28] 余强, 聂少平, 李文娟, 等. 黑灵芝多糖对D-半乳糖致衰老小鼠的作用研究[J]. 食品科学, 2009, 30(17): 305-307. DOI:10.3321/j.issn:1002-6630.2009.17.071.
[29] 张忠华, 朱萱萱, 倪文彭, 等. 首乌软胶囊对衰老小鼠GSH-Px、CAT的影响[J]. 实用中医内科杂志, 2009, 23(1): 25-26. DOI:10.3969/j.issn.1671-7813.2009.01.014.
[30] 杨溢烁, 曾德永, 刘艳, 等. 香菇多糖体内抗氧化活性研究[J]. 中国食物与营养, 2016, 22(8): 72-74. DOI:10.3969/j.issn.1006-9577.2016.08.017.
