山楂果胶寡糖的抑菌性能及机理
2018-02-28牟德华李丹丹
王 巍,牟德华*,李丹丹
当今社会因食源性病菌引起的食物污染严重影响着人们的健康[1]。大量食品的腐败变质是对社会资源的浪费,对社会经济的可持续发展造成不利影响。抑制食源性腐败菌的滋生对延长食品货架期尤为重要[2]。
果胶分子是由半乳糖醛酸以α-1,4糖苷键连接而成的多糖链,一般由半乳糖、木糖、鼠李糖、阿拉伯糖等组成侧链[3]。研究表明,果胶本身没有抑菌活性,但分解所得的低分子质量寡糖被认为具有一定的抑菌功能[4],可作为安全的天然防腐剂并显示出极大的开发应用前景[5-6]。Bouaziz等[7]研究了杏仁胶寡糖对病原菌和真菌的抑菌效果及其对牛肉的保鲜效果,结果显示杏仁胶寡糖有着较好的抑菌效果,延长了肉制品货架期。李拖平等[8]就离体条件下山楂果胶寡糖对食品腐败微生物枯草芽孢杆菌的抗菌作用进行了研究和考察,结果表明山楂果胶寡糖与其他天然食品添加剂复配要比单独使用有更强的抑菌作用。Di Rong等[9]研究了柑橘果胶寡糖对双歧杆菌和乳酸菌的益生作用,发现其提高了对产志贺毒素大肠杆菌的抗黏附活性,结果表明低聚糖有潜力运用于治疗细菌性疾病药物和功能性食品。Liu Xiaoli 等[10]研究了曲酸枝壳寡糖对革兰氏菌的抑菌效果,并测定了菌体的膜通透性,通过细菌生长规律可以看出抑菌效果显著,可作为一种新型抗菌剂作用于革兰氏菌。
本研究通过对山楂果胶进行酶解,分离制得不同聚合度寡糖,考察自制寡糖的抑菌性能及抑菌机理,为其在天然食品防腐剂开发中的应用提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、酿酒酵母菌(Saccharomyces cerevisiae)、植物乳杆菌(Lactobacillus plantarum)由河北科技大学微生物实验室提供。大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌使用牛肉膏蛋白胨培养基;植物乳杆菌用乳酸细菌培养基;酿酒酵母菌用酵母浸出粉胨葡萄糖培养基(lysogeny broth,LB),相对应液体培养基不加琼脂。
半乳糖醛酸(标准品)、葡聚糖凝胶G 5 0美国Sigma公司;复配酶制剂、多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectinesterase,PP)上海康禧食品饮业有限公司;对硝基苯磷酸二钠四水盐、Tris-HCl、邻硝基酚-β-D-半乳糖苷 上海宝曼科技有限公司;咔唑 上海生工生物工程股份有限公司。
1.2 仪器与设备
EPOCH2全波长酶标仪 美国博腾仪器有限公司;S-4800-I场发射扫描电子显微镜(scanning electron microscope,SEM) 日本Hitachi公司;7HZ-82A水浴恒温振荡器 常州荣华仪器制造有限公司;KQ5200DE数控超声清洗器 昆山市起声仪器有限公司;D-1-70型自动控制压力蒸汽灭菌锅 北京发恩科贸有限公司。
1.3 方法
1.3.1 抑菌实验
1.3.1.1 山楂果胶寡糖的制备
本实验前期制得山楂果胶,酶解果胶生成寡糖并通过葡聚糖凝胶柱进行分离收集,得到了平均聚合度2~5的果胶寡糖,于4 ℃冷藏待用。
总糖质量浓度测定用咔唑比色法,得到D-半乳糖醛酸质量浓度ρ1(mg/L)与吸光度A1的回归方程ρ1=0.008 3A1-0.033 5(R2=0.999 0),其中ρ1范围为0~140 mg/L。
还原糖质量浓度测定用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色法,得到D-半乳糖醛酸质量浓度ρ2(mg/L)与吸光度A2的回归方程ρ2=0.226 3A2-0.019 9(R2=0.999 8),其中ρ2范围为0 ~2 mg/mL。
按照式(1)计算果胶寡糖平均聚合度[11]。

式中:ρ1、ρ2分别为酶解液中总糖和还原糖的质量浓度/(mg/mL)。
1.3.1.2 不同聚合度寡糖对抗菌性的影响
参考李大峰等[12]的方法并略作修改。采用打孔法测定抑菌圈大小,将100 mL菌液(浓度确定为107CFU/mL)分别加入到凝固好固体培养基的培养皿中,均匀涂布,静置5 min。用打孔器在培养基上打出直径为6 mm的圆孔,然后于每孔中滴加少量固体培养基封底[13],往圆孔中注入10 μL果胶寡糖溶液,静置5 min,放置于培养箱中在37 ℃下恒温培养24 h,抑菌圈直径用游标卡尺测量,对照组为不经过酶解的果胶液。
1.3.1.3 测定最小抑菌浓度和最小杀菌浓度
根据刘奕等[14]的方法并略作修改。本实验采用双倍稀释法,用与培养受试菌种相应的液体培养基稀释成平均聚合度为3的2 倍质量浓度梯度的寡糖溶液,分别加入含有20 mL培养基的锥形瓶中,使得果胶寡糖溶液质量浓度最终为0.039、0.078、0.156、0.313、0.625、1.250、2.500、5.000 g/L,分别标为1~8号,再向每个锥形瓶中分别加入50 µL菌液(107CFU/mL)。将1~8号锥形瓶固定于摇床上,以200 r/min在37 ℃恒温摇床培养12 h,肉眼不可见浑浊的最小质量浓度为最小抑菌浓度(minimal inhibitory concentration,MIC)。取清澈的不同质量浓度的菌液涂板培养,无菌生长的最小质量浓度为最小杀菌浓度(minimum bactericidal concentration,MBC)[15]。
1.3.1.4 生长曲线的测定
参考Liu Guorong等[16]的方法并略作修改。金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、植物乳杆菌和酿酒酵母菌5 种供试菌种,100 µL菌液(107CFU/mL)分别加入到相对应盛放有50 mL液体培养基的150 mL锥形瓶中,每种菌接种4 个锥形瓶。将平均聚合度为3的果胶寡糖溶液分别加入到锥形瓶中,控制最终质量浓度分别为0.2、0.5、1×MIC,不加寡糖溶液为对照。盛有酿酒酵母菌液锥形瓶置于28 ℃、其余锥形瓶置于37 ℃,200 r/min摇床培养,每隔1 h在无菌条件下取样在660 nm波长处测定吸光度以反映微生物生长状态,绘制供试菌的生长曲线。
1.3.2 抑菌机理的研究
1.3.2.1 菌体形态的测定
参考冯亚净等[17]的方法并略作修改。采用SEM观察菌体形态。将金黄色葡萄球菌、大肠杆菌于液体培养基中37 ℃恒温培养12 h(107CFU/mL)。0、1×MIC的果胶寡糖溶液分别加入到5 mL菌悬液中,37 ℃、200 r/min摇床中培养4 h。用pH 7.4的磷酸盐缓冲液将培养后的菌液清洗3 次,加入适量的戊二醛溶液后于4 ℃环境下放置4 h。使用体积分数为30%、50%、70%、90%的乙醇和无水乙醇进行脱水,静置10 min,然后用叔丁醇置换出乙醇。干燥,离子溅喷金,SEM观察。
1.3.2.2 相对电导率的测定
本实验选取抑菌实验效果最为明显的3 种菌即大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌作为供试菌种。参考Diao Wenrui等[18]的方法,3 种菌分别接种于牛肉膏蛋白胨培养基中,37 ℃恒温培养12 h,4 000 r/min离心15 min,收集菌体,用质量分数5%的葡萄糖溶液洗至菌液相对电导率与其相等,作为等渗菌悬液(107CFU/mL)。将不同质量浓度的果胶寡糖溶液(0、1×MIC和1×MBC)分别加入到5%葡萄糖溶液中并混匀,测其相对电导率,记为L1。将不同质量浓度的果胶寡糖溶液(0、1×MIC和1×MBC)分别加入到等渗菌液中,放于37 ℃摇床中培养6 h,每隔1 h取出测定相对电导率,记为L2。将等渗菌悬液用电磁炉煮5 min,等待温度缓慢下降后,测相对电导率,记为L0。菌种膜通透性的相对电导率根据公式(2)[19]计算。
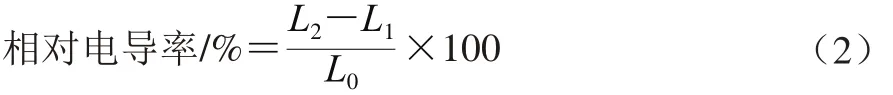
1.3.3 细胞膜完整性的测定
1.3.3.1 蛋白质核酸含量的测定
参考Lü Fei等[20]的方法并略作修改。取供试菌液30 mL,4 500 r/min离心15 min,菌体用pH 7.4磷酸盐缓冲液清洗3 次,并用磷酸盐缓冲液定容到100 mL。将不同质量浓度的果胶寡糖溶液(0、1×MIC和1×MBC)各加入到20 mL菌悬液中,37 ℃摇床培养3 h。随后,菌悬液8 000 r/min离心5 min,取上清液在260 nm波长处测定其吸光度,菌悬液中核酸的相对含量用A260nm表示。另取上清液,用考马斯亮蓝法测595 nm波长处的吸光度,表示蛋白质相对含量。
1.3.3.2 碱性磷酸酶活力的测定
参考金山[11]的方法并略作修改。取活化后的大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌各50 mL菌液4 000 r/min离心15 min,得到菌体,用pH 7.4磷酸盐缓冲液洗涤3 次后重新悬浮。将平均聚合度为3的果胶寡糖溶液加入到菌悬液中,使菌悬液终浓度为1×MIC,对照组为不加果胶寡糖组,37 ℃恒温培养,每小时定时取样,将1 mL样品用0.4 µm滤菌膜过滤,随后将0.2 mL滤液加入1.8 mL 0.1 mol/L Tris-HCl缓冲液(pH 8.0,含0.2 mg/mL对-硝基苯磷酸二钠四水盐)中混匀,混合液于23 ℃水浴30 min。用OD410nm表示溶液碱性磷酸酶活力[21]。
1.3.3.3 β-半乳糖苷酶活力的测定
前处理同1.3.3.2节,取2 mL样品8 000 r/min离心10 min,收集菌体悬浮于3 mL 0.05 mol/L Tris-HCl缓冲液(pH 7.0)中,加入0.5 mL 4 mg/mL的邻硝基酚-β-D-半乳糖苷、0.1 mL 0.2 mol/L的Na3PO4(pH 7.0),25 ℃水浴30 min。加入1.5 mL的1 mol/L的Na2CO3终止反应。以OD410nm表示β-半乳糖苷酶活力。
1.4 数据统计分析
用SPSS 17.0软件进行统计分析,组间数据比较采用单因素方差分析,以P<0.05表示差异有统计学意义,所得数据以表示。
2 结果与分析
2.1 不同平均聚合度果胶寡糖对抑菌性的影响
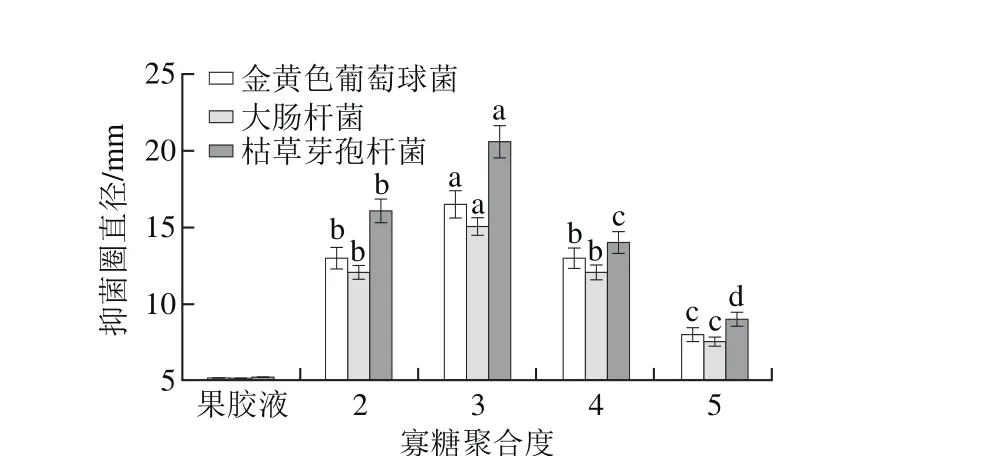
图1 不同平均聚合度果胶寡糖对抑菌性的影响Fig. 1 Effect of pectin oligosaccharides with different averagepolymerization degrees on bacteriostasis
收集葡聚糖凝胶柱不同出峰管数所对应寡糖溶液并测定其平均聚合度,得到果胶寡糖平均聚合度为2~5。质量浓度为1 g/L的各个聚合度山楂果胶寡糖对酿酒酵母菌和植物乳杆菌抑菌圈均不明显,选取抑菌圈效果明显的3 株菌(金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌),结果如图1所示。不同平均聚合度寡糖对3 种致病菌展现出不同的抑菌性能,其中平均聚合度为3的寡糖对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌的抑菌圈直径最大,分别为16.5、15.0、20.5 mm,未经酶解的果胶液没有抑菌效果。从抑菌圈和MIC、MBC结果来看大肠杆菌对果胶寡糖的耐受性要优于金黄色葡萄球菌和枯草芽孢杆菌,说明不同的菌株对果胶低聚糖的耐受力不一样。这可能是由于革兰氏阴性菌所存在的高脂多糖含量双层膜结构比革兰氏阳性菌的单层膜结构更能抵制果胶寡糖的侵入[22]。综上所述,以下抑菌实验均采用平均聚合度为3的果胶寡糖。
2.2 果胶寡糖的抑菌性能
2.2.1 MIC和MBC测定结果
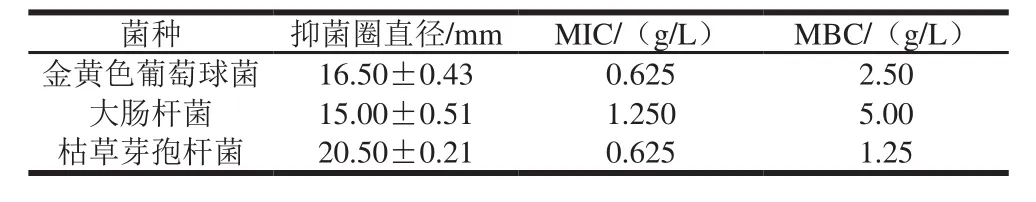
表1 平均聚合度为3的果胶寡糖对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌的抑菌圈直径、MIC和MBCTable 1 Inhibitory zone diameters, MICs and MBCs of pectin oligosaccharides with average polymerization degree of 3 against Staphylococcus aureus, Escherichia coli and Bacillus subtilis
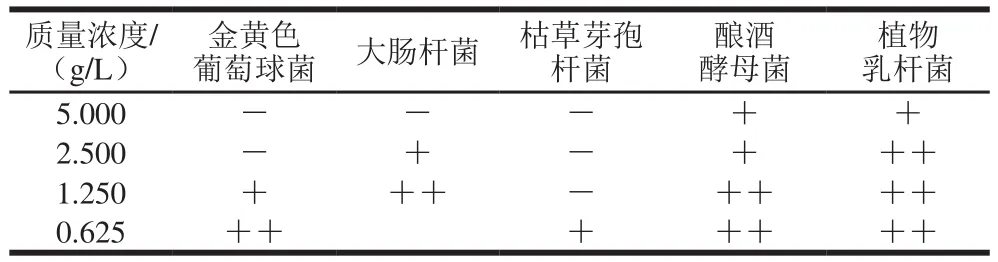
表2 培养皿中菌落生长情况Table 2 Colony growth in Petri dishes with different concentrations of pectin oligosaccharides with average polymerization degree of 3
由表1可以看出,枯草芽孢杆菌的抑菌圈直径最大,为20.50 mm,且果胶寡糖的MIC和MBC最低,分别为0.625 g/L和1.250 g/L。由此表明平均聚合度为3的果胶寡糖对枯草芽孢杆菌的抑菌效果最好,其次为金黄色葡萄球菌、大肠杆菌。但对酿酒酵母菌和植物乳杆菌的抑菌效果不明显,在受药质量浓度范围内没有MIC,由表2也可以看出,果胶寡糖对酿酒酵母和植物乳杆菌的抑制效果不明显,在受药质量浓度范围也不存在MBC。
2.2.2 果胶寡糖对5 种供试菌生长曲线的影响
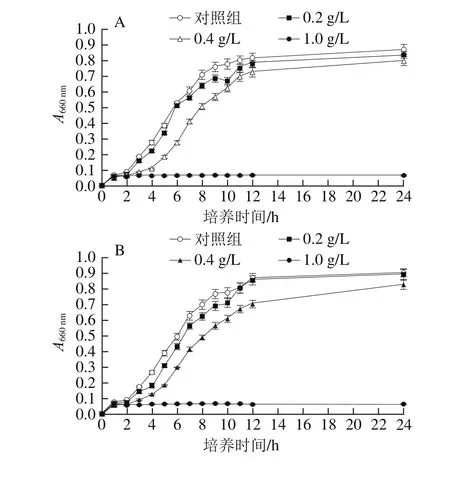
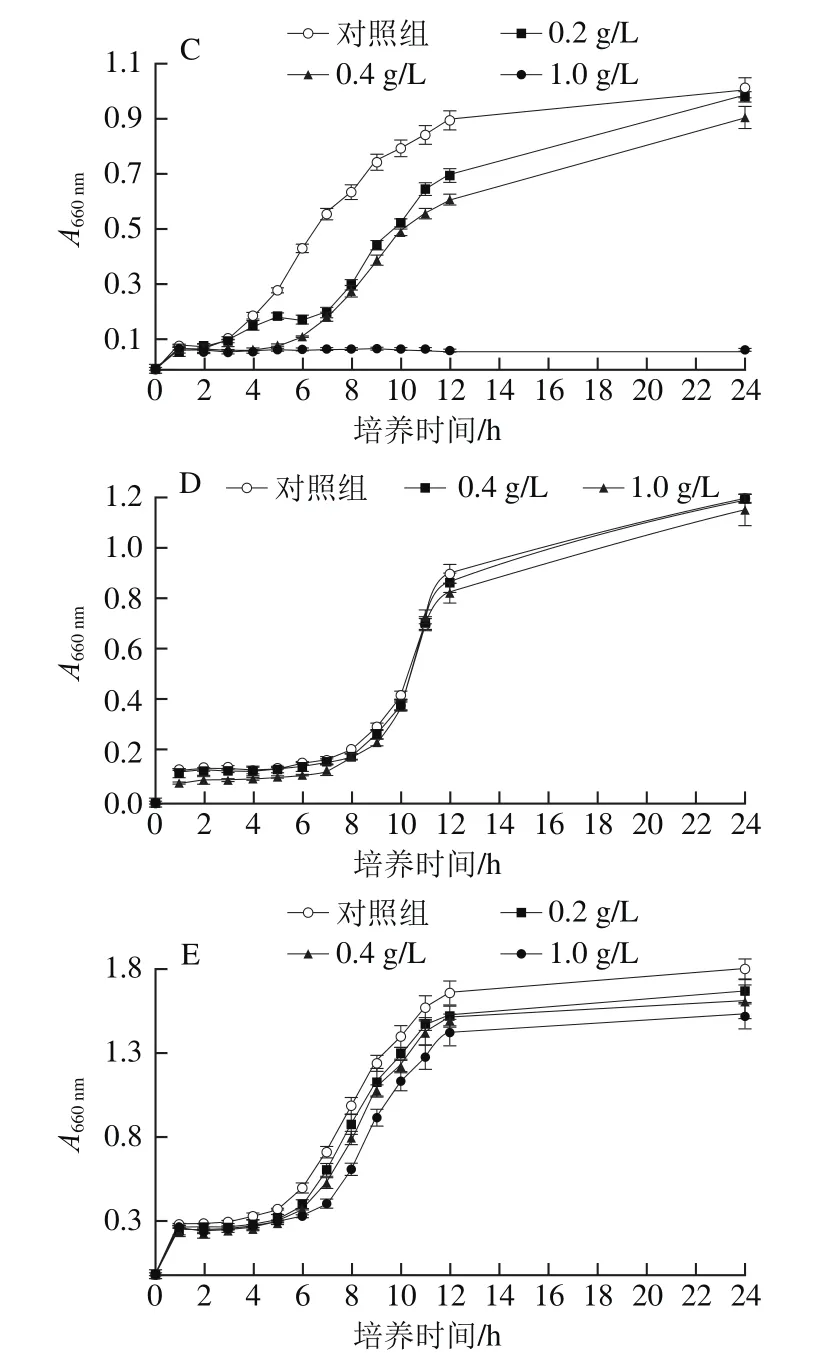
图2 果胶寡糖对5 种供试菌生长曲线的影响Fig. 2 Effect of pectin oligosaccharides on growth curves of ベve test bacteria
从图2可以看出,在对照组中5 种供试菌种均正常生长,有明显的指数期、平稳期等特征。在加入0.2 g/L和0.4 g/L果胶寡糖后,金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌生长速率明显减缓,对数期、平稳期延后;在加入1 g/L果胶寡糖后,这3 种菌悬液的A660nm随着时间的推移基本没有变化,菌体停止生长;可以看出果胶寡糖对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌的抑制效果明显。随着加入果胶寡糖质量浓度的增加,酿酒酵母菌和乳酸菌生长也受到了一定程度的抑制,但效果不明显。
2.3 抑菌机理
2.3.1 果胶寡糖对菌体形态的影响
由SEM结果可知,未添加果胶寡糖的对照组中菌体细胞完整(图3B、D),细胞壁和细胞膜较为完整光滑,菌体外观形态正常。当加入1×MIC的果胶寡糖时(图3A、C),金黄色葡萄球菌菌体大量塌陷,胞膜表面不平整,失去了圆滑的球状形态,形态遭到严重破坏。大肠杆菌菌体变形,甚至被降解,胞壁胞膜受损严重,细胞质外漏。这种变化可能是由于果胶寡糖引起了胞膜组分的溶解和转变[23],破坏了细胞膜的完整,使菌体细胞变形凹陷,从而抑制菌体的生长。

图3 金黄色葡萄球菌和大肠杆菌SEM图Fig. 3 SEM of Staphylococcus aureus and Escherichia coli
2.3.2 果胶寡糖对膜通透性的影响
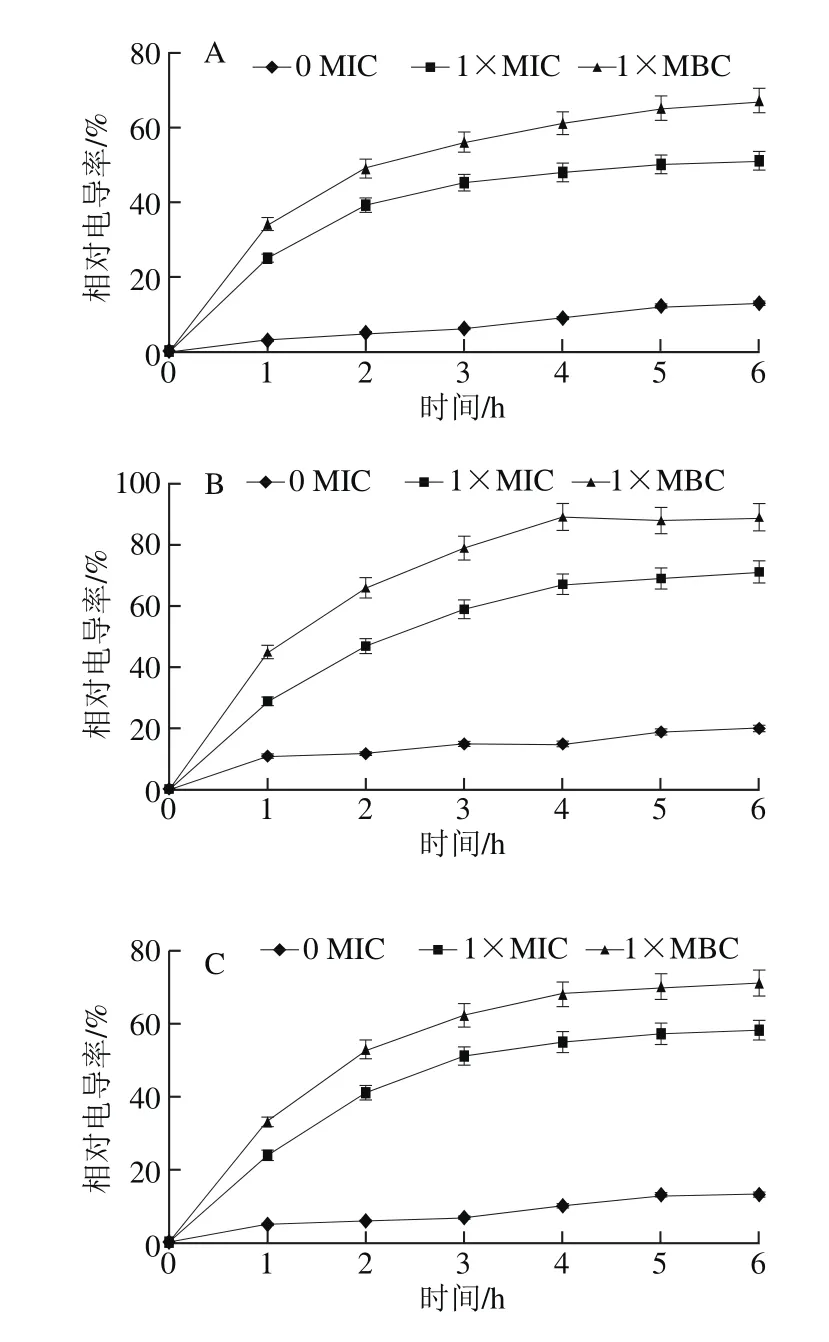
图4 果胶寡糖溶液对3 种菌相对电导率的影响Fig. 4 Effect of pectin oligosaccharide on relative conductivity of three strains
由图4可以看出,1×MIC和1×MBC组随着果胶寡糖加入,菌液中相对电导率迅速增大,之后增长趋于平缓。说明菌体胞膜被破坏,内容物溢出,影响膜通透性;并且,相对电导率数值与寡糖质量浓度成正比关系,说明实验中高质量浓度的果胶寡糖对胞膜的破坏性更强。在6 h枯草芽孢杆菌相对电导率最高,即果胶寡糖对枯草芽孢杆菌胞膜破坏性最强。菌体细胞膜相当于一道屏障,K+、Na+、H+等可以通过,这些离子能保证胞膜正常发挥作用。这种对小分子物质的渗透作用受控于膜结构[24]。果胶寡糖首先进入细菌的细胞壁,将壁破坏后开始攻击细胞膜,细胞膜受到影响后离子稳态失衡,影响菌体的代谢,最终导致菌体死亡[25]。对照组随时间延长相对电导率略有升高,可能由菌体自溶引起。
2.3.3 果胶寡糖对细胞膜完整性的影响
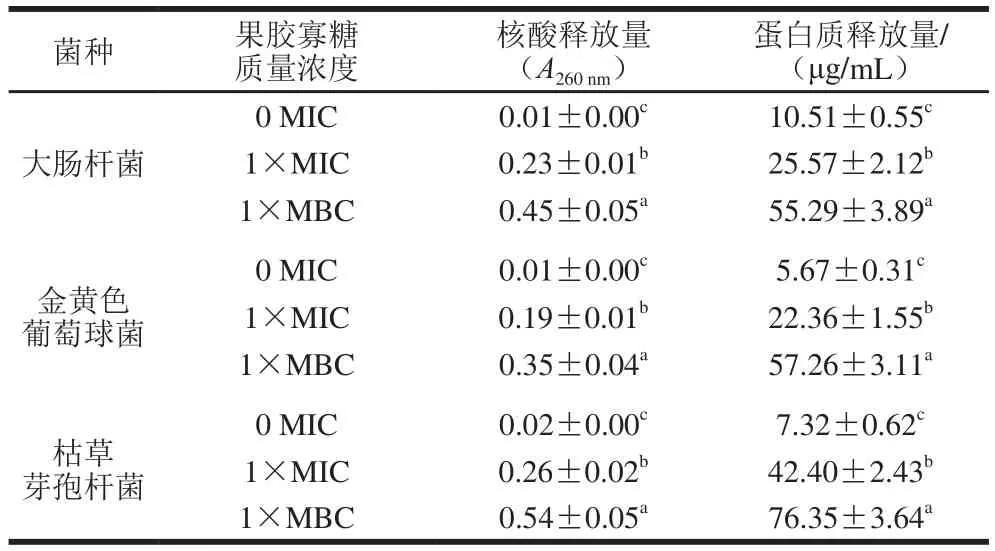
表3 不同质量浓度果胶寡糖对菌体细胞膜的影响Table 3 Effect of different concentrations of pectin oligosaccharides on the cell membrane
果胶寡糖对菌体膜完整性的影响由菌体核酸、蛋白质释放量表示,测定结果如表3所示。加入1×MIC果胶寡糖后,3 种菌核酸释放量均增大,当加入果胶寡糖质量浓度增加到1×MBC后,核酸增长幅度加大。蛋白质的释放趋势同核酸,果胶寡糖的加入使悬液中蛋白质含量成倍增长。此内溶物释放趋势与Shen Suxia等[26]的结果相同。
核酸、蛋白质等大分子物质贯穿于整个胞膜和胞质当中,是组成细胞的重要结构物质[28],核酸、蛋白质等大分子物质的外溢表明胞膜完整性遭到了破坏。可能因为果胶寡糖直接作用胞壁和胞膜结构,破坏了膜完整性,致使核酸、蛋白质大量泄漏,影响其代谢活动进行,最终导致细菌死亡。或者破坏胞壁致使细胞失去胞壁的保护,最终使细菌溶解死亡[28]。
2.3.4 细胞壁和细胞膜完整度
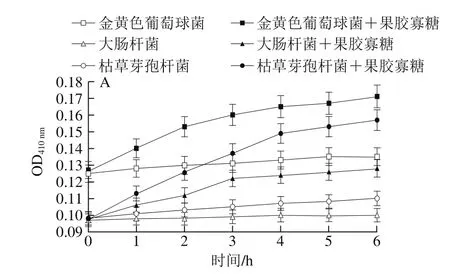
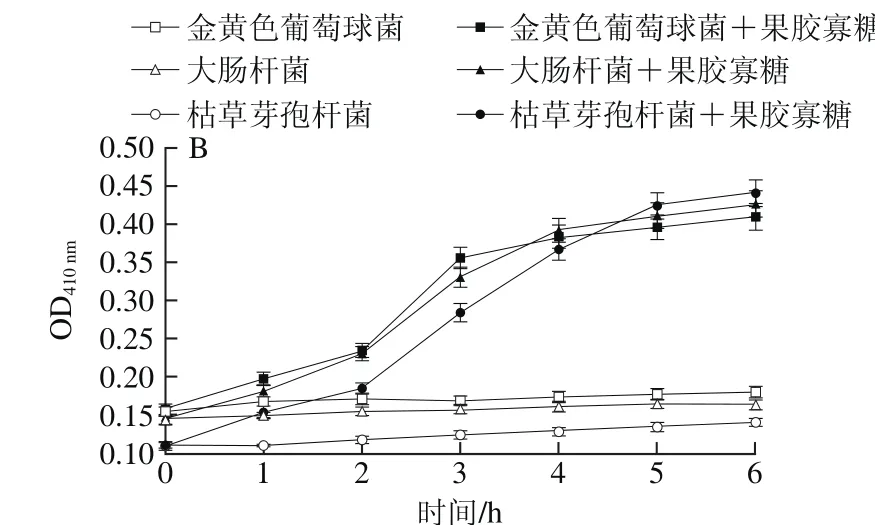
图5 果胶寡糖对菌体细胞碱性磷酸酶(A)和β-半乳糖苷酶(B)活力的影响Fig. 5 Effect of pectin oligosaccharides on intracellular alkaline phosphatase (A) and beta galactosidase (B) activity
一般而言,碱性磷酸酶存在于细胞膜与细胞壁之间,而β-半乳糖苷酶存在于细胞膜内,菌液中不会存在这两种酶[29]。因此,如果在菌液中检测到碱性磷酸酶,则证明它是从裂口中漏出来的,说明细胞壁已经被破坏。同理如果在菌液中检测到β-半乳糖苷酶即可证实细胞膜被破坏。通过检测菌液中两种酶活性的强弱可以表示细胞壁和细胞膜的透性变化和被破坏的程度[30]。
从图5A可以看出,实验组与对照组相比溶液中碱性磷酸酶活力开始增大,说明果胶寡糖对3 种菌的细胞壁产生破坏,使碱性磷酸酶从缺口中漏出。从图5B中可看出,在作用2 h后,溶液中β-半乳糖苷酶含量增加,该结果说明果胶寡糖首先破坏了菌体的细胞壁,正所谓“唇亡齿寒”,细胞壁被损坏,细胞没有了保护自己的躯壳,细胞膜结构必将由于细胞质的膨胀压而损坏,菌体胀裂死亡。枯草芽孢杆菌的对照组和实验组OD值差距大于其余两种菌,这也和前面抑菌圈实验结果相吻合。
3 结 论
现阶段,越来越多的人青睐于绿色、健康的天然食品。山楂果胶寡糖作为提取于山楂中的天然物质,具有良好的抑菌效果,迎合了绿色食品趋势。本实验研究了山楂果胶寡糖作用于5 种供试菌的抑菌性,得出结果:平均聚合度为3的山楂果胶寡糖抑菌效果最好;其中对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌有很好的抑菌效果,其MIC分别为0.625、1.250 g/L和0.625 g/L,抑菌圈直径分别为16.5、15.0 mm和20.5 mm。另外,本研究从多方面阐述了果胶寡糖的抑菌机理:SEM图显示出果胶寡糖破坏了菌体的形态,细胞表面褶皱、凹陷、菌体死亡;可能因为果胶寡糖影响了菌体胞膜的通透性,离子稳态破坏导致相对电导率失衡;胞壁受损致使细菌不能耐受菌体内的高渗透压而胀裂死亡,核酸、蛋白质大量泄漏,大量碱性磷酸酶和β-半乳糖苷酶泄漏到菌液中。本实验将为山楂果胶寡糖作为天然、经济的抑菌剂更好地应用于食品保鲜提供了理论依据。
[1] VONGKAMJAN K, WIEDMANN M. Starting from the bench:prevention and control of foodborne and zoonotic diseases[J].Preventive Veterinary Medicine, 2015, 118(2/3): 189-195.DOI:10.1016/j.foodchem.2015.06.076.
[2] BIAN X, MUHAMMAD Z, EVIVIE S E, et al. Screening of antifungal potentials of Lactobacillus helveticus KLDS 1.8701 against spoilage microorganism and their effects on physicochemical properties and shelf life of fermented soybean milk during preservation[J]. Food Control, 2016, 66: 183-189. DOI:10.1016/j.foodcont.2016.02.004.
[3] JAYANI R S, SAXENA S, GUPTA R. Microbial pectinolytic enzymes: a review[J]. Process Biochemistry, 2005, 40(9): 2931-2944.DOI:10.1016/j.procbio.2005.03.026.
[4] 李学红, 马庆一, 张昱, 等. 果胶酶解液抑菌性能的研究[J]. 食品工业科技, 2003, 24(1): 51-53. DOI:10.13386/j.issn1002-0306.2003.01.019.
[5] MUZZARELLI R A A, BOUDRANT J, MEYER D, et al. Current views on fungal chitin/chitosan, human chitinases, food preservation,glucans, pectins and inulin: a tribute to Henri Braconnot, precursor of the carbohydrate polymers science, on the chitin bicentennial[J].Carbohydrate Polymers, 2012, 87(2): 995-1012. DOI:10.1016/j.carbpol.2011.09.063.
[6] ZOU P, YANG X, WANG J, et al. Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J].Food Chemistry, 2016, 190: 1174-1181. DOI:10.1016/j.foodchem.2015.06.076.
[7] BOUAZIZ F, HELBERT C B, ROMDHANE M B, et al. Structural data and biological properties of almond gum oligosaccharide:application to beef meat preservation[J]. International Journal of Biological Macromolecules, 2015, 72: 472-479. DOI:10.1016/j.ijbiomac.2014.08.044.
[8] 李拖平, 李苏红, 宋玉蓉, 等. 山楂果胶寡糖及其复合物对枯草杆菌的抗菌作用[J]. 食品工业科技, 2012, 33(10): 154-156.DOI:10.13386/j.issn1002-0306.2012.10.060.
[9] DI Rong, VAKKALANKA M S, ONUMPAI C, et al. Pectic oligosaccharide structure-function relationships: prebiotics, inhibitors of Escherichia coli O157: H7 adhesion and reduction of Shiga toxin cytotoxicity in HT29 cells[J]. Food Chemistry, 2017, 227: 245-254.DOI:10.1016/j.foodchem. 2017.01.100.
[10] LIU Xiaoli, XIA Wenshui, JIANG Qixing, et al. Effect of kojic acidgrafted-chitosan oligosaccharides as a novel antibacterial agent on cell membrane of Gram-positive and Gram-negative bacteria[J]. Journal of Bioscience and Bioengineering, 2015, 120(3): 335-339. DOI:10.1016/j.jbiosc.2015.01.010.
[11] 金山. 山楂果胶寡糖的分离制备及其抗菌特性的研究[D]. 哈尔滨:东北农业大学, 2008: 21.
[12] 李大峰, 贾冬英, 陈潇, 等. 柚皮果胶水解物的抗菌活性研究[J]. 氨基酸和生物资源, 2010, 32(2): 63-65. DOI:10.14188/j.ajsh.2010.02.013.
[13] 张晓璐. 阿奇霉素分散片人体药代动力学研究及生物等效性评价[D].沈阳: 中国医科大学, 2006: 12.
[14] 刘奕, 费伟, 王丽娜, 等. 人工合成抗菌肽对口腔细菌抗菌性能的初步研究[J]. 华西口腔医学杂志, 2014, 32(6): 601-605. DOI:10.7518/hxkq. 2014.06.017.
[15] DE SOUSA GUEDES J P, DA COSTA MEDEIROS J A, DE SOUZA SILVA R S, et al. The efベcacy of Mentha arvensis L. and M. piperita L.essential oils in reducing pathogenic bacteria and maintaining quality characteristics in cashew, guava, mango, and pineapple juices[J].International Journal of Food Microbiology, 2016, 238: 183-192.DOI:10.1016/j.ijfoodmicro.2016.09.005.
[16] LIU Guorong, REN Guimei, ZHAO Lei, et al. Antibacterial activity and mechanism of biベdocin A against Listeria monocytogenes[J]. Food Control, 2017, 73: 854-861. DOI:10.1016/j.foodcont.2016.09.036.
[17] 冯亚净, 张媛媛, 王瑞鑫, 等. 五味子木脂素对大肠杆菌的抑菌机理及效果[J]. 食品与发酵工业, 2016, 42(2): 72-76. DOI:10.13995/j.cnki.11-1802/ts.201602013.
[18] DIAO Wenrui, HU Qingping, ZHANG Hong, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J]. Food Control, 2014, 35(1): 109-116. DOI:10.1016/j.foodcont.2013.06.056.
[19] KNAUTH P, PASQUINI L, DI VONA M L. Comparative study of the cation permeability of protonic, anionic and ampholytic membranes[J].Solid State Ionics, 2017, 300: 97-105. DOI:10.1016/j.ssi. 2016.12.015.[20] LÜ Fei, LIANG Hao, YUAN Qipeng, et al. In vitro antimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms[J]. Food Research International, 2011, 44(9): 3057-3064. DOI:10.1016/j.foodres.2011.07.030.
[21] HU Q, ZHOU B, DANG P, et al. Facile colorimetric assay of alkaline phosphatase activity using Fe (Ⅱ)-phenanthroline reporter[J].Analytica Chimica Acta, 2017, 950: 170-177. DOI:10.1016/j.aca.2016.11.012.
[22] MALANOVIC N, LOHNER K. Gram-positive bacterial cell envelopes: the impact on the activity of antimicrobial peptides[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2016, 1858(5):936-946. DOI:10.1016/j.bbamem.2015.11.004.
[23] 张赟彬, 刘笑宇, 姜萍萍, 等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技, 2015, 31(5): 31-35;11. DOI:10.13982/j.mfst.1673-9078.2015.5.006.
[24] COX S D, MANN C M, MARKHAM J L, et al. Determining the antimicrobial actions of tea tree oil[J]. Molecules, 2001, 6(2): 87-91.DOI:10.3390/60100087.
[25] BAJPAI V K, SHARMA A, BAEK K H. Antibacterial mode of action of Cudrania tricuspidata fruit essential oil, affecting membrane permeability and surface characteristics of food-borne pathogens[J]. Food Control, 2013, 32(2): 582-590. DOI:10.1016/j.foodcont.2013.01.032.
[26] SHEN Suxia, ZHANG Tiehua, YUAN Yuan, et al. Effects of cinnamaldehyde on Escherichia coli and Staphylococcus aureus membrane[J]. Food Control, 2015, 47: 196-202. DOI:10.1016/j.foodcont.2014.07.003.
[27] SHARMA A, BAJPAI V K, BAEK K H. Determination of antibacterial mode of action of Allium sativum essential oil against foodborne pathogens using membrane permeability and surface characteristic parameters[J]. Journal of Food Safety, 2013, 33(2): 197-208. DOI:10.1111/jfs.12040.
[28] LONG M, WANG J, ZHUANG H, et al. Performance and mechanism of standard nano-TiO2(P-25) in photocatalytic disinfection of foodborne microorganisms: Salmonella typhimurium and Listeria monocytogenes[J]. Food Control, 2014, 39: 68-74. DOI:10.1016/j.foodcont. 2013.10.033.
[29] PRAMANIK K, GHOSH P K, RAY S, et al. An in silico structural,functional and phylogenetic analysis with three dimensional protein modeling of alkaline phosphatase enzyme of Pseudomonas aeruginosa[J]. Journal of Genetic Engineering and Biotechnology,2017, 15(2): 527-537. DOI:10.1016/j.jgeb.2017.05.003.
[30] ZHENG H, WU W T, LIAO J M, et al. Studies on isolation and purification of (+)-abscisic acid from Botrytis cinerea[J]. Chinese Journal of Antibiotics, 2002, 27(10): 589-591. DOI:10.13461/j.cnki.cja.002637.
