基于反转录-环介导等温扩增技术检测金黄色葡萄球菌
2018-02-28梁玉林刘秀周振森周鹏飞尹建军
梁玉林,刘秀,周振森,周鹏飞,尹建军
(中国食品发酵工业研究院,北京, 100015)
金黄色葡萄球菌(Staphylococcusaureus)是革兰氏阳性菌,是常见的食源性致病菌之一。金黄色葡萄球菌在自然界中无处不在,食品受污染的机会很多,常见受其污染的食品有肉、奶、鱼、蛋类及其制品等。进食污染食品会引起食物中毒及肺炎、心包炎、败血症等疾病[3-5]。据美国疾病控制中心报告,在全球范围内由金黄色葡萄球菌引起的感染占第二位,仅次于大肠杆菌。因此,开发一种快速、灵敏、准确的方法来检测金黄色葡萄球菌对食品风险监控工作至关重要。
目前对金黄色葡萄球菌的检测主要是产致病性毒素金葡菌和耐甲氧西林金葡菌的检测,通常采用细菌的分离培养、染色观察、血浆凝固酶试验、氧化酶试验和耐药性检测等,这些方法操作繁琐,检测时间长,灵敏性不高,不能满足当前快速检测需求[6]。近年来以抗原抗体反应为基础的免疫学方法和以核酸为基础的分子生物学技术以其准确性、快速性逐渐成为致病菌检测方法的发展方向[7-8]。酶联免疫(ELISA)法是免疫学中最常用的方法,SCHOTTE等[9]报道过一种改良ELISA方法,能够在15 min内检测500 pg/mL的金黄色葡萄球菌肠毒素。但该方法所用试剂选择性高,价格昂贵,易受环境、时间、温度等条件影响。以聚合酶链反应(PCR)为代表的变温核酸扩增方法最早在国外被应用于致病菌检测,WILSON等[10]采用该方法8 h内可检出人工污染脱脂乳中金黄色葡萄球菌肠毒素B和C1,对靶DNA检测限达到1 fg。该方法虽然敏感、准确、快速,但需要昂贵的的仪器设备,对检测人员有较高的技术要求,限制了这些方法普及和推广[11-12]。环介导等温扩增(LAMP)技术是日本学者NOTOMI等[13]在2000年发明的一种全新的核酸体外扩增新技术。LAMP技术具有灵敏度高、特异性强、速度快和设备简单等优点[14-16]。该技术在灵敏度、特异性和检测范围等指标上能媲美甚至优于PCR技术,不依赖任何专门的仪器设备实现现场高通量快速检测,检测成本远低于PCR。因DNA在死菌中不易降解,传统的以DNA为检测模板进行LAMP反应,可能会检出死菌DNA而造成假阳性的后果[17-18]。而RNA在死菌中易降解,以RNA为检测模板进行反转录-环介导等温扩增(reverse transcriptase loop-mediated isothermal amplification, RT-LAMP)能够避免假阳性的发生。通过选取金黄色葡萄球菌特异性保守nuc基因并设计引物[19-21],构建了检测该靶基因的实时荧光RT-LAMP技术体系。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌等26株细菌均为本实验室保存;溶菌酶,天根生物科技公司;RNeasy Minikit,QIAGEN公司;Isothermal Master Mix(IMM),英国OptiGene Limited公司;焦炭酸二乙酯(DEPC),中科瑞泰(北京)生物科技有限公司;平板计数琼脂(PCA),琼脂糖凝胶,北京路桥技术股份有限公司;PrimeScriptTMRT-PCR Kit,宝生物工程(大连)有限公司;Trans DNA MarkerⅡ,全式金生物技术有限公司。
1.2 仪器与设备
微量移液器,德国Eppendorf公司;高压灭菌锅(SX-700),日本TOMY公司;精密天平(CPA323S),德国Sartorius公司;超纯水仪(Mili-Q Advantage A10),德国默克公司;离心机( 5804R型,5424型),德国Eppendorf公司;超微量核酸蛋白分析仪(Biodrop),英国柏点公司;GenieⅢ,英国OptiGene Limited公司;电泳仪(JY-300C),北京君意仪器公司;凝胶成像仪,法国VILBER公司。
1.3 方法
1.3.1 引物设计
根据GenBank中的nuc基因(GenBank Accession BA000018.3)的序列,利用LAMP Primer Explorer 4在线软件(http://primer explorer.jp/elamp4.0.0/index.htm l)设计5组引物,每组引物分别包括外引物F3、B3,内引物FIP、BIP和环引物LoopF,设计完成后委托北京六合华大基因科技有限公司合成。对设计的引物进行初步筛选,避免引物间出现非特异性扩增。
1.3.2 纯培养细菌RNA提取
在平板上取金黄色葡萄球菌单菌落接入LB液体培养基中,培养12 h到对数期。取1 mL菌液5 000g离心10 min,轻轻倒掉液体。向沉淀加入10 μL蛋白酶K,100 μL TE(含终质量浓度15 mg/mL溶菌酶),充分混匀沉淀,在室温下反应30 min,后续步骤严格按照RNeasy Mini kit操作步骤提取。
1.3.3 RT-LAMP和RT-PCR反应
经优化后在12.5 μL体系中,包括7.5 μL IMM、3.5 μL混合引物(外引物、内引物和环引物含量分别为2.5 pmol、10 pmol和5 pmol)、1.5 μL模板。RT-LAMP反应温度65 ℃,反应时间30~60 min。
RT-PCR扩增引物nuc-F:5′-GCCCAATTCGTTATGACAGAATACT-3′,nuc-R:5′-CAAGTCGACCAGCTTGTCTTCGC-3′,扩增产物为694 bp。按照PrimeScriptTMRT-PCR Kit 操作步骤进行反转录和PCR扩增反应。
1.3.4 死菌中RNA降解实验
为验证死菌中RNA降解情况,我们选取107、106、105、104、103、102、101CFU/mL七个菌液浓度。121 ℃下20 min高压蒸汽灭菌,放置一段时间,模拟死菌状态。分别对灭菌前后各浓度梯度的金黄色葡萄球菌菌液进行RNA提取,并进行RT-LAMP反应。
1.3.5 RT-LAMP反应的特异性和灵敏度
提取本实验室的金黄色葡萄球菌等26株细菌RNA,进行RT-LAMP实验验证建立的RT-LAMP方法的特异性。将提取的原菌液总RNA测定浓度后,对总RNA进行稀释,最后选取2 fg、20 fg、200 fg、2 pg、20 pg、200 pg、2 ng/μL共7个浓度梯度,从各浓度梯度各取1.5 μL作为反应模板进行RT-LAMP实验检测纯培养金黄色葡萄球菌灵敏度。
1.3.6 RT-LAMP和RT-PCR反应在人工污染脱脂乳样品中的灵敏度检测
为保证检测结果的准确性,经国标GB/T4789.10—2016方法证实试验所用脱脂乳中不含金黄色葡萄球菌。取25 g脱脂乳置于225 mL灭菌生理盐水中,制备脱脂乳匀浆。取新鲜培养的12 h细菌,用生理盐水充分洗涤培养基,10倍梯度系列稀释,取各稀释度菌液1 mL加入脱脂乳匀浆中,制备人工污染脱脂乳匀浆,使人工污染脱脂乳匀浆中金黄色葡萄球菌含量达到10-1~105CFU/mL,充分混合,作为人工污染脱脂乳样品。
取各菌液浓度的人工污染脱脂乳样品1 mL,提取人工污染脱脂乳样品中的RNA,同时取不加金黄色葡萄球菌的脱脂乳样品1 mL作为阴性对照平行进行RNA提取。以提取的RNA为反应模板分别进行RT-LAMP和RT-PCR实验,并对两种方法的检测灵敏度进行比较。
2 结果与分析
2.1 引物筛选
根据RT-LAMP引物设计原则,共设计了5组金黄色葡萄球菌引物。为验证所设计引物的稳定性,在未存放过核酸样品的实验室中,对5组金黄色葡萄球菌引物进行RT-LAMP阴性扩增实验。由图1可以看出,1号、2号和3号引物均发生扩增反应,可以断定该扩增反应是非特异性的,可能是引物二聚体引起的扩增反应。在加入金黄色葡萄球菌核酸样品情况下,对5组引物进行RT-LAMP阳性扩增实验。图2表明,4号引物RT-LAMP反应出现荧光曲线时间最短且荧光值最高。对比图1和图2可知,设计的4号引物无论是在引物稳定性还是在扩增时间、荧光值方面均最佳,因此选取4号引物进行下一步实验,4号引物序列如表1所示。

图1 金黄色葡萄球菌引物筛选(不含检测模板)Fig.1 Staphylococcus aureus primer selection (without detection template)
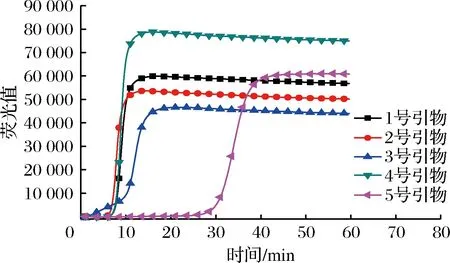
图2 金黄色葡萄球菌引物筛选(含检测模板)Fig.2 Staphylococcus aureus primer selection (with detection template)
表1 金黄色葡萄球菌靶基因引物序列
Table 1 Staphylococcus aureus target gene primer sequence
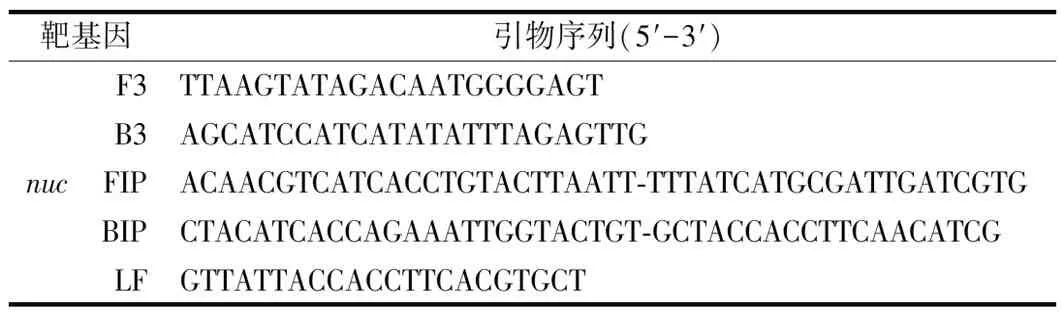
靶基因引物序列(5'-3')nucF3TTAAGTATAGACAATGGGGAGTB3AGCATCCATCATATATTTAGAGTTGFIPACAACGTCATCACCTGTACTTAATT-TTTATCATGCGATT-GATCGTGBIPCTACATCACCAGAAATTGGTACTGT-GCTACCACCTTCAACATCGLFGTTATTACCACCTTCACGTGCT
2.2 引物退火曲线分析
RT-LAMP扩增反应是否发生一般通过凝胶电泳是否出现梯状条带判断,而该方法并不能完全得出扩增是由于体系中的金黄色葡萄球菌特异性靶基因片段存在的结论。为辅助分辨RT-LAMP扩增产物来源,进一步避免假阳性的发生。根据扩增产物的GC含量不同,退火温度不同的原理,对引物退火曲线进行分析。如图3所示,筛选的4号引物在退火温度为82.5 ℃左右时,对应的退火曲线出现峰值。
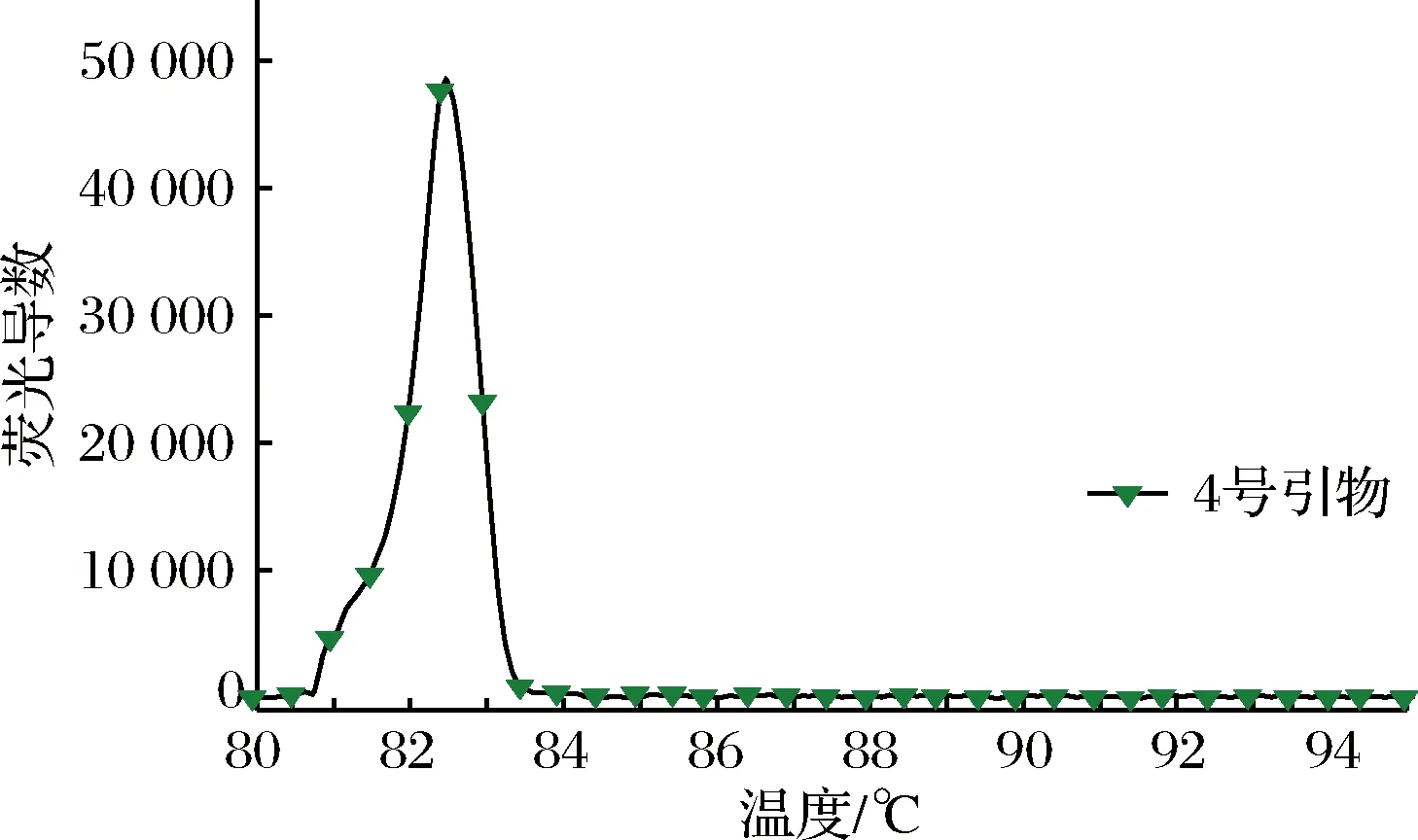
图3 4号引物的退火曲线分析Fig.3 Annealing curve analysis of No.4 primer
2.3 死菌中RNA降解实验
DNA比较稳定,在死菌中能长时间存在,以DNA为检测模板的LAMP扩增反应可能会检出死菌DNA而造成假阳性的后果。而RNA不稳定、易降解,不能在死菌中长时间存在。应用RNeasy Minikit试剂盒对同一浓度的金黄色葡萄球菌分别进行灭菌前后菌液核酸提取,并进行RT-LAMP实验,验证死菌中RNA的降解情况。结果表明,以灭菌前金黄色葡萄球菌菌液提取的核酸为检测模板进行RT-LAMP实验,其检测限能达到101CFU/mL(如图4)。
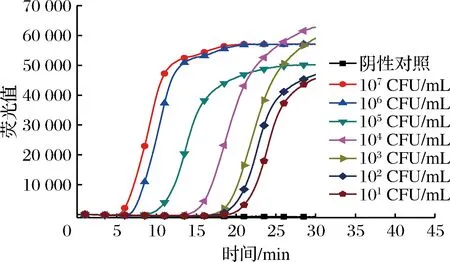
图4 活菌RNA检测Fig.4 RNA detection of viable bacteria
RNeasy Mini kit试剂盒对金黄色葡萄球菌的DNA和RNA均能有效提取,通过DNA消化去除DNA杂质得到纯的RNA。RT-LAMP反应灵敏,反应体系的IMM中含有反转录酶,可以使反转录过程和扩增反应过程同步进行,在该体系中以金黄色葡萄球菌的DNA和RNA为检测模板均能够产生扩增反应。以灭菌后菌液提取的核酸为检测模板进行RT-LAMP实验,可能由于高浓度的菌液中DNA消化不完全导致检测模板中含有DNA而检出107CFU/mL的菌液浓度(如图5)。因在实际样品中最大也不会产生超过104CFU/mL的污染量,所以以RNA为检测模板的RT-LAMP反应能很好的鉴别金黄色葡萄球菌是否处于活菌状态。

图5 死菌RNA检测Fig.5 RNA detection of dead bacteria
2.4 RT-LAMP反应特异性和灵敏度
对金黄色葡萄球菌等26株细菌进行RT-LAMP特异性检测,只有金黄色葡萄球菌产生荧光扩增反应,其余非金黄色葡萄球菌均未产生荧光扩增反应(如表2),说明建立的RT-LAMP方法具有较强的菌株特异性。
提取纯培养金黄色葡萄球菌总RNA作为反应模板,对模板进行10倍系列稀释,检测纯培养金黄色葡萄球菌RT-LAMP的反应灵敏度。实验结果表明,当核酸浓度20 fg/μL该方法仍能特异性检出(见图6),所建立的实时荧光RT-LAMP方法比文献报道的其他病原菌RT-LAMP反应灵敏度至少要高一个数量级[22]。
2.5 RT-LAMP和RT-PCR反应在人工污染脱脂乳样品中的灵敏度检测
将提取的人工污染脱脂乳RNA溶解到50 μL不含RNase的无菌水中,取其中1.5 μL为检测模板,分别进行RT-LAMP和RT-PCR实验(见图7和图8)。同时取1 mL各菌液浓度的人工污染脱脂乳样品进行平板菌落计数,记录人工污染脱脂乳样品中金黄色葡萄球菌的准确含量。结合平板计数,人工污染脱脂乳样品RT-LAMP灵敏度达到23 CFU/mL,换算成脱脂乳含菌量为230 CFU/g,并且30 min内能完成检测。与此同时,人工污染脱脂乳样品RT-PCR灵敏度只能达到2.3×103CFU/mL,换算成脱脂乳含菌量为2.3×104CFU/g,比RT-LAMP检测灵敏度低100倍。为进一步判断扩增反应是否由于体系中的金黄色葡萄球菌靶基因片段存在而引起,对人工污染脱脂乳样品RT-LAMP退火曲线进行分析。如图9各菌液浓度的人工污染脱脂乳样品RT-LAMP退火曲线特征峰的峰值均出现在82.5 ℃左右,跟RT-LAMP阳性扩增相一致。结果判定各菌液浓度的人工污染脱脂乳样品RT-LAMP的扩增反应均是由于体系中金黄色葡萄球菌靶基因片段存在而引起的。所建立的方法从核酸提取到RT-LAMP反应结束大概只需要1 h左右,大大减少了实验时间,有望应用于现场快速检测。

表2 RT-LAMP反应特异性
注:“+”表示有荧光扩增曲线,“-”表示无荧光扩增曲线。
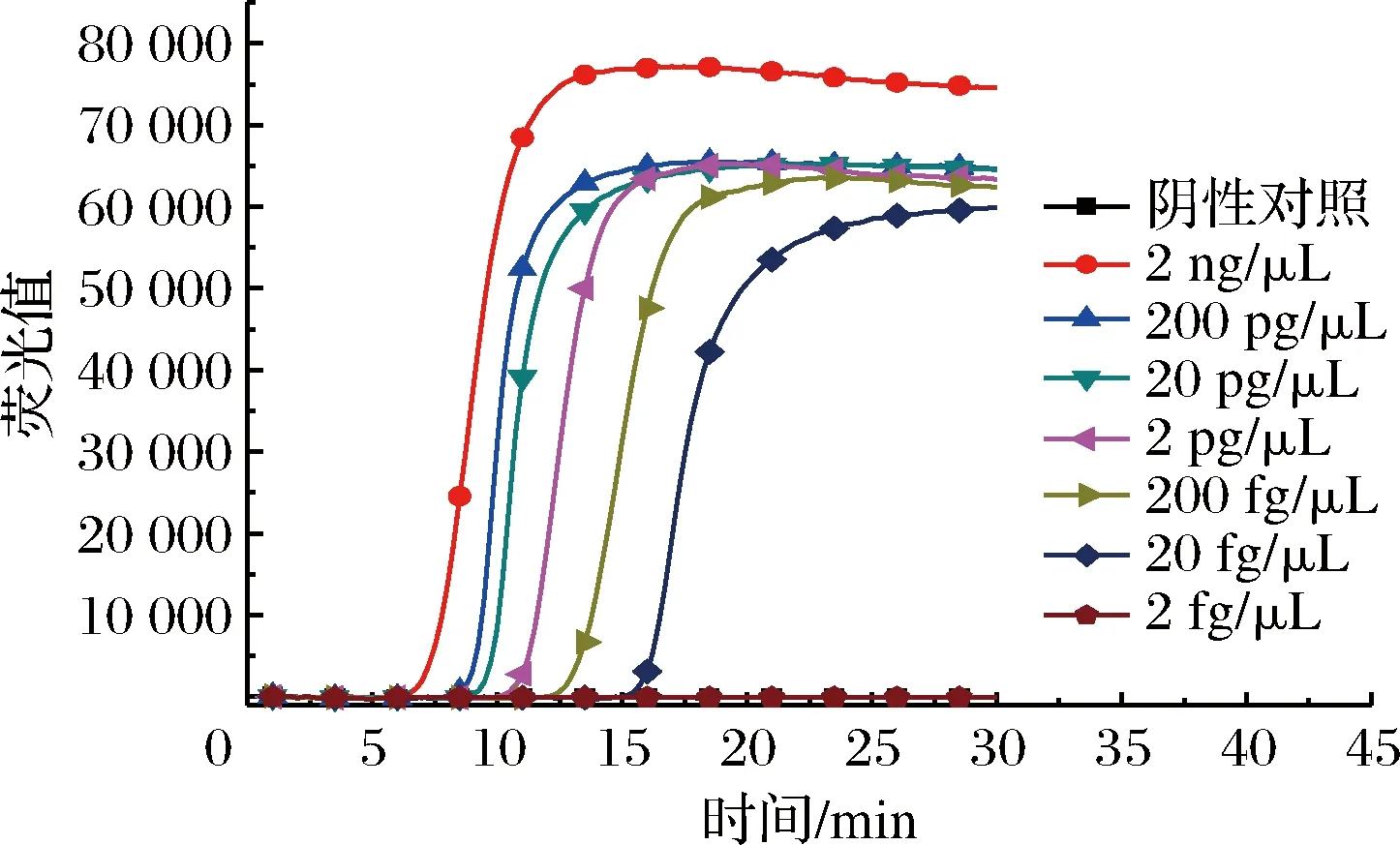
图6 RT-LAMP反应灵敏度Fig.6 RT-LAMP reaction sensitivity

M-DNA分子质量Marker; NC-阴性对照;1-2.3×105 CFU/mL; 2-2.3×104 CFU/mL;3-2.3×103 CFU/mL;4-2.3×102 CFU/mL;5-23 CFU/mL;6-2 CFU/mL;7-0 CFU/mL图7 人工污染脱脂乳RT-LAMP反应灵敏度Fig.7 Artificial contamination skim milk RT-LAMP reaction sensitivity
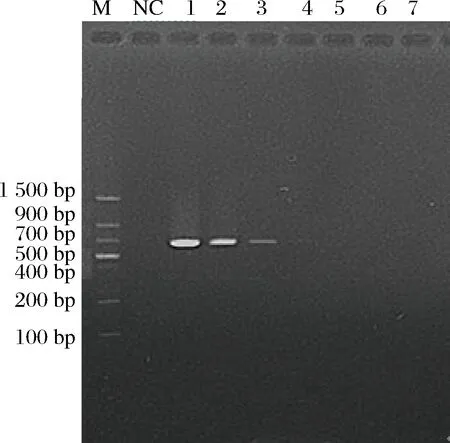
图8 人工污染脱脂乳RT-PCR产物电泳Fig.8 Artificial contamination skim milk RT-PCR product electrophoresis
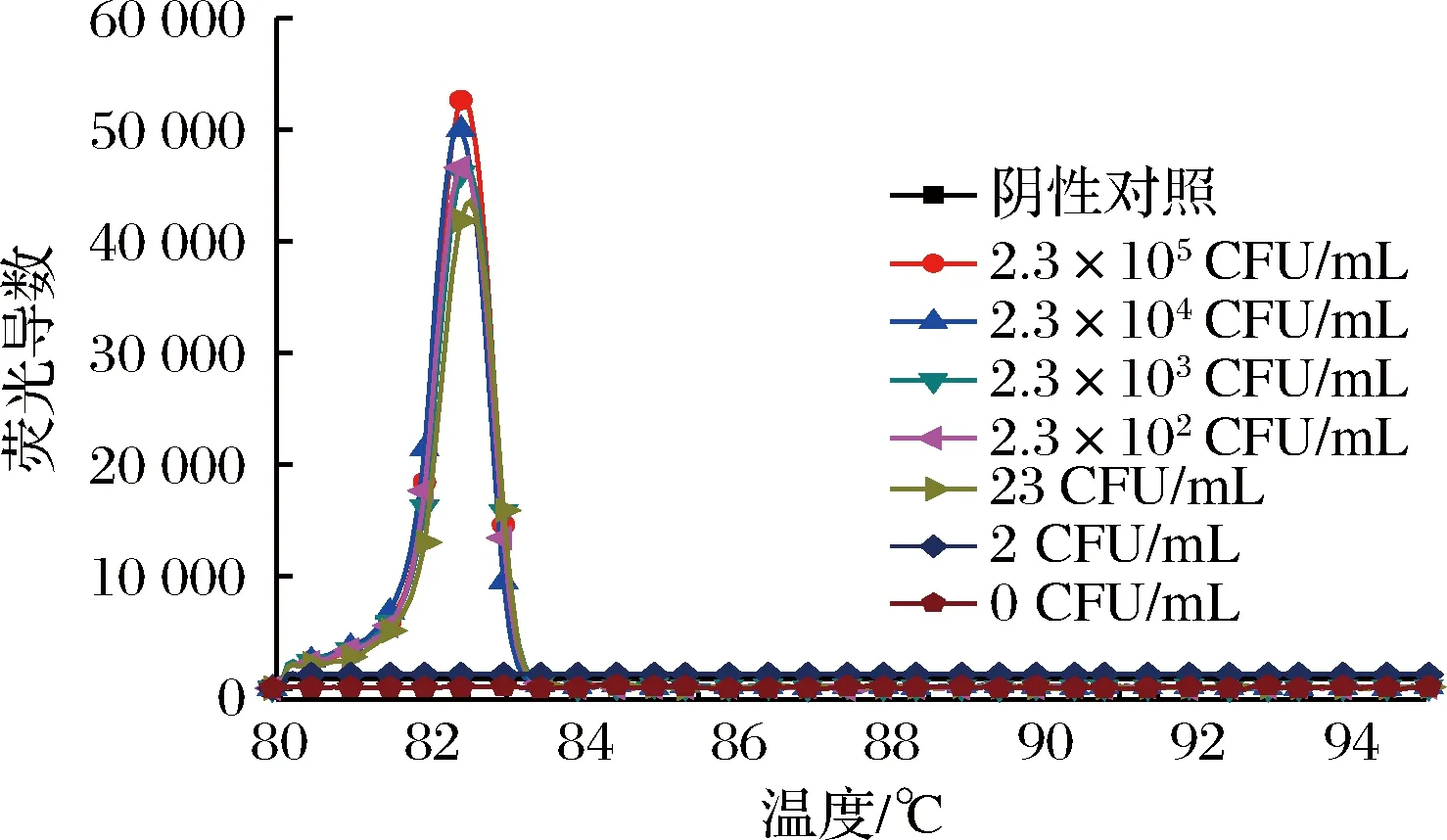
图9 人工污染脱脂乳RT-LAMP反应退火曲线Fig.9 Artificial contamination of skim milk RT-LAMP reaction Annealing curve
3 讨论
在食品检测中,由于死菌中DNA的长期存在使得基因水平的检测方法高估了样品中的活菌的水平,造成假阳性问题。在活菌检测方面,前人做了大量工作。CHEN等[23]利用荧光染料叠氮溴化丙锭(PMA)与LAMP技术相结合来区分死菌和活菌。PMA是对DNA有高度亲和力的荧光染料,不能透过完整的细胞膜,只能选择性的透过不完整的死细胞,PMA与死菌DNA结合后使之不能发生扩增反应[24-25]。PMA-LAMP实验需要对PMA浓度和光照时间进行优化,实验步骤繁琐。并且由于PMA对革兰氏阴性菌和阳性菌作用效果不一样,而导致PMA对混合菌液作用效果不佳。相比而言RT-LAMP在活菌检测中具有独特优势,以致病菌RNA为检测模板更能反映样本中的活菌状态。RT-LAMP技术在病毒检测中应用广泛,在食源性致病菌检测领域应用较少。本研究将RNA检测和实时荧光LAMP技术相结合,不但能够鉴定细菌的死活,而且进一步提高了反应的灵敏度。
金黄色葡萄球菌可以产生一种与凝固酶相关的细胞外耐热核酸酶,近来文献报道多以编码耐热核酸酶的nuc基因为靶基因设计LAMP引物[26-29]。张璐等[30]在检测的221株金黄色葡萄球菌中,发现99.09%含有nuc基因。本实验选取特异性保守nuc基因设计了5组引物,通过对不同组引物进行筛选,构建了基于RNA为检测模板的实时荧光RT-LAMP技术体系。
综上所述,本研究建立了简单、便捷、特异性强、灵敏度高适用于脱脂乳的金黄色葡萄球菌RT-LAMP检测方法。因受金黄色葡萄球菌污染的食品种类很多,不同食物基质对金黄色葡萄球菌核酸提取干扰情况不同,而实验只对人工污染脱脂乳样品进行了检测,因此后期需要扩大人工污染食品种类并对实际样品进行检测,逐步完善或推广该技术的应用。
[1] 关文英, 史红, 韩艳青,等. 2013年河北省食品中金黄色葡萄球菌污染状况调查[J]. 中国食品卫生杂志, 2015,27(S1):18-21.
[2] CHEN J, PARK B. Recent advancements in nanobioassays and nanobiosensors for foodborne pathogenic bacteria detection[J]. Journal of Food Protection, 2016,79(6):1 055-1 069.
[3] JORGENSEN H J, MORK T, HOGASEN H R, et al. EnterotoxigenicStaphylococcusin bluk milk in Norway[J]. Journal of Applied Microbiology, 2005, 99(1): 158-166.
[4] KENNEDY J, BOLTON D J, COWAN C. Food safety and bacterial pathogens: why you should eat in restaurants[C]. Proceedings of an international conference hosted by the 32nd Annual Food science and Technology Research Conference. Ireland Cork: National University of Ireland Cork, 2002: 5.
[5] 宋涛平,邱华丽,王淑娟,等. 金黄色葡萄球菌LAMP可视化快速检测方法的建立[J]. 食品与机械,2015,31(5):55-58.
[6] 张超楠. 食品中金黄色葡萄球菌的快速检测方法研究[D].长春: 吉林大学,2012.
[7] YAN Cheng-hui, ZHANG Yun, YANG Hang, et al.Combining phagomagnetic separation with immunoassay for specific, fast and sensitive detection ofStaphylococcusaureus[J]. Talanta, 2017, 170:291-297.
[8] ZHANG Hong-wei, MA Lu-yao, MA Lina, et al. Rapid detection of methicillin-resistantStaphylococcusaureusin pork using a nucleic acid-based lateral flow immunoassay[J]. International Journal of Food Microbiology, 2017, 243:64-69.
[9] SCHOTTE U, LANGFEIDT N, PERUSKI AH. Detection ofStaphylococcalenterotoxinB(SEB)by enay me linked immunosorbent assay and by a rapid hand held assay[J]. Clin Lab, 2002, 48(7-8):395-400.
[10] WILSON L G, JAMES E, GILMOUR C. Detection of enterotoxingenicStaphylococcusaureusin dried skimmed milk: use of the polymerse chain reaction for amplification and detection of staphylococcal enterotoxin genesentBandentC1 and the thermonuclearse genenuc[J]. Applied and Environmental Microbiology, 1991, 57(6):1 793-1 798.
[11] 顾琳,黄平,宋衍燕,等. PCR检测食品中金黄色葡萄球菌肠毒素基因[J]. 中国食物与营养,2015,21(2):17-19.
[12] 黄其建, 张进, 李静,等. 实时荧光PCR直接检测样本中耐甲氧西林金黄色葡萄球菌应用研究[J]. 标记免疫分析与临床, 2016, 23(2):194-196,222.
[13] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA [J]. Nucleic Acids Res, 2000, 28(12): E63.
[14] TOMITA N, MORI Y, KANDA H, et al. Loop-mediated isothermal amplification(LAMP) of gene sequences and simple visual detection of products[J]. Nat Protoc, 2008, 3(5): 877-882.
[15] SONG Chun-mei, LIU Cheng, WU Shu-yan, et al. Development of a lateral flow colloidal gold immunoassay strip for the simultaneous detection ofShigellaboydiiandEscherichiacoliO157:H7 in bread, milk and jelly samples [J]. Food Control, 2016, 59: 345-351.
[16] MORI Y, KITAO M, TOMITA N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. J BiochemBiophys Methods, 2004, 59(2): 145-157.
[17] 樊粉霞, 阚飙, 闫梅英. 利用RT-LAMP技术鉴别伤寒沙门菌[J]. 中国生物化学与分子生物学报, 2013, 29(7): 682-689.
[18] YU Ying, MA Xiao-yan, ZHANG Wei.Detection ofStaphylococcusaureusin milk using real-time fluorescence loop-mediated isothermal amplification[J]. Advance Journal of Food Science and Technology, 2015, 8(9):678-684.
[19] 胡瑜. 金黄色葡萄球菌耐热核酸酶的功能鉴定及表达调控[D].上海: 上海交通大学,2013.
[20] 谭国浩, 谭翰清, 程洁萍,等. 荧光PCR方法检测金黄色葡萄球菌nuc基因及其在消毒监测中的初步应用[J/OL]. 中国消毒学杂志, 2014, 31(5):467-469,472.
[21] 邓阳, 刘晓晨, 李冰,等. 食源性微生物MRSA及其检测方法在食品安全中的研究进展[J]. 现代食品科技, 2015, 31(1):259-266.
[22] FAN Fen-xia, WANG Shu-jing, LOU Jing. Establishment of RT-LAMP assay to detectSalmonellatyphiin blood[J]. Disease Surveillance, 2012, 27(4): 325-329.
[23] YANG Hong, WANG Yu, MA Xiao-yan, et al. Development and evaluation of a loop-mediated isothermal amplification assay for the rapid detection ofStaphylococcusaureusin food [J]. Eur Food Res Technol, 2011, 232(5): 769-776.
[24] ZHANG Tie, WANG Chun-guang, WEI Xiao-yuan, et al. Loop-mediated isothermal amplification for detection ofStaphylococcusaureusin dairy cow suffering from mastitis [J]. Journal of Biomedicine and Biotechnology, 2012,11:1-5.
[25] 胡惠秩, 满朝新, 董鑫悦.等. PMA-LAMP方法检测灭菌乳中金黄色葡萄球菌的研究[J]. 食品工业科技, 2012, 33(21):300-304,308.
[26] 赵玥明, 满朝新, 曲艳艳,等. 环介导等温扩增技术快速检测肉中金黄色葡萄球菌[J]. 中国食物与营养, 2016, 22(1): 57-61.
[27] CHEN Si-yi, WANG Fei, BEAULIEU J C, et al. Rapid detection of viableSalmonellaein produce by coupling propidiummonoazide with loop-mediated isothermal amplification [J]. Applied and Environmental Microbiology, 2011, 77(12):4 008-4 016.
[28] CAO Xiao, ZHAO Li-chao, YANG Cui-qi, et al. Establishment of PMA-LAMP method for rapid detection ofStaphylococcusaureuswith sublethalinjury[J]. Food Science, 2016, 37(24):149-155.
[29] HU Hui-zhi, MAN Chao-xin, DONG Xin-yue, et al. Detecting of viableStaphylococcusaureusby loop-mediated isothermal amplification coupling with propidium monoazide in dairy products[J]. Science and Technology of Food Industry, 2012, 33(21): 300-302.
[30] 张璐. 金黄色葡萄球菌毒力基因的分布和致病性的研究[D].保定: 河北农业大学,2012.
