四川自然发酵香肠中组胺降解菌的筛选鉴定及初步应用
2018-02-28张楠杨勇李彬彬徐晔李仁杰张姗
张楠,杨勇,李彬彬,徐晔,李仁杰,张姗
(四川农业大学 食品学院,四川 雅安,625014)
四川自然发酵香肠简称四川香肠或川味香肠,是我国传统发酵肉制品之一,因其麻辣爽口的特点深受消费者喜爱。近年来,发酵食品的食用安全性问题不断受到关注,而生物胺是关注热点。四川香肠的成熟伴随着复杂的微生物变化和蛋白质变化,原料肉以及自然环境中的微生物可能会产生氨基酸脱羧酶,导致生物胺的产生。生物胺是由氨基酸脱羧或醛和酮氨基化形成的具有生物活性的小分子量含氮有机化合物[1],对于维持人体正常生理功能有着重要意义。但是,过量的生物胺会对人体健康造成危害,如高血压、头痛、腹泻和呕吐等[2],其中组胺的毒性最大[3]。
SUN等[4]研究结果表明,30种市售四川香肠中组胺为最主要的生物胺,且所有样品中组胺含量超过了100 mg/kg。孙霞等[5]对传统发酵四川香肠加工贮藏过程中生物胺含量变化结果表明,组胺含量在成熟时高达127.90 mg/kg。卢士玲等[6]调查的42个传统中式香肠中,有11.9%的样品组胺超过规定标准。PAPAVERGOU等[7]发现,50个希腊发酵干香肠中组胺含量在0~515 mg/kg之间,有28%的样品组胺含量超过了100 mg/kg。ROSEIRO等[8]发现,20%的萨拉米香肠中组胺含量超过了100 mg/kg,成熟30 d的香肠中生物胺总量约为2 500 mg/kg。由此可见,控制发酵香肠中组胺的含量,对保证发酵香肠的安全有重要意义。
目前,国内外专门针对发酵香肠中组胺降解菌筛选的研究还鲜有文献报道。本研究以四川省内不同地区的20个自然发酵香肠样品作为实验材料,对能用做香肠发酵剂且具有降解组胺能力的菌株进行筛选鉴定,为四川香肠的安全生产提供参考。
1 材料与方法
1.1 实验材料
20个自然发酵香肠样品均购于四川省的4个不同区域,分别是川西8个(成都市3个、雅安市3个和资阳市2个)、川东4个(遂宁市2个、南充市2个)、川北4个(绵阳市2个和广元市2个)、川南4个(宜宾市2个、攀枝花市2个)。香肠成熟时间均为30 d,采样后置于无菌塑料袋中,4℃下贮藏备用。
新鲜猪肉、肠衣、食盐、白酒、白糖等原辅料均购于四川省雅安市农贸市场。
2株生物胺产生菌大肠杆菌(Escherichiacoli)和奥默柯达菌(Kodamaeaohmeri)由四川农业大学食品学院肉品加工实验室从四川香肠中分离得到。
1.2 试剂与仪器
试剂:组胺标品、丹磺酰氯:Sigma公司;乙腈、丙酮、甲醇等:色谱纯;色氨酸、苯丙氨酸、精氨酸、鸟氨酸、赖氨酸、组氨酸、酪氨酸、磷酸吡哆醛、盐酸二甲基对苯二铵盐酸盐、α-萘酚等:分析纯;细菌总DNA提取试剂盒、PCR相关试剂:天根公司。
仪器:SW-GJ-IFD型超净工作台,苏净集团泰安公司;SYQ-DSX-280B型高压蒸汽灭菌锅,上海申安医疗器械厂;BMS602型均质机,德国BRT公司; LC-2010CHT高效液相色谱仪,日本岛津;PCR和凝胶成像仪,Bio-Rad;pHS-3C+酸度计;Milli-Q超纯水仪,美国Millipore公司;游标卡尺,恒量公司;牛津杯(内径0.6±0.01 cm,外径0.8±0.01 cm,高度1.0±0.01 cm)。
1.3 实验方法
1.3.1 培养基制作
产胺上层培养基:溴甲酚紫0.06 g,琼脂20 g,蒸馏水1 000 mL,调pH 5.2。产胺下层培养基:MRS固体培养基中加入5 g色氨酸、苯丙氨酸、精氨酸、鸟氨酸、赖氨酸、组氨酸、酪氨酸,0.05 g磷酸吡哆醛,调pH 5.2。
1.3.2 降生物胺乳酸菌分离纯化
参照卢世玲等[6]的方法略做修改。取25 g肉样于225 mL无菌生理盐水中均质混匀,取1 mL进行富集培养并梯度稀释,取稀释液200 μL涂布于含8 g/L CaCO3的MRS固体培养基上培养24 h,挑取具有溶钙圈的菌株于产生物胺显色培养基上进行显色,每个适宜稀释度平行3次。5 min内显紫色的为产胺菌,黄色为不产胺菌,平行显色2次。将2次均显黄色菌株于MRS培养基上分离纯化3次后于4 ℃斜面保藏备用。
1.3.3 菌株初筛
能用做发酵肉制品发酵剂的乳酸菌应耐受6% NaCl和150 mg/kg NaNO2,具有产酸能力较强,发酵葡萄糖不产气,不产H2O2、H2S、NH3和黏液等特点。由于蛋白质为生物胺的前体物质,菌株还需对蛋白质无明显的分解作用,此外具有氧化酶活性的菌株可以降解生物胺。据此,进行以下筛选实验[9-10]:耐食盐试验、耐亚硝酸盐试验、产黏性试验、葡萄糖产气试验、产H2S试验、H2O2试验、过氧化氢酶试验、产色素检测、精氨酸产氨试验、V-P试验、石蕊牛乳试验、硝酸盐还原试验、蛋白质降解活性试验和氧化酶活性试验。
1.3.4 菌株复筛
取初筛菌株分离纯化3次,并在MRS液体培养基中活化3次,然后接入含300 μg/mL组胺的营养肉汤培养基中,37 ℃培养48 h后,取1 mL样品,加入0.1 mol/L的盐酸1 mL后于-20 ℃冰箱中待测。取1 mL含300 μg/mL组胺的营养肉汤培养基1 mL作为空白对照。样品平行测定3次取平均值。
1.3.4.1 标准溶液配制与柱前衍生
准确称取组胺标品0.010 0 g,用0.1 mol/L的盐酸定容至10 mL,分别吸取5、10、20、50、100、200、500、1 000 μL的标准溶液定容至10 mL,各取1 mL依次加入200 μL 2 mol/L NaOH,300 μL饱和NaHCO3和2 mL 10 mg/mL丹磺酰氯丙酮溶液并混匀,40 ℃暗反应45 min后加入100 μL的NH4OH去除残留的丹磺酰氯,加乙腈定容至5 mL后 0.45 μm滤膜过滤,用于标曲绘制。
1.3.4.2 样品检测
待测样品衍生步骤同1.3.4.1。
1.3.4.3 色谱条件
色谱柱为C18柱(4.6 mm×250 mm,5 μm),流动相A为超纯水,流动相B为乙腈,流速为1 mL/min,紫外检测波长为254 nm,柱温30 ℃,进样量10 μL,采用梯度洗脱程序,洗脱程序见表1。

表1 梯度洗脱程序
1.3.5 菌种鉴定
1.3.5.1 菌落形态特征鉴定
菌落形态:观察分离得到的菌落形态(形状、颜色等),并记录结果。
菌株形态:将菌株进行革兰氏染色,观察菌体形态(大小、形状等),并记录结果。
1.3.5.2 生理生化特征鉴定
将筛选得到的菌株用微量发酵管进行生理生化鉴定,参考乳酸菌的鉴定标准[11],对菌株生理生化特征进行分析。
1.3.5.3 分子生物学鉴定
将所分离得到的菌株在MRS液体培养基中37 ℃培养24 h,按照天根公司细菌基因组DNA提取试剂盒说明提取DNA,经1%的琼脂糖凝胶电泳检测后进行PCR扩增。
所选用的引物为通用引物:上游引物为27f,下游引物为1492r。PCR反应为25 μL体系:包括1 μL的模板DNA,上游引物和下游引物各1 μL,2×Taq Master MIX 12.5 μL,无菌水9.5 μL。PCR反应程序:95 ℃预变性5 min,30个循环(95 ℃变性1 min;55 ℃退火90 s;72 ℃延伸2 min),最终72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,送成都擎科公司测序,并与NCBI数据库中已知序列进行对比。
1.3.6 菌株生长特性
1.3.6.1 菌株生长能力和产酸能力测定
将菌株接种到MRS液体培养基中,37 ℃培养24 h,每2 h分别用分光光度计和pH计测定600 nm处吸光值和pH值,以空白培养基作为对照,平行3次取平均值。
1.3.6.2 菌株耐食盐能力和耐亚硝酸盐能力测定
将菌株接种到分别含0、20、40、60、80 g/L NaCl和分别含0、50、100、150、200 mg/kg NaNO2的MRS液体培养基中,37 ℃培养24 h,用分光光度计测定600 nm处吸光值,以空白培养基作为对照,平行3次取平均值。
1.3.6.3 菌株在不同温度和酸度下生长能力测定
将菌株接种到MRS液体培养基中,分别在10、20、30、40、50 ℃条件下培养24 h,用分光光度计测定600 nm处吸光值,以空白培养基作为对照,平行3次取平均值。
将菌株接种到pH值为3.5、4.5、5.5、6.5、7.5、8.5、9.5的MRS液体培养基中,37 ℃培养24 h,用分光光度计600 nm处吸光值,以空白培养基作为对照,平行3次取平均值。
1.3.7 抑菌试验
1.3.7.1 降解菌之间的抑制作用
参考刘冬梅等[12]的方法,以鉴定得到的降解菌两两做抑菌试验,步骤如下。指示菌在MRS液体培养基中活化24 h后调OD值为0.8±0.02,取200 μL培养液涂布于营养琼脂培养基上;受试菌活化24 h后调OD值为0.8±0.02,取1 mL接种到新的培养基中37 ℃培养24 h, 95 ℃水浴15 min后8 000g离心10 min,取上清液200 μL接入牛津杯中,4 ℃扩散4 h后,37 ℃培养24 h,观察现象。以空白培养基做对照,平行4次。
1.3.7.2 组胺降解菌对产胺菌的抑制作用
以两两间无抑制作用的降解菌分别对产胺菌做抑菌试验;以降解菌按1∶1∶1的比例混合后对产胺菌做抑菌试验。指示菌和受试菌浓度的调整同1.3.7.1,以空白培养基做对照,平行4次。用游标卡尺测定抑菌圈大小。
1.3.8 组胺降解菌对四川香肠组胺含量的影响
1.3.8.1 香肠制作和样品采集
参照巩洋[13]的配方和工艺流程制作香肠。
本研究在预实验的基础上,确定香肠的工艺参数:发酵温度20 ℃,发酵相对湿度75%,发酵时间2 d;成熟温度13 ℃,成熟相对湿度60%,成熟时间28 d。以筛选得到的组胺降解菌作为发酵剂,接种量为107CFU/g,菌株按照1∶1∶1的比例混合加入。
实验分组:A组为未接种组,B组为接种组。取香肠加工贮藏过程中的9个工艺点,即0(原料肉)、2、6、10、14、18、22、26、30 d进行采样。
1.3.8.2 组胺含量测定
取5 g肉加入20 mL 0.1 mol/L的盐酸匀浆,4 ℃,4 000g离心10 min,沉淀部分如前的方法再提取1次。取2次的上清液用0.1 mol/L的盐酸定容到50 mL,取1 mL样液进行柱前衍生。衍生步骤同1.3.4.1,测定方法同1.3.4.3。
1.3.9 数据处理与统计分析
2 结果与讨论
2.1 组胺降解菌的筛选
2.1.1 菌株分离纯化结果
溴甲酚紫的pH变色范围为5.2(黄色)~6.8(紫色),而生物胺是一种有机碱,当菌株产生生物胺时会使培养基的pH值高于6.8而变为紫色。采用单层平板培养双层平板显色的方法,从不同地区的20个市售四川香肠样品中一共分离得到能在MRS培养基上生长且具有溶钙圈,倒入上层培养基显黄色(不产生物胺)的菌株256株(图1-b);分离得到在营养琼脂培养基上生长,倒入上层培养基显紫色(产生物胺)的菌株7株(图1-a、1-c)。
2.1.2 菌株初筛结果
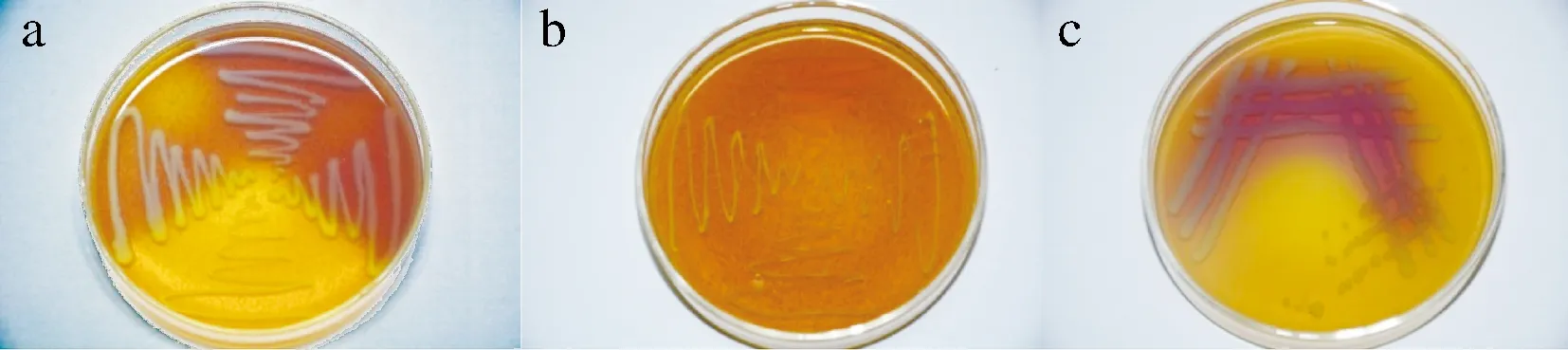
图1 培养基显色结果Fig.1 Chromogenic result of color medium
由于水分的散失,香肠在成熟时食盐和亚硝酸盐的质量分数能达到6%和0.015%左右。因此,能用作发酵剂的菌株应耐受质量分数为6%的食盐和质量分数为0.015%的亚硝酸盐。黏液能影响香肠的组织状态,产气会影响香肠结构的致密性,H2S、H2O2和NH3等不良气体会影响香肠的风味,色素会影响香肠的感官。因此,发酵剂应该不产黏液、H2S、H2O2、NH3和色素等。另外,亚硝酸盐不仅具有发色作用,还能抑制肉毒梭状芽孢杆菌,因此菌株还应该具有还原硝酸盐的能力。由于蛋白质是生物胺的前体物质,发酵剂最好不具有蛋白质降解能力。具有氧化酶活性的菌株可以降解生物胺。
在分离得到的256株菌中,符合发酵肉制品发酵剂相关标准且具有氧化酶活性的菌株共17株,编号分别为2、4、19、25、33、39、40、41、42、43、44、45、46、47、48、49和50,初筛结果如表2所示。将这17株菌进行组胺降解能力的测定。

表2 菌株初筛结果
注:+:反应为阳性;-:反应为阴性。
2.1.3 菌株降组胺能力
2.1.3.1 组胺标准曲线绘制结果
由图2可知,溶剂峰及杂质峰在5 min前洗脱,组胺的保留时间为15.018 min,保留时间相对稳定,峰形对称、尖锐,能达到较好的分离度。根据峰面积求得组胺浓度的回归方程为y=22 214x+993.97,决定系数R2=0.999 1,说明线性良好。
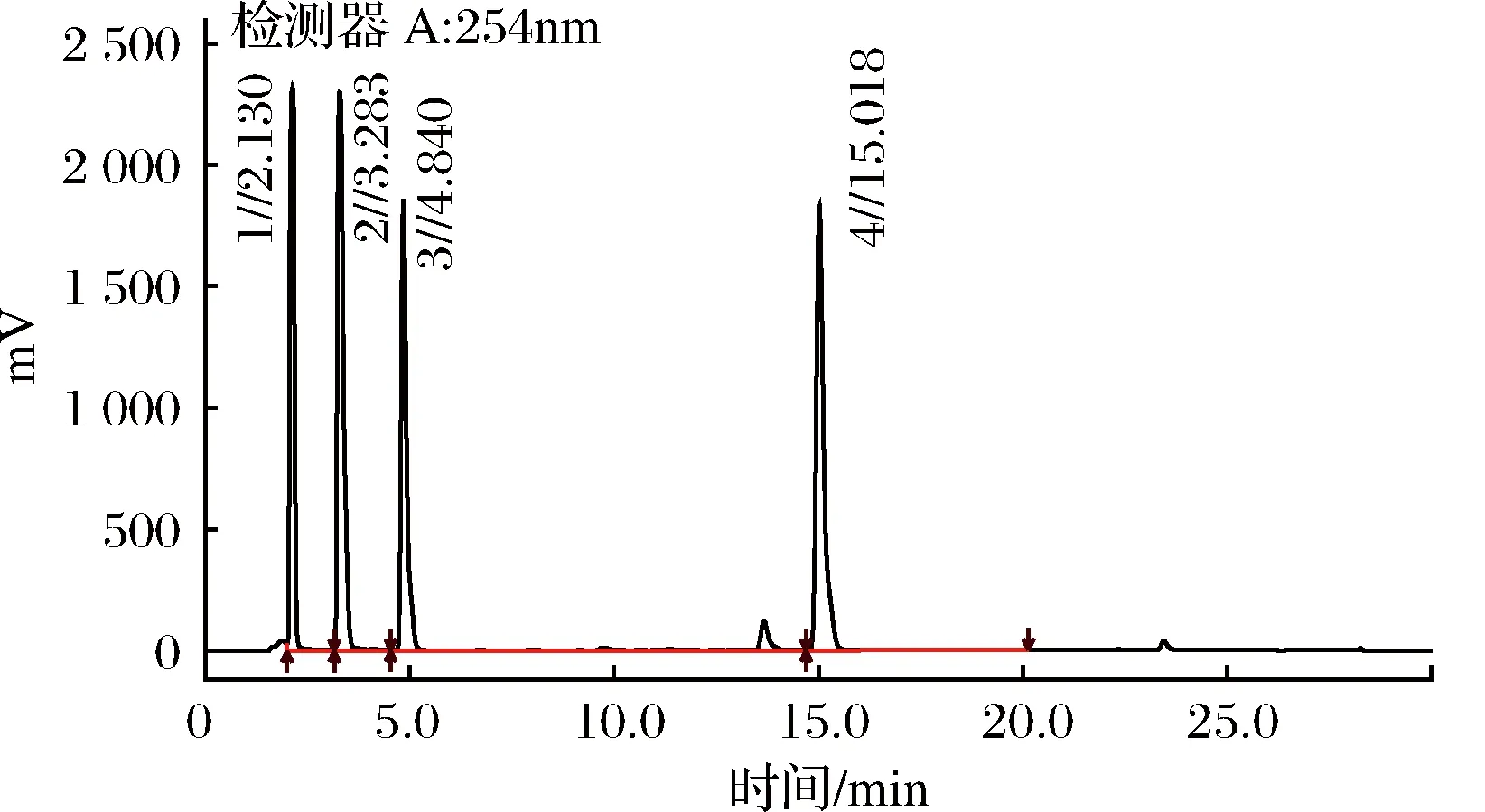
图2 组胺标品高效液相色谱图Fig.2 The HPLC chromatogram of standard histamine
2.1.3.2 组胺降解率测定结果
由图3可知,17株菌对组胺都有不同程度的降解能力,其中19号、41号、46号、47号和48号菌株的降解率分别为23.07%、17.90%、14.48%、15.47%和26.79%,均高于10%,可用于后续实验。
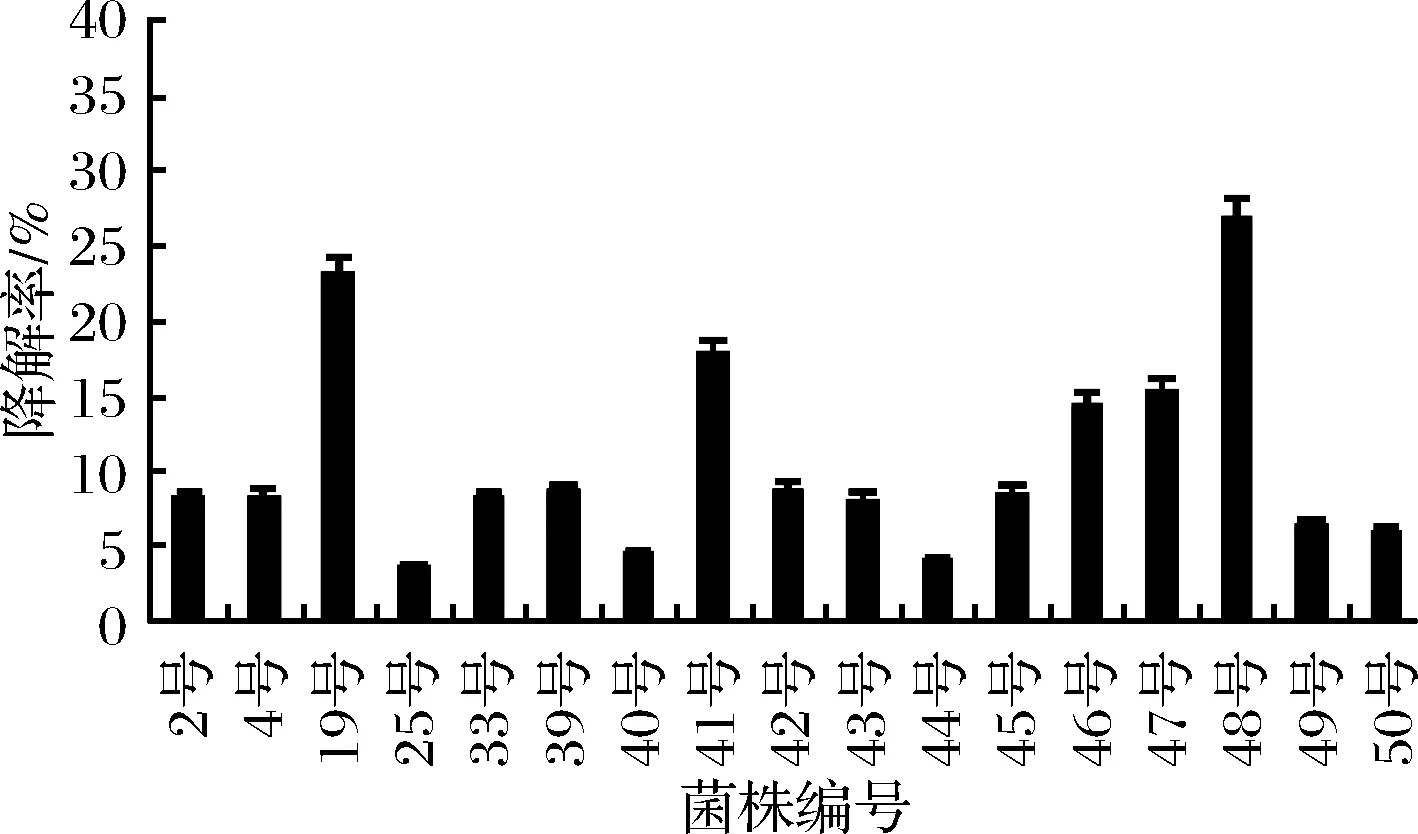
图3 菌株的组胺降解率Fig.3 The histamine degradation rate of strains
2.2 菌株的鉴定
2.2.1 形态学鉴定结果
将复筛得到的组胺降解率较高的菌株接种到MRS培养基上,37 ℃培养24 h后观察菌落形态并进行革兰氏染色。菌株和菌落的形态学鉴定结果如表3所示。

表3 菌株形态和菌落形态鉴定表
2.2.2 生理生化鉴定结果
参照《乳酸细菌分离鉴定及其试验方法》对复筛得到的5株菌进行生理生化鉴定,结果如表4所示。初步判定19号为植物乳杆菌(Lactobacillusplantarum),41号为戊糖片球菌(Pediococcuspentosaceus),46号为混淆魏斯氏菌(Weissellaconfusa),47号和48号为屎肠球菌(Enterococcusfaecium)。

表4 菌株生理生化鉴定结果
注:+:反应为阳性;-:反应为阴性;/:未检测。
2.2.3 分子生物学鉴定结果
采用试剂盒提取编号为19、41、46、47和48菌株的DNA,用通用引物对5株菌的16S rDNA进行扩增,经1%琼脂糖凝胶电泳后得到5条长约1 500 bp的扩增产物,如图4所示。

图4 16S rDNA的PCR产物电泳图Fig.4 The electrophoresis results of 16S rDNA PCR amplification
泳道1为marker DL 2 000,泳道2为19号菌株的PCR产物,泳道3为41号菌株的PCR产物,泳道4为46号菌株的PCR产物,泳道5为47号菌株的PCR产物,泳道6为48号菌株的PCR产物。将PCR测序结果与NCBI数据库中的已知序列进行对比,结果如表5所示。

表5 菌株分子生物学鉴定结果
2.3 抑菌试验
2.3.1 组胺降解菌之间的抑制作用
牛津杯抑菌实验结果表明,19号、41号、46号、47号和48号5株菌之间无明显拮抗作用。由于屎肠球菌可能具有耐药性,根据菌株鉴定结果,选择19号、41号和46号3株安全的且为食源性的乳酸菌,用于后续研究。
2.3.2 组胺降解菌对产胺菌的抑制作用
图5(a)为混合菌对大肠杆菌的抑菌图,图5(b)为单一菌对奥默柯达菌的抑菌图。抑菌圈测量结果发现,19号、41号、46号以及混合菌对大肠杆菌的抑菌圈大小分别在1.530~1.566、1.360~1.478、1.412~1.470、1.688~1.886 cm范围内,对奥默柯达菌的抑菌圈大小分别在1.312~1.354、1.318~1.402、1.210~1.370、1.422~1.464 cm范围内。由表6可知,菌株对大肠杆菌的抑制作用比奥默柯达菌强,表明大肠杆菌的敏感性比酵母菌强,这可能是由于细菌和真菌的细胞结构不同导致对抑菌物质的敏感性不同。许多研究表明,乳酸菌的代谢产物,如乳酸[16],乳酸链球菌肽[17],有机酸[18]等均具有抑菌活性,而混合菌种对产胺菌的抑菌圈大小显著大于单一菌种对产胺菌的抑菌圈大小(p<0.05),可能是因为不同菌株的发酵液中的抑菌物质对产胺菌的抑制具有协同作用,而抑菌物质的确定还有待进一步研究。

a-混合菌对大肠杆菌的抑菌图;b-单一菌对奥默柯达菌的抑菌图图5 组胺降解菌对组胺产生菌的抑制作用Fig.5 The inhibition of histamine reducing strains to histamine producing strains
表6 抑菌实验结果
Table 6 The results of inhibition

受试菌抑菌圈直径/cm大肠杆菌奥默柯达菌空白0.805±0.0040.802±0.00319号1.546±0.0151.334±0.01741号1.422±0.0491.368±0.03746号1.444±0.0271.312±0.071混合菌1.772±0.0881.436±0.019
2.4 组胺降解菌的生长特性
2.4.1 菌株的生长能力和产酸能力
能用做香肠发酵剂的菌株需要有较强的生长能力和产酸能力。由图6和图7可知,3株菌的生长能力和产酸能力为19号高于41号高于46号,在培养24 h后培养基的pH值均低于5.0,说明3株菌均具有较好的产酸能力,符合生产发酵香肠的基本要求。

图6 菌株的生长能力Fig.6 The growth ability of strains

图7 菌株的产酸能力Fig.7 The acid producing ability of strains
2.4.2 菌株的耐食盐和耐亚硝酸盐能力
能用于香肠发酵剂的菌株需要能耐受60 g/L的食盐和150 mg/kg的亚硝酸盐。由图8和图9可知,当食盐质量浓度低于60 g/L时3株菌均能生长,当质量浓度升高到80 g/L时,3株菌培养24h后的OD值均低于0.2,这是由于较高的食盐浓度增加了渗透压从而抑制了菌株的生长活性;亚硝酸盐浓度在0~200 mg/kg范围内,3株菌均能较好地生长。该结果表明,3株菌耐受一定浓度的食盐和亚硝酸盐,符合生产发酵香肠的发酵剂的基本要求。

图8 菌株的耐食盐能力Fig.8 The resistant to salt of strains

图9 菌株的耐亚硝酸盐能力Fig.9 The resistant to nitrite of strains
2.4.3 不同pH和温度下的生长能力
香肠的发酵和成熟温度通常在10~20 ℃之间,香肠成熟时pH值通常在5.2~5.6之间。由图10和图11可知,3株菌均可在一定的低温和低pH值情况下生长,能满足香肠发酵的要求。
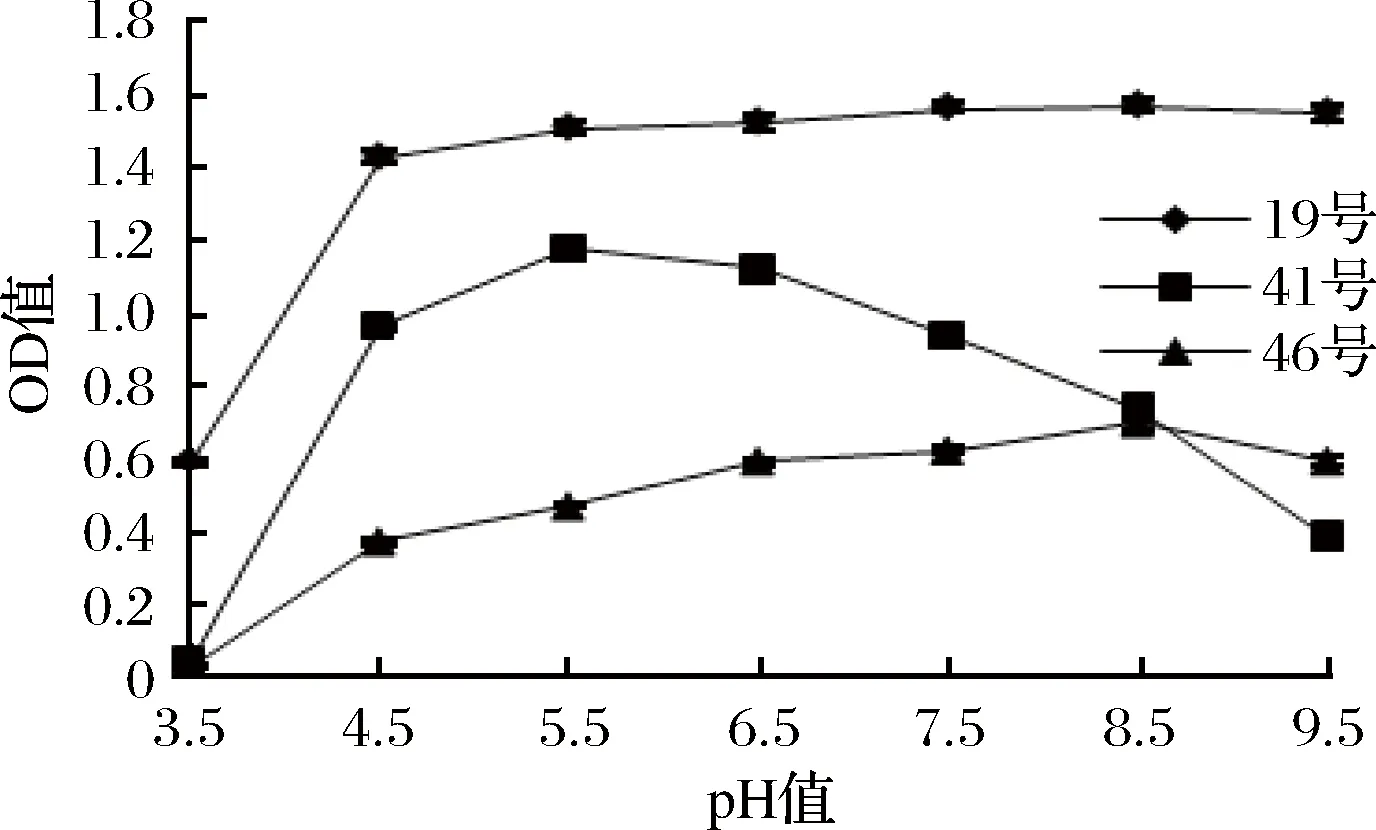
图10 不同pH值下3菌株的生长能力Fig.10 The growth ability at different pH
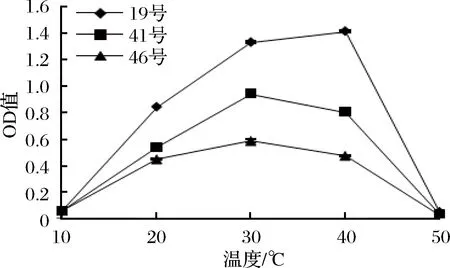
图11 不同温度下3菌株的生长能力Fig.11 The growth ability at different temperature
2.5 四川香肠加工过程中组胺含量的变化
由图12可知,香肠发酵结束时(2 d)未检测到组胺,而在香肠成熟的整个过程中,未接种组和接种组的组胺含量均呈上升趋势,与孙霞等[19]结果相似。这可能是因为原料肉中组氨酸含量较低,随着成熟过程中大量的蛋白质分解产生组氨酸,而组氨酸在微生物的作用下产生组胺而不断积累。香肠成熟时(30 d),接种组的组胺含量(46.56 mg/kg)比未接种组的组胺含量(66.77 mg/kg)降低了30.26%,说明混合发酵剂确实能显著降低(p<0.05)四川香肠中组胺的含量。但是,由抑菌实验可知发酵剂对产胺菌也具有较强的抑制作用,有多少组胺是通过发酵剂产生的氧化酶降解而减少的,有多少组胺是由于产胺菌被抑制而减少的,还有待深入研究。

图12 组胺含量的变化Fig.12 The change of histamine content during fermentation
3 结论
本实验通过平板显色法和高效液相色谱法能对组胺降解菌进行有效地分离筛选,得到符合发酵剂相关标准,能较好地降解组胺含量且为食源性的乳酸菌共3株,分别为植物乳杆菌、戊糖片球菌和混淆魏斯氏菌,对组胺的降解率分别达23.07%、17.90%、14.48%。3株菌之间无明显拮抗作用,具有较好的生长能力和产酸能力,能耐受低温、低pH值、60 g/L的食盐及150 mg/kg的亚硝酸盐,满足发酵香肠的生产要求。混合菌株比单一菌株能更好地抑制产胺菌的生长。香肠成熟30 d时,接种组按照1∶1∶1的比例混合,可显著降低组胺含量。本研究结果表明,在四川香肠发酵过程中接种专门筛选的乳酸菌可以降低其组胺的含量,这对于提升传统发酵肉制品的食用安全性具有重要的意义。
[1] KOMPRDA T, SMLD, NOVICKK, et al. Content and distribution of biogenic amines in Dutch-type hard cheese[J]. Food Chemistry, 2007, 102(1): 129-137.
[2] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690.
[3] BODMER S, IMARK C, KNEUBUHL M. Biogenic amines in foods: histamine and food processing[J]. Inflammation Research, 1999, 48(6): 296-300.
[4] SUN X, ZHOU K, GONG Y, et al. Determination of biogenic amines in Sichuan-style spontaneously fermented sausages[J]. Food Analytical Methods, 2016, 9(8): 2 299-2 307.
[5] 孙霞, 巩洋, 杨勇, 等. 传统自然发酵四川香肠加工贮藏过程中生物胺含量变化[J]. 食品与发酵工业, 2015, 41(8): 215-219.
[6] 卢士玲, 徐幸莲, 舒蒸华, 等. 传统中式香肠中生物胺调查研究[J]. 食品与发酵工业, 2009, 35(10): 141-146.
[7] PAPAVERGOU E J, SAVVAIDIS I N, AMBROSIADIS I A. Levels of biogenic amines in retail market fermented meat products[J]. Food Chemistry, 2012, 135(4): 2 750-2 755.
[8] ROSEIRO C, SANTOS C, SOL M, et al. Prevalence of biogenic amines during ripening of a traditional dry fermented pork sausage and its relation to the amount of sodium chloride added[J]. Meat Science, 2006, 74(3): 557-563.
[9] 马德功, 孙春禄, 王成忠, 等. 发酵香肠益生型乳酸菌发酵剂的筛选[J]. 食品科技, 2008, 18(4): 63-66.
[10] 李凤彩, 程文新, 谢华, 等. 发酵香肠菌种筛选标准探讨[J]. 食品工业科技, 2002, 20(6): 78-79.
[11] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999.
[12] 刘冬梅, 李理, 杨晓泉, 等. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110-111.
[13] 巩洋, 孙霞, 张林, 等. 混合菌种发酵生产低酸度川味香肠的加工工艺[J]. 食品工业科技, 2015, 36(5): 227-239.
[15] 佟婷婷. 四川泡菜细菌多样性分析及降生物胺菌株筛选[D]. 无锡, 江南大学, 2015.
[16] 乔支红, 程永强, 鲁战会, 等. 乳酸对三种食源性致病菌的抑菌及杀菌作用[J]. 食品科技, 2008, 10: 187-191.
[17] 巩凡, 胡晓燕, 吴伟芳, 等. 干酪乳酸杆菌代谢物对白假丝酵母菌生物被膜的体外抑菌效果及分子机制[J].山东大学学报(医学版), 2017, 55(2): 74-78.
[18] 李洁, 李晓然, 宫路路, 等. 乳酸片球菌发酵液中主要有机酸及其抑菌性研究[J]. 食品与发酵工业, 2014, 40(5): 124-129.
[19] 孙霞, 巩洋, 杨勇, 等. 混合菌种发酵生产低酸度川味香肠加工过程中生物胺含量的变化[J]. 食品与发酵工业, 2015, 41(6): 81-87.
