群体感应信号分子AI-2高产乳酸菌株筛选及特性研究
2018-02-28蔡针华程娜贾震虎逄晓阳
蔡针华,程娜,贾震虎*,逄晓阳
1(山西师范大学 生命科学学院,山西 临汾,041000) 2(中国农业科学院农产品加工研究所,北京,100193)
乳酸菌属于革兰氏阳性菌,是一类能利用碳水化合物产生乳酸,并对人体健康有特殊作用的重要益生菌。进入宿主肠道后可以通过生物拮抗作用抑制病原菌的粘附定植[1]和生长繁殖[2-3],在宿主肠道发育过程中发挥着重要作用[4]。据报道乳酸菌具有促进食物消化与吸收、降低血清胆固醇、抑制病原菌和抗感染、抗肿瘤及预防衰老等作用[5]。迄今为止,对乳酸菌粘附和定植肠道的详细机制仍在探索之中,但是目前学术界关于乳酸菌肠道黏附已经达成的初步共识是,肠道菌群和宿主免疫系统通过相互作用减少炎症反应,对维持机体微生态平衡发挥着重要作用[6]。随着研究的不断深入,有关乳酸菌的研究已涉及生物学和医学的各个领域,包括乳酸菌的鉴定和分类、与粘膜免疫机制、益生作用及表达系统等[7]。研究者发现乳酸菌菌群的群体行为跟很多生物现象相关,比如生物膜形成[8]、自溶[9]、肠道定植能力等,所以大量研究开始关注乳酸菌的群体行为,而细菌的群体感应现象是研究菌群群体行为的突破口[10]。
细菌的群体感应(quorum sensing,QS)系统是通过菌体向周围环境中分泌群体感应信号分子,同时菌体细胞膜上具有感知这种信号分子的受体,当菌群密度达到一定阈值的时候,菌体细胞膜上的信号分子受体感受到这种密度压力后,通过磷酸化的方式将QS信号传递给调控基因表达的调控蛋白,通过调控蛋白对菌体的生理代谢进行调节。细菌种间交流主要是通过自体诱导剂-2(Autoinducer-2,AI-2)来完成的[11],AI-2主要是由保守的LuxS蛋白酶在甲基循环中催化合成,这种信号分子存在于大多数细菌中,在许多微生物进行种内和种间的交流起到了关键的作用。目前已报道在超过80种细菌中存在luxS基因[12-13],不仅在致病菌中有luxS基因,许多益生菌中也拥有luxS基因并能够生成AI-2[12,14-15]。研究表明,luxS介导的群体感应系统对细菌多种生理现象具有重要的调控作用[16],因此深入研究乳酸菌luxS基因的功能将为后续解析乳酸菌群体感应信号传导通路、探索乳酸菌在宿主肠道内粘附定植的机制奠定基础。
1 材料与方法
1.1 菌株
8株乳酸菌均为实验室保藏菌株。大肠埃希氏菌 DH5α 购自北京全式金生物技术有限公司。哈维弧菌 BB152 (VibrioharveyiBB152),哈维弧菌 BB170 (VibrioharveyiBB170)、均购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.2 培养基及试剂
LB液体培养基:10 g胰蛋白胨(TRYPTONE)(OXOID 公司)、5 g酵母提取物(YEAST EXTRACT)(OXOID公司)、10 g NaCl(生工生物),使溶质完全溶解,调节 pH值至7.5,定容至1 L,121 ℃,15 min灭菌,4 ℃保存备用。
AB培养基:1 L培养基中加入0.05 mol/L MgSO4(AMRESCO 公司),0.3 mol/L NaCl(AMRESCO公司),0.2% vitamin-free Casamino Acids(BD公司), 用KOH(AMRESCO公司)调pH至7.5,121 ℃,15 min灭菌后添加10 mL 1 mol/L K2HPO4(AMRESCO公司)(0.22 μm滤器过滤),10 mL 0.1 mol/LL-精氨酸(AMRESCO 公司)(0.22 μm 滤器过滤),20 mL 50%甘油(0.22 μm滤器过滤)。
MRS液体培养基:北京陆桥技术股份有限公司;MB液体培养基、MB固体培养基:青岛高科园海博生物技术有限公司;细菌基因组提取试剂盒、细菌RNA提取试剂盒、cDNA反转录试剂盒、RT-PCR试剂盒,北京全式金生物技术有限公司。
1.3 主要仪器
凝胶成像仪(GelDocXR+,美国伯乐公司);快速梯度PCR仪(TP600),日本TAKARA公司;实时荧光定量PCR仪(ABI7500),美国Perkin ELmer公司;全波长酶标仪(SPARK20M),瑞士TECAN公司;恒温培养箱(OJ5-2012R),上海精密仪器有限公司;恒温金属浴(MB-102),杭州博日科技有限公司。
1.4 菌种保藏活化及各生长时期的确定
从70多株乳酸菌中经过平板计数挑选8株进行实验(表1)。

表1 实验所用菌株
将冻存的8株乳酸菌分别活化3代。每代于37 ℃培养18 h,连续培养3代即可用于实验。BB170和BB152冻干粉复苏,划线于MB平皿,28 ℃恒温箱静置至生长出大小适宜的单菌落。随后挑单菌落于MB液体培养基中,每代于28 ℃振荡培养24 h,连续活化培养3代即可用于实验。取商品化DH5α,于LB
液体培养基,37 ℃,200 r/min振荡培养10 h至指数期,每代于37 ℃振荡培养10 h,连续培养3代即可用于实验,每次使用按4%的接种量接种于新鲜MRS培养基中。取活化好的乳酸菌菌液以4%的接种量于新鲜的MRS液体培养基中混匀,取1 mL于24孔透明酶标板中,用多功能酶标仪每隔1 h测1次OD600 nm值,绘制生长曲线确定各菌株的指数期,平台期。
1.5 生物学方法检测信号分子AI-2
将已活化好的8株乳酸菌按4%接种至灭菌后的MRS液体培养基中,37 ℃继续培养18 h(平台期)大约109CFU/mL,将菌液6 000 r/min离心10 min,上清液用0.22 μm的灭菌滤菌器过滤分装至2 mL离心管中,得到各乳酸菌的无菌上清液;按相同方法收集28 ℃振荡培养13 h的V.harveyiBB152无菌上清液和37 ℃培养的DH5α无菌上清液分别作为阳性对照和阴性对照;所得无菌上清液分别贮藏于-80 ℃冰箱备用。
将报告菌株培养至菌体OD600 nm为0.8~1.2,然后用新鲜的AB培养基以1∶5 000的比例与报告菌株混匀。分别将各乳酸菌、V.harveyiBB152、DH5α无菌上清液作为待测样品、阳性对照和阴性对照,经条件优化后按1∶100混合于稀释后的报告菌株培养液中,置于30 ℃继续振荡培养。不加任何菌液的只有稀释过的报告菌株培养液作为介质对照,1~6 h内,每隔1 h取200 μL至96孔黑色酶标板中,用多功能酶标仪的生物发光模式检测其荧光强度值,在1~6 h内,以阴性对照组荧光强度值降到最小的时间点为基准,此时阳性组相对荧光强度设为1,信号分子AI-2的强度用相对荧光表示。样品与对照均做3个复孔,每次实验重复3次。按照以下方式计算各菌株荧光强度:阴性对照组荧光强度为阴性对照的荧光强度值与阳性对照的荧光强度值之比;待测组相对荧光强度值为待测样品的荧光值与介质对照荧光值之比。
1.6 luxS基因的生物学鉴定
1.6.1 引物的设计
根据 NCBI上luxS基因的DNA全长序列(No.1063754),应用Oligo7设计内参引物(16S rRNA-F和16S rRNA-R) 及特异性引物 (LuxS-F和LuxS-R)、(LDH-F和LDH-R)并由北京六合华大基因科技股份有限公司合成,具体引物序列见表2。
1.6.2 菌种RNA提取及cDNA合成
将4株乳酸菌按4%的接种量转接入MRS液体培养基中,37 ℃培养18 h至平台期,离心收集菌体细胞,按照常规Trizol法提取菌体总RNA。cDNA按如下体系进行合成:3μL RNA(1 μg)溶液中加入 4 μL Mix和 1 μL gDNA Remove,Rnase-free Water至20 μL,轻轻混匀后 42 ℃孵育15 min,85 ℃加热5 s以获得cDNA。
1.6.3 实时荧光定量PCR
PCR反应体系(20 μL)为:Tip Green Qpcr SuperMix 10 μL,ddH2O 8.5 μL,上、下游引物(10 μmol/L)各0.4 μL,Passive Reference Dye(50×) 0.4 μL,模板1 μL。PCR 反应条件为 95 ℃ 10 min;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 34s,40个循环;PCR产物经1%琼脂糖凝胶电泳检测,将产物送至北京六合华大基因科技股份有限公司进行DNA测序。
1.7 乳酸菌种内不同pH下信号分子AI-2与菌体密度的关系
将筛选出高产AI-2信号的乳酸菌AST18进行耐酸性与信号分子AI-2的研究,备好的菌液按4%接种到不同pH培养基中,37 ℃培养18 h,按1.3.2的方法检测不同pH培养条件下乳酸菌AI-2的情况。样品与对照均做3个复孔,每次实验重复3次。
2 结果与讨论
2.1 各菌株生长周期的确定
结合表1和图1选取实验室的8株乳酸菌是因为他们在连续活化3代培养18 h后,经平板计数菌落数都是109CFU/mL,通过多功能酶标仪获得各乳酸菌的生长曲线,它们有相同的生长周期,在培养18 h后都达到了对数末期,保证了几株菌的菌群密度一致性,几株菌又是实验室研究较多的,遗传背景比较清楚,故实验选取这8株乳酸菌来进行后续实验。相关研究已经证实,乳酸菌产信号分子AI-2通常都在对数末期或者稳定初期达到最高[17-18],这可能是由于大量 AI-2信号分子随着菌体密度的增高而增多,但当其浓度达到一定阈值时,发生的内化作用,菌体重吸收或附着在细胞膜表面,调控稳定期的某些重要生理功能[18]。由图1显示,8株乳酸菌大概从3 h进入指数期,10 h到达指数末期,之后进入平台期,OD600 nm在指数末期达到最大,在18 h时OD600 nm趋于稳定,处于平台期,因此实验中选择培养18 h时测定不同乳酸菌产信号分子 AI-2的荧光强度。

图1 8株乳酸菌的生长曲线Fig.1 Growth curves of eight strains of lactic acid bacteria
2.2 菌株培养上清AI-2信号检测
结合已研究的方法[17-20]进行优化设计,实验中用到的指示菌株V.harveyiBB170是标准菌株V.harveyiBB120的定向突变菌株,产信号分子AI-2的luxS基因是完整的,所以选它为报告菌株。不同细菌产生的信号分子AI-2,都能被报告菌株V.harveyBB170识别,诱导其荧光酶基因的表达,从而产生发光反应[21]。V.harveyBB152也是突变体且只能产生信号分子AI-2,故作为阳性对照[17],大肠埃氏菌DH5α由于缺失luxS基因不能产生AI-2信号,故作为阴性对照。由图2可知,在0~3 h内所有对照组的荧光强度均随时间的延长而在不断下降,且阴性对照在3 h时荧光强度已经达到最低,之后开始升高,由于阴性对照中只包含稀释后的报告菌株,表明当培养时间达到3 h时,指示菌产生的信号分子AI-2浓度达到诱导其发光的阈值。因此,以3 h时的荧光强度值为标准计算各菌株相对荧光强度,表示信号分子AI-2活性。依据文献[22]研究发现,V.harveyiBB170构成的AI-2检测体系对pH值较敏感,过酸或者过碱均会对指示菌的发光性产生影响。从最优角度出发,按照1∶100的加样比例添加,此时体系中既含有足够量的AI-2信号分子足以诱导V.harveyiBB170产生荧光,同时又避免了培养上清液中酸度和抑菌物质对指示菌的影响[19]。检测结果如图3所示,8株乳酸菌的相对荧光强度只有1株SY13小于阴性对照,说明其中7株乳酸菌均可以产信号分子AI-2,其中乳酸菌YL-6、AST18和ZNJ160201的相对荧光强度明显高于其他几株,乳酸菌LGG、YL-LGG-ATCC和LJJ的相对荧光强度较弱。

图2 不同孵育时间各样品的荧光强度值Fig.2 The luminescence of different incubation time of samples

图3 各乳酸菌培养18 h上清液的相对荧光强度Fig.3 The relative luminescence of lactic acid bacteria in incubation time 18 h
2.3 RT-PCR检测luxS基因表达情况
已被证明[23]在细菌物种中导致产生AI-2的生物合成途径是高度保守的,且已经在不同乳杆菌的基因组中发现了LuxS同源物,同时早些时候已经研究了一些乳杆菌属物种产生AI-2的情况[22,24-25]。参与AI-2生物合成的重要酶是S-核糖基半胱氨酸酶,也称为LuxS蛋白,基因组分析发现55种以上的细菌均含有AI-2合成酶luxS的同源保守序列[26]。选取其中乳酸菌AST18、ZNJ160201和SY13、YL-LGG-ATCC这4株菌用生物学方法来检测AI-2荧光强度是否是由关键基因luxS所控制和荧光方法的准确性。对4株乳酸菌进行RT-PCR检测,luxS基因的表达情况如图4。luxS基因在乳酸菌AST18、ZNJ160201表达较强,在YL-LGG-ATCC表达较弱,而在SY13菌株中几乎没有表达,与图2的荧光结果较一致,同时通过结合两种检测结果,说明AI-2荧光强度是由关键基因luxS所控制。
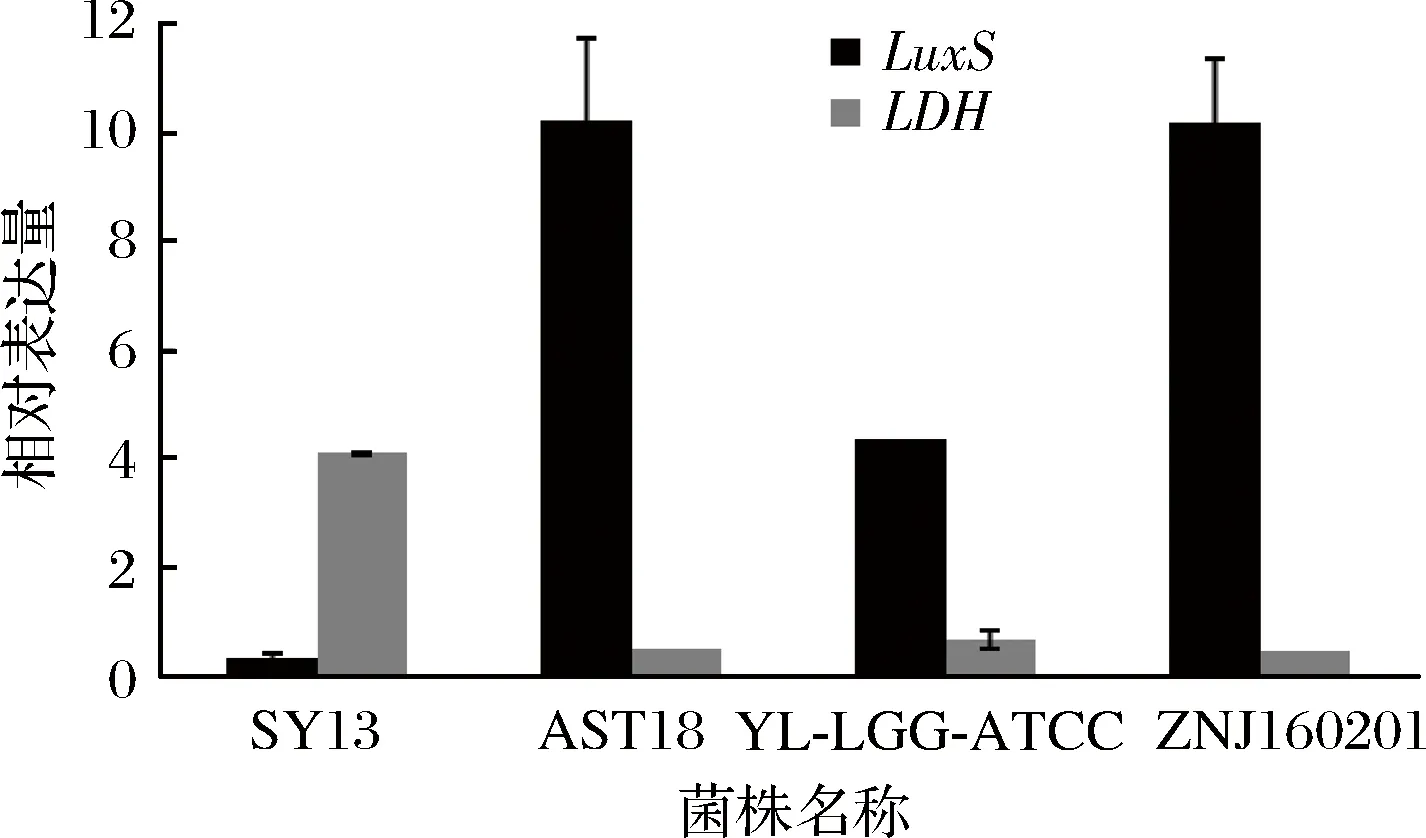
图4 四株乳酸菌luxS基因和LDH基因的相对表达量Fig.4 Relative expression of luxS gene and LDH gene of four lactic acid bacteria
LEBEE[24]等人已经研究得出luxS基因在乳酸菌中有中枢代谢作用。同时群体感应必不可少可能伴随着能量反应,luxS基因可能间接的参与了EMP,磷酸戊糖和TCA等循环,因而实验又选择LDH基因来检测QS系统与新陈代谢之间的关系。发现当luxS基因表达较强时,而LDH基因表达较弱,LDH基因编码乳酸脱氢酶的生成,进而催化丙酮酸生成乳酸,乳酸是谷氨酸发酵的主要副产物,所以当luxS基因表达较强时,LDH基因相对较弱,乳酸生成相对较少,有利于宿主体内肠道的酸碱平衡,继而维持肠道菌群平衡,从而在肠道内发挥益生作用。对这4株菌进行基因组提取,普通PCR扩增后,经过聚丙烯酰胺凝胶电泳结果如图5所示,与实时荧光聚合酶列式反应结果一致,说明菌株AST18和ZNJ160201的AI-2信号强,luxS基因表达较强,AI-2信号强度是由关键基因luxS所主导。同时通过3个结果的一致性也说明了荧光检测与RT-PCR检测相结合是比较准确的方法用于群体感应信号分子AI-2的检测。
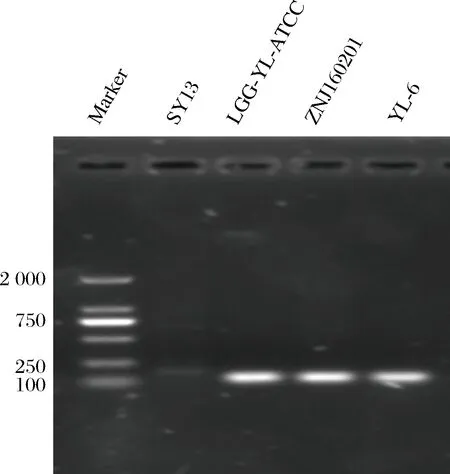
图5 LuxS基因PCR产物电泳图Fig.5 Electrophoresis of luxS gene amplified by PCR
2.4 生物发光与耐酸性特性研究
据报道[27],有机酸、苹果酸对致病菌AI-2信号的产生有抑制作用。luxS基因参与环境调控胁迫,如酸性胁迫已经在变形链球菌中被证明[28-29],但是该基因在乳酸杆菌中酸适应的作用尚不清楚。实验探究乳酸菌在强酸环境中生长后AI-2信号变化情况,结果如图6,乳酸菌在不同pH的培养基中培养后,AI-2信号也大不相同。在菌体数达到一定阈值时,能够激发报告菌株发光酶的活性,诱导报告菌株发光,酸性越强AI-2信号越强。当pH等于3.5时,菌体密度几乎是最低的,但是AI-2信号是最强的。而当pH等于2.5时,过酸的环境不利于菌体的生长,可能是菌体数没有达到阈值,所以AI-2信号较弱,上述所得结果与1.3中检测的LDH基因和luxS基因的表达相符合。这样的结果说明AI-2信号提高了乳酸菌酸胁迫作用,继而发挥其肠道益生作用;同时也说明菌体密度并不是群体感应变化的主要原因,可能与其所处的环境有极大的关系。为以后研究乳酸菌通过群体感应系统调节肠道菌群平衡及发挥免疫功能提供了一定的帮助。

图6 不同pH条件下荧光强度与OD600 nm的关系Fig.6 The relationship of light intensity and OD600 nm under unequal pH condition
3 结论
本研究筛选出3株高产群体感应信号分子AI-2乳酸菌,通过RT-PCR检测证明了荧光筛选方法的可靠性,同时确定了luxS基因编码的LuxS蛋白是控制群体感应信号分子AI-2的主要酶。同时得出在酸性环境中AI-2信号更强,说明乳酸菌能够通过群体系统的调控在酸性肠道内存活,并调控肠道菌群平衡,发挥其免疫功能。本研究为下一步研究luxS突变株与群体感应,免疫调节功能等关系奠定了基础。
[1] BAUMGART D C ,SDIGNASS A U. Intestinal barrier function[J]. Curr Opin Clin Nutr Metab Care, 2002, 5(6): 685-694.
[2] LI X J,YUE L Y,GUAN X F,et al. The adhesion of putative probiotic lactobacilli to cultured epithelial cells and porcine intestinal mucus[J]. J Appl Microbiol, 2008, 104(4): 1 082-1 091.
[3] OHLAND C L,MACNAUGHTON W K. Probiotic bacteria and intestinal epithelial barrier function[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(6): G807-819.
[4] SOMMER F, BACKHED F.The gut microbiota-masters of host development and physiology[J]. Nat Rev Microbiol, 2013, 11(4): 227-238.
[5] 代永刚,田志刚,南喜平. 乳酸菌及其生理功能研究的进展[J]. 农产品加工(学刊), 2009(7): 24-26;29.
[6] 李红娟.LactobacilluscaseiAST18抗真菌代谢产物分析及抑菌作用研究[D].北京:中国农业科学院, 2014.
[7] 任大勇,李昌,秦艳青,等. 乳酸菌益生功能及作用机制研究进展[J]. 中国兽药杂志,2011,45(2):47-50.
[8] 谢丽斯,张宏梅,刘学禄,等. 从腐败食品中分离的乳酸菌生物被膜形成的影响因素[J]. 食品与发酵工业, 2011, 37(3): 6-8.
[9] 孙洁. 乳酸菌发酵剂菌株的自溶特性及机理研究[D].北京:中国农业科学院, 2010.
[10] 冯镇,张兰威. 乳酸杆菌LB-3自溶酶特性研究[J]. 中国乳品工业, 2008, (9): 18-21.
[11] ASCENSO O S,MARQUES J C,SANTOS A R,et al. An efficient synthesis of the precursor of AI-2, the signalling molecule for inter-species quorum sensing[J]. Bioorg Med Chem, 2011, 19(3): 1 236-1 241.
[12] PARK H,YEO S,JI Y,et al.Autoinducer-2 associated inhibition byLactobacillussakeiNR28 reduces virulence of enterohaemorrhagicEscherichiacoliO157:H7[J]. Food Control, 2014, 45: 62-69.
[13] JIMENEZ J C,EDERLE M J. Quorum sensing in group A Streptococcus[J]. Frontiers in Cellular and Infection Microbiology, 2014, 4(4):127.
[14] CHRISTIAEN S E,CONNELL MOTHERWAY M O,BOTTACINI F,et al. Autoinducer-2 plays a crucial role in gut colonization and probiotic functionality ofBifidobacteriumbreveUCC2003[J]. PLoS One, 2014, 9(5): e98111.
[15] YEO S,PARK H, JI Y,et al. Influence of gastrointestinal stress on autoinducer-2 activity of twoLactobacillusspecies[J]. FEMS Microbiol Ecol, 2015, 91(7).DOI:10.1093/femsec/fivo65.
[16] MAN Li-li,MENG Xiang-chen,ZHAO Ri-hong. Induction of plantaricin MG under co-culture with certain lactic acid bacterial strains and identification ofLuxSmediated quorum sensing system inLactobacillusplantarumKLDS1.0391[J]. Food Control, 2012, 23(2): 462-469
[17] MOSLEHI-JENABIAN S,GORI K,JESPERSEN L.AI-2 signalling is induced by acidic shock in probiotic strains ofLactobacillusspp.[J]. International Journal of Food Microbiology, 2009, 135(3): 295-302.
[18] GORI K,MOSLEHI-JENABIAN S,PURROTTI M,et al. Autoinducer-2 activity produced by bacteria found in smear of surface ripened cheeses[J]. International Dairy Journal, 2011, 21(1): 48-53.
[19] 张腾,贺银凤. 坚强肠球菌SQ-3-2基于Lux S群体感应系统信号分子AI-2的检测及方法优化[J]. 食品与发酵工业, 2013, 39(2): 168-173.
[20] LI Z,NAIR S K.Quorum sensing: How bacteria can coordinate activity and synchronize their response to external signals?[J]. Protein Science, 2012, 21(10): 1 403-1 417.
[21] LEBEER S, CLAES I J J, VERHOEVEN T L A,et al. Impact ofluxSand suppressor mutations on the gastrointestinal transit ofLactobacillusrhamnosusGG[J]. Applied and Environmental Microbiology, 2008, 74(15): 4 711-4 718.
[22] DEKEERSMAECKER S C,VANDERLEYDEN J.Constraints on detection of autoinducer-2 (AI-2) signalling molecules usingVibrioharveyias a reporter[J]. Microbiology, 2003, 149(8): 1 953-1 956.
[23] WINANS S C,BASSLER B L. Mob psychology[J]. J Bacteriol, 2002, 184(4): 873-883.
[24] LEBEER S,DE KEERSMAECKER S C,VERHOEVEN T L. Functional analysis ofluxSin the probiotic strainLactobacillusrhamnosusGG reveals a central metabolic role important for growth and biofilm formation[J]. J Bacteriol, 2007, 189(3): 860-871.
[25] TANNOCK G W,GHAZALLY S,WALTER J,et al. Ecological behavior ofLactobacillusreuteri100-23 is affected by mutation of theluxSgene[J]. Applied and Environmental Microbiology, 2005, 71(12): 8 419-8 425.
[26] RAO R M,PASHA S,SOWDHAMINI R. Genome-wide survey and phylogeny of S-Ribosylhomocysteinase (LuxS) enzyme in bacterial genomes[J]. BMC Genomics, 2016, 17(1): 742.
[27] ALMASOUD A, HETTIARACHCHY N,RAYAPROLU S,et al. Inhibitory effects of lactic and malic organic acids on autoinducer type 2 (AI-2) quorum sensing ofEscherichiacoliO157:H7 andSalmonellaTyphimurium[J]. Lwt-Food Science and Technology, 2016, 66: 560-564.
[28] WEN Z T, BUME R A.LuxS-mediated signaling inStreptococcusmutans is involved in regulation of acid and oxidative stress tolerance and biofilm formation[J]. J Bacteriol, 2004, 186(9): 2 682-2 691.
[29] SZTAJER H,LEMME A,VILCHEZ R,et al. Autoinducer-2-regulated genes inStreptococcusmutansUA159 and global metabolic effect of theluxSmutation[J]. J Bacteriol, 2008, 190(1): 401-415.
