辣椒根际链霉菌WKFF34的分离鉴定及拮抗作用
2018-02-28韦坤逢李灿灿
韦坤逢,王 丽,李灿灿,黄 剑
(绿色农药与农业生物工程国家重点实验室培育基地/教育部绿色农药与生物工程重点实验室/贵州大学精细化工研究开发中心,贵州 贵阳 550025)
根际是微生物生活的主要活动场所之一,德国科学家Lorenz Hiltner首次提出根际微生物的概念,认为植物是否发病以及作物品质的好坏与其根际微生物的组成直接相关[1]。根际微生物被誉为植物的第二套基因组[2],在植物的生长发育过程中发挥着重要作用,根际微生物中的一些成员有益于植物的生长,而有些则企图通过与植物的保护机制相对抗从而导致植物染病,一部分甚至还威胁到人类的健康[3]。尽管目前对根际微生物的重要性已经得到广泛的认识,但是人类对数目巨大的根际微生物的了解仍然知之甚少。植物根际中放线菌分布广泛,仅次于细菌[4],放线菌作为最具吸引力的一类微生物资源是因为其能产生具有极高商业价值的抗生素和其它生物活性物质,如维生素、生物碱、植物促生物质、酶以及酶抑制剂等等[5-6]。抗生素能够有效防治多种人类致病菌和农作物的某些病害,具有无污染、无毒、无残留等优点,而大约2/3的天然抗生素是来自放线菌[7],在医药、农业等领域有广泛的应用。
目前,放线菌作为一类绿色的生物源农药来源,世界各国对放线菌的研究与资源开发极为重视。尽管过去数十年对产抗生素放线菌进行了大量的研究[8],近年放线菌中新的和有价值的生物活性物质的发现持续下降[9],然而对地球上微生物的研究,人们现在已经分离、鉴定和对其相关性质进行研究的种类也不到总数的1%~10%[10]。仍然有新的放线菌和化合物被不断挖掘[11],而且通过改善根际微生物生态环境来促进植物生长、增加植物抗逆性等方面的研究也日益成为人们研究的热点,因此,为了作物的健康生长,仍然有必要对植物根际微生物的组成及其作用进行进一步的研究,从根际放线菌中寻找农抗活性物质或利用生防菌防治植物病害仍然是国内外研究的热点,具有广阔的前景。
本研究为丰富生防放线菌资源,寻找活性优良的候选菌株,以贵州花溪辣椒传统种植地根际土壤为研究对象进行微生物拮抗活性筛选,从中分离到一株具有较强拮抗作用的根际放线菌WKFF34,通过形态、培养特征、生理生化特性、拮抗活性、16S rRNA序列分析及其系统发育等方面的研究,对该菌株进行了鉴定,为今后该放线菌菌株的研究与利用提供一定的科学依据。
1 材料与方法
1.1 供试材料
1.1.1 土壤样品采集与处理 采自贵州省贵阳市花溪区党武乡辣椒种植区露地辣椒根际土壤(海拔1 170 m),样品置无菌袋后混合,冰盒保存带回实验室4 ℃冰箱保存备用。
1.1.2 供试植物病原菌 靶标细菌为:白菜软腐病菌(Erwiniacarotorora)、柑橘溃疡病菌(Xanthomonasaxonopodispv.citri)、烟草青枯病菌(Ralstoniasolanacearum)。靶标真菌为:水稻纹枯病原菌(Thanatephoruscucumeris)、苹果炭疽病原菌(Glomerellacingulata)、油菜菌核病原菌(Sclerotiniasclerotiorum)、苹果腐烂病原菌(Cytosporamandshurica)、茄子黄萎病原菌(Verticilliumdahliae)、小麦赤霉病原菌(Gibberellazeae)、马铃薯晚疫病原菌(Phytophthorainfestans)、辣椒疫霉病原菌(Phytophthoracapsici)和番茄灰霉病原菌(Botrytiscinerea)。以上病原菌均保存于贵州大学精细化工研究开发中心生测室。
1.1.3 供试藻种 藻种铜绿微囊藻(Microcystisaeruginosa) 购自中国科学院水生生物研究所藻种保藏中心。
1.1.4 主要培养基 放线菌分离纯化培养基为高氏一号培养基。真菌检测用培养基为马铃薯葡萄糖琼脂培养基(PDA)。细菌检测用培养基为溶菌肉汤培养基(LB)。培养特征用培养基为:酵母抽提物培养基(ISP2)、燕麦琼脂培养基(ISP3)、无机盐淀粉琼脂培养基(ISP4)、甘油-天冬酰胺培养基(ISP5)、淀粉铵琼脂培养基、蔡氏培养基、葡萄糖酵母膏培养基、营养琼脂培养基等。发酵培养基:可溶性淀粉5 g,葡萄糖3 g,大豆粉5 g,蛋白胨4 g,酵母膏4 g,KNO31 g,NaCl 0.5 g,CaCO30.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,K2HPO40.5 g,蒸馏水1000 mL,pH值7.2~7.4。藻种培养基为BG11培养基。
1.2 方法
1.2.1 放线菌菌株的分离 采用平板连续稀释法。将土样自然风干10 d,充分研钵磨细过60目筛,称取研细的土壤样品5 g,加入灭菌水45 mL,并加入5颗灭菌的玻璃珠,200 r/min 28 ℃充分振荡20 min,制成10-1土壤浓度悬浮液备用。待土粒沉淀后,再用10倍稀释法进行稀释处理。吸取1 mL上清液,移入盛有9 mL灭菌水的10 mL离心管中,制成10-2土壤浓度悬浮液。依此类推,依次稀释制成10-3、10-4、10-5和10-6土壤浓度悬浮液,吸取上述10-3、10-4、10-5和10-6土壤浓度悬浮液200 μL于高氏一号培养基平板上(加50 mg/L重铬酸钾和25 mg/L奈啶酮酸作为抑制剂)进行菌种分离,用灭菌涂布棒涂布均匀。每个梯度设3个重复,28 ℃恒温培养箱倒置培养5~30 d,待菌落长出后,适时挑选不同形态的菌株,通过多次划线法纯化后转接到高氏一号斜面保存。
1.2.2 菌株发酵液的制备 将放线菌WKFF34在高氏一号琼脂培养基上28 ℃活化5 d后,接种于装有100 mL高氏一号液体培养基的250 mL锥形瓶中,180 r/min 28 ℃振荡培养4 d,再按10%的接种量于装有100 mL液体发酵培养基的250 mL锥形瓶中,180 r/min 28 ℃振荡培养7 d。然后将发酵液经4 000 r/min离心20 min,0.22 μm滤膜过滤得菌株发酵液,4 ℃保存备用。
1.2.3 菌株生物活性测定 (1)抗细菌活性测定。挑取少量供试细菌病原菌于LB液体培养基,180 r/min 28 ℃振荡培养24 h,取200 μL菌液于固体LB培养基平板上涂布均匀。再将待测的放线菌菌饼置于平板中央,使菌落一面紧贴于LB固体培养基表面,对照只接靶标菌,每个处理重复3次,置于28 ℃恒温培养箱中培养48 h,用十字交叉法测量抑菌圈的直径,测定其抑菌活性。(2)抗真菌活性测定。1)初筛采用平板对峙法进行菌株WKFF34的抑菌活性测定[12]。将培养好的供试植物病原菌菌饼(直径6 mm),倒贴接种于PDA平板的中央,距离病原菌左右各30 mm处接种生长5 d的菌株WKFF34菌饼,于28 ℃恒温培养箱倒置培养4~7 d。对照只接靶标菌,每处理设重复3次,待对照长满3/4培养皿时,观察是否有拮抗作用并测量抑菌条带的宽度。以抑菌条带的宽度作为抑菌活性强弱的标志:“+”为抑菌条带宽度0.5≤D≤5 mm,表示抑菌活性弱;“++”为抑菌条带宽度6≤D≤15 mm,表示抑菌活性较强;“+++” 为抑菌条带宽度16≤D≤35 mm,表示抑菌活性很强。2)复筛采用抑制菌丝生长速率法测定拮抗菌株发酵滤液的抑菌活性及抗菌谱[13]。将菌株WKFF34发酵滤液按1∶9的比例与融化的PDA培养基(45~50 ℃)混匀,倒平板制成带药培养基。以加入等体积的无菌发酵培养液的PDA培养基作为对照。在平板中央接种直径为6 mm的靶标菌菌饼,使带菌丝一面贴在培养基表面。每处理重复3次,置于28 ℃恒温培养箱培养4~7 d,待对照长满3/4培养皿时,用十字交叉法测量对照组和处理组菌落直径,计算抑制率。
抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径] ×100%
(1)
(3)溶藻活性测定。采用改进的双层藻平板法测定WKFF34菌株的溶藻活性[14]。将BG11固体培养基倒入培养皿中作为底层,待培养基凝固之后,将BG11半固体培养基与培养好的铜绿微囊藻按1∶1的比例混合作为上层,凝固之后,将双层藻平板在温度为28 ℃,光暗周期为L∶D=12 h∶12 h,光照强度约为2 000 lx的光照培养箱内培养4 d。再将培养好的放线菌WKFF34的菌饼反贴双层藻平板中央,同样条件下培养3 d,用十字交叉法测量溶藻圈的直径,观察其溶藻活性。对照为不接种放线菌的双层藻平板。(4)药物敏感性试验。采用抗生素药敏纸片,在高氏一号固体培养基上通过平板扩散法进行。将菌株于高氏一号液体培养基28 ℃摇床培养72 h后,取200 μL均匀涂布于平板上,贴上药敏纸片,设3个重复,28~30 ℃培养48 h后测量抑菌圈直径,计算平均值,根据美国临床实验室标准化协会(CLSI)的标准判断其药敏性。
1.2.4 菌株特征和分类鉴定 (1)菌株形态特征观察。采用高氏一号培养基于28 ℃下进行平板插片法培养[15],培养7 d后,用光学显微镜及扫描电镜观察气生菌丝、基内菌丝及孢子丝的形态特征。(2)菌株的培养特征观察。参照国际链霉菌计划中有关放线菌的培养特征描述所采用的标准培养基进行培养特征的测定[16]。所用培养基为ISP2、ISP3、ISP4、ISP5等,于28 ℃培养14 d后,观察和记录菌株的培养特征,包括生长情况、气生菌丝、基内菌丝和可溶性色素状况等。(3)菌株生理生化特性。参照Shirling方法[16]和中国科学院微生物研究所放线菌分类组《链霉菌鉴定手册》进行[17]。(4)菌株系统发育分析。分子生物学鉴定采用16S rRNA序列分析方法[18]。用Chelex-100改进法提取菌株基因组DNA[19],用细菌16S rRNA通用扩增引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R(5′-TAC GGC TAC CTT GTT ACG ACT-3′)进行PCR扩增。PCR反应体系为总体积50 μL(包含10×buffer 5.0 μL,dNTP 4.0 μL,引物27F 1.0 μL,引物1492R 1.0 μL,Taq酶0.3 μL,DNA模版1.0 μL,双蒸水37.7 μL)。PCR反应条件为94 ℃预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸1 min,30个循环,循环结束后72 ℃延伸10 min,最后4 ℃保存。PCR反应结束后8 g/L琼脂糖凝胶电泳检测PCR产物。PCR产物经电泳检查合格后进行测序。
将测得的16S rRNA序列在NCBI中用Blast软件与GenBank核酸序列数据库中已知的相关种属进行序列同源性分析,选取同源性比较高的相关模式菌株,采用Clustal X1.83软件进行多序列比对,用MAGA 5.0软件中Kimura 2-Parameter Distance模型进行多序列匹配排列,采用邻接法(Neighbor-joining Method)构建系统进化树,以确定该菌株的系统发育地位,其中Bootstrap检验的重复次数为1 000次。
2 结果与分析
2.1 拮抗菌株WKFF34分离及其对植物致病菌的抑菌活性
通过连续稀释平板法,从采集的健康辣椒根际土壤中,依据菌落形态、色泽、生长速度等表观特征的差异,对辣椒根际放线菌进行分离和纯化,共得到87株放线菌,通过参试细菌和真菌对分离的放线菌菌株进行了拮抗活性的初筛和复筛,得到一株拮抗活性强的放线菌菌株WKFF34。通过平板涂布法,发现菌株WKFF34对柑橘溃疡病菌和烟草青枯病菌有一定抑制作用,抑菌圈直径分别为16 mm和8 mm,对白菜软腐病菌则没有抑菌活性,结果见表1。

表1 菌株WKFF34对3种植物病原细菌的抑菌活性
“-”表示没有抑菌圈。
“-”means no inhibition zone.
通过平板对峙法,进行了菌株WKFF34对6种植物病原菌的抑菌活性初筛,结果见表2。研究发现,菌株WKFF34对6种植物病原菌均有不同程度的抑制作用,其中对油菜菌核病菌和茄子黄萎病菌的抑制效果显著,其抑菌条带分别为30 mm和24 mm。

表2 放线菌WKFF34菌株对6种植物病原菌的抑菌作用初筛
2.2 菌株WKFF34发酵液对植物病原菌的拮抗活性复筛及抗菌谱
采用菌丝生长速率法进行了菌株发酵滤液对9种植物病原菌的拮抗活性复筛。结果发现菌株WKFF34的发酵液具有广谱的抑菌活性,对多种供试植物病原菌都表现出不同程度的抑制活性(表3)。菌株WKFF34的抑菌谱较广,相比之下对真菌类的油菜菌核病原菌的抑制活性最高,抑制率为80.43%,对苹果炭疽病原菌、水稻纹枯病原菌、茄子黄萎病原菌也具有较强的抑菌活性,抑制率均分别为79.48%、70.00%和63.63%。对小麦赤霉病原菌的抑制效果较差,为16.35%;对卵菌类的马铃薯晚疫病菌和辣椒疫霉病菌具有一定的抑制作用,其抑制率分别为46.15%和49.07%。说明该菌株对不同属的多种植物病原菌表现出较好的抑菌效果。

表3 WKFF34菌株发酵液对9种植物病原菌菌丝生长的抑制作用
数据均为3次重复平均值。同列数据后不同小写字母表示在P<0.05水平显著差异(Duncan氏新复极差法)。
The data were the average of three replicates.The different small letters after the same column figures indicated significant difference at the level ofP<0.05 by Duncan’s new multiple range test.
2.3 抗生素药敏性测定结果
采用平板扩散法,对菌株WKFF34进行了11类,共30种抗生素的药敏试验,结果见表4。从表4可以看出,菌株WKFF34对7类12种抗生素如四环素、复方新诺明、万古霉素、氯霉素、米诺环素、麦迪霉素、强力霉素、多粘菌素、新霉素、庆大霉素、阿米卡星和氨苄西林敏感,对其余18种抗生素如呋喃唑酮、氯氟沙星、克林霉素、诺氟沙星、头孢氨苄、头孢唑啉、头孢拉定、头孢呋辛、头孢他啶、头孢曲松、头孢哌酮、环丙沙星、红霉素、氧氟沙星、青霉素、苯唑西林、羧苄西林和哌拉西林耐药。

表4 菌株WKFF34的抗生素药敏测定
“-”为没有抑菌圈,S为敏感,R为耐药,根据CLSI标准判定。
“-”means no inhibitory zone,“S” means susceptible and “R” means resistant(R) according to the cut-off values by CLSI standards interpretation.
2.4 菌株WKFF34的溶藻活性
通过双层藻平板法测定了菌株对铜绿微囊藻的溶藻作用。结果发现,菌株WKFF34对铜绿微囊藻具有明显的溶藻圈,溶藻圈直径为22 mm(图1)。说明菌株WKFF34菌株对铜绿微囊藻具有溶藻活性。

图1 菌株WKFF34对铜绿微囊藻的溶藻圈Fig.1 The algae-lysing zoom of strain WKFF34 to Microcystis aeruginosaon double algae plate
2.5 菌株特征及多相分类鉴定
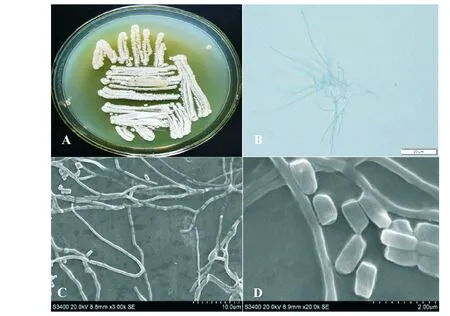
A:菌落,B:菌丝(光镜,400×),C:孢子链(扫描电镜,3K×),D:孢子(扫描电镜,20K×)A:Colony,B:Mycelium(OM,400× ),C:Spore chains(SEM,3K×),D:Spores(SEM,20K×)图2 菌株WKFF34的菌落、菌丝和孢子的形态特征Fig.2 Morphology of mycelium and spores of strain WKFF34
2.5.1 形态与培养特征 菌株WFKK34在高氏一号培养基上生长良好,在培养基上刚长出来时呈白色,随培养时间延长,孢子堆由薄变厚,菌落颜色由白色变为浅黄色,见图2(A)。在光学显微镜(OM)下观察发现,菌株WKFF34气生菌丝丰富无隔阂,基内菌丝不断裂,分枝多,不断裂,见图2(B)。通过扫描电镜(SEM)对菌株WKFF34的孢子链和孢子形态进行观察,发现菌株WKFF34的孢子链直且长,偶有波曲,孢子呈棒状、光滑、不运动,孢子顶端及侧面略有凹陷,且孢子长为7~13 μm,宽在5~7 μm,结果见图2(C、D)。
对菌株WKFF34在不同培养基上的培养特征进行了观察研究,发现其在大多数培养基上都能正常生长,结果见表5。菌株WKFF34除在ISP4、察氏培养基、葡萄糖酵母培养基上生长情况一般外,其他培养基的生长情况均良好;菌丝白色至黄色,在高氏一号,马铃薯葡萄糖琼脂,淀粉铵琼脂,察氏培养基上不产生可溶性色素。
2.5.2 生理生化特征 对菌株WKFF34的部分生理生化特征进行了测定,结果见表6。结果发现,菌株WKFF34能利用多种物质为碳源、氮源;淀粉水解,明胶液化,硝酸盐还原反应呈阳性;牛奶凝固和胨化,纤维素水解反应,H2S产生呈阴性。
2.5.3 基于16S rRNA基因序列的系统发育分析 放线菌WKFF34的16S rRNA PCR产物经过测序后得到的基因核苷酸序列为1 412 bp,GenBank的序列注册号为KY630730。用Blast软件从GenBank等数据库中进行序列相似性搜索,发现WKFF34菌株与链霉菌属菌株高度相关,WKFF34菌株与链霉菌属菌株的同源性为99%~100%,说明该菌株属于链霉菌属成员。用邻接法(NJ)构建的系统进化树见图3。菌株WKFF34在系统进化树上与多株链霉菌属菌株的遗传距离很小,与蓝微褐链霉菌模式菌株S.cyaneofuscatusJCM4364(AY999770)相似性为99.64%、S.luridiscabieiS63(AF361784,相似性为99.49%)、S.californicusNBRC3368(AB184755,相似性为99.35%)、S.albovinaceusNBRC12739(AB249958,相似性为98.92%) 聚在同一分支上,序列相似性极高。综合该菌株的形态学特征、培养特征、生理生化特征和16S rRNA基因序列的系统发育分析,并与蓝微褐链霉菌模式菌株StreptomycescyaneofuscatusJCM 4364的特征进行比较,结果发现二者极为相似,鉴定菌株WKFF34属于链霉菌属Streptomyces成员,为有效发表种蓝微褐链霉菌Streptomycescyaneofuscatus的一个菌株,命名为StreptomycescyaneofuscatusWKFF34。
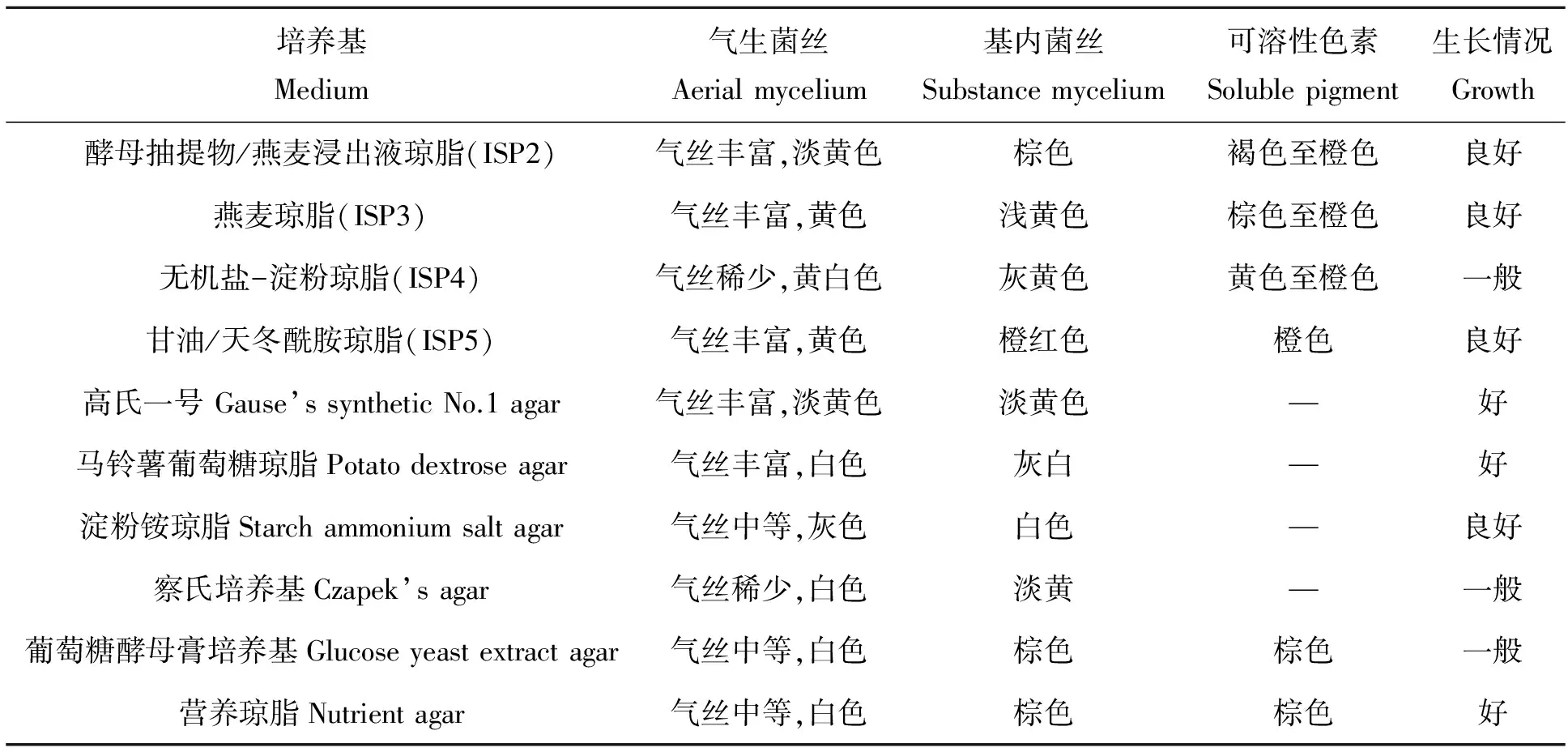
表5 菌株WKFF34的培养特征
“—”为不产生可溶性色素。
“—”means no soluble pigment.
“+”表示阳性,“-”表示阴性。
“+” tested Positive,“-” tested Negative.
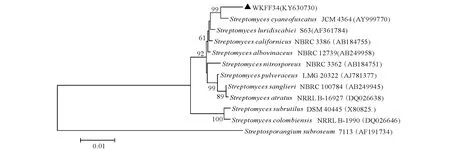
分支处的数值为Bootstrap 法重复1 000次评估得到各节点支持率;标尺0.01为进化距离。Numbers at nodes indicating values for each node out of 1 000 bootstrap replications;Scale 0.01 meaning evolutionary distance.图3 基于16S rRNA基因序列构建的菌株WKFF34和相关链霉菌属典型菌株的邻接法系统发育树Fig.3 Neighbour-joining phylogenetic tree based on 16S rRNA gene sequences of strain WKFF34 and related Streptomyces strains
3 结论与讨论
放线菌作为重要的微生物资源,受到人们的关注已数十年,大量的研究发现放线菌能产生多种具有生物活性的次级代谢产物,如抗生素、抗肿瘤物质、抗菌活性物质、免疫抑制剂、植物生长促生活性物质和一些酶类等等,广泛应用医学、农业等领域。尽管近年来新型抗生素的筛选难度越来越大,但研究发现来自不同生境的可培养放线菌仍然是目前微生物源生物活性物质的最重要资源,一种微生物可以产生大量的次生代谢物,最高可达50种化合物[20]。人类对新型高生物活性抗生素等生物活性物质的需求,从各种环境中对产抗生素和多种生物活性物质的新放线菌资源的筛选依然具有很大的吸引力和必要性。
本研究发现分离自辣椒根际土壤的菌株WKFF34具有典型的链霉菌属特点,16S rRNA序列分析菌株WKFF34与蓝微褐链霉菌模式菌株StreptomycescyaneofuscatusJCM4363(AY999770)具有最大的相似性,达99.64%,在系统发育树上处于同一分枝,亲缘关系最近。基于16S rRNA序列分析和系统发育分析,通过比较两者之间的形态特征和培养特征、以及生理生化特征测定结果,将菌株WKFF34鉴定蓝微褐链霉菌StreptomycescyaneofuscatusWKFF34(序列注册号为KY630730)。
关于蓝微褐链霉菌Streptomycescyaneofuscatus的研究主要集中在医学与小分子物质方面[21-22],如能产具有抗肿瘤活性的色霉素[23-25]、蒽环霉素类[26-28]等不同结构类型的抗生素,抗菌活性方面的研究也仅是针对部分人体致病菌的抗菌作用,如黄苛从银杏根际土壤中分离到S.cyaneofuscatusJSM 20.1菌株的发酵产物对革兰氏阴性菌(产气杆菌、变形杆菌)、阳性菌(枯草芽孢杆菌、藤黄八叠球菌和金黄色葡萄球菌)及真菌(白色念珠菌)有较好抑制作用[29],刘晓瑜等[30]从多种药用植物中分离到的5株内生链霉菌菌株(GS3、GS10、MD1、MD2和GXDJ6),经鉴定均为S.cyaneofuscatus菌株,对耐甲氧金黄色葡萄球菌(MRSA)具有拮抗作用。而针对该菌株涉及到的农用拮抗活性报道极少,仅见Xue 等[31]从青海油菜的根际放线菌中分离到的一株S.cyaneofuscatusZY-153菌株,发现对棉花黄萎病具有拮抗作用,同时在种子包衣和土壤接种试验中表现出一定的生防作用,其它关于蓝微褐链霉菌的农用拮抗活性未见报道。因此本研究通过对菌株WKFF34在农用生物活性的测定,发现该菌株具有与前人研究不一样的更广谱的抗菌活性,首次发现菌株WKFF34对细菌性的柑橘溃疡病菌、烟草青枯病菌具有抑菌活性,但对白菜软腐病菌无活性;抗真菌活性方面,发现放线菌WKFF34的发酵液对多种供试植物病原菌都表现出不同程度的抑制活性,具有广谱的抑菌活性,其中对油菜菌核病原菌的抑制活性最高,抑制率为80.43%,对苹果炭疽病原菌、水稻纹枯病原菌、茄子黄萎病原菌也具有较强的抑菌活性,抑制率均分别为79.48%、70.00%和63.63%,对苹果腐烂病原菌以及番茄灰霉病原菌也有一定的抑制作用;值得注意的是对卵菌类的马铃薯晚疫病菌和辣椒疫霉病菌也具有一定的抑制作用,抑制率分别为46.15%和49.07%;但对小麦赤霉病原菌的抑制效果较差,抑制率仅为16.35%。研究结果显示蓝微褐链霉菌WKFF34菌株的发酵液对多种植物病原菌表现出较好的抑菌效果,显示出该菌株在农用拮抗活性方面具有良好的开发利用价值。本研究还首次测定了菌株WKFF34对11类30种抗生素的敏感性试验,结果发现该菌株对青霉素类中的氨苄西林,大环内酯类的麦迪霉素,多肽类的万古霉素与多粘菌素,磺胺类的复方新诺明,酰胺类的氯霉素,氨基糖苷类的阿卡米星、庆大霉素和新霉素,四环素类的四环素、米诺环素和强力霉素等7类12种抗生素保持敏感性。
令人感兴趣的是,菌株WKFF34对导致淡水发生蓝藻水华的铜绿微囊藻也具有明显的溶藻活性。前人研究发现对铜绿微囊藻等蓝藻具有溶藻活性的细菌较多[32],具有溶藻作用的放线菌报道相对较少[33]。本研究首次发现蓝微褐链霉菌对铜绿微囊藻具有溶藻活性,对进一步拓宽了放线菌对水华污染进行生物防治研究具有重要意义,为放线菌应用于蓝藻导致的淡水环境问题的生物防治提供了一种潜在的微生物资源。
由于前人研究发现蓝微褐链霉菌具有优良的产生多种不同化学结构的生物活性物质能力,而目前该菌株应用于防治植物病害的研究极少,开展对菌株WKFF34的农用生物活性研究可以为其在生产实践中的应用奠定基础,有关该菌株对植物病害的防治实验、农用抗菌物质的分离纯化及其防病抑菌机理,包括对铜绿微囊藻的溶藻作用物质分离与溶藻机理等均有待进一步研究。
[1] Hartmann A,Rothballer M,Schmid M.Lorenz Hiltner,a pioneer in rhizosphere microbial ecology and soil bacteriology research[J].Plant and Soil,2008,312(1):7-14.
[2] 艾超,孙静文,王秀斌,等.植物根际沉积与土壤微生物关系研究进展[J].植物营养与肥料学报,2015,21(5):1343-1351.
Ai C,Sun J W,Wang X B,et al.Advances in the study of the relationship between plant rhizodeposition and soil microorganism[J].Journal of Plant Nutrition and Fertilizer,2015,21(5):1343-1351.
[3] Mendes R,Garbeva P,Raaijmakers J M.The rhizosphere microbiome:significance of plant beneficial,plant pathogenic,and human pathogenic microorganisms[J].FEMS Microbiology Reviews,2013,37(5):634-663.
[4] Pragya R,Yasmin A,Anshula J.An insight into agricultural properties of actinomycetes[J].International Journal of Research in BioSciences,2012,1(1):7-12.
[5] Omura,S.Philosophy of new drug discovery[J].Microbiological Reviews,1986,50(3):259-279.
[6] El-Tarabily K A,Hardy G E S J,Sivasithamparam K.Performance of three endophytic actinomycetes in relation to plant growth promotion and biological control ofPythiumaphanidermatum,a pathogen of cucumber under commercial field production conditions in the United Arab Emirates[J].European Journal of Plant Pathology,2010,128(4):527-539.
[7] Okami Y and Hotta K.Search and discovery of new antibiotics[M]//Goodfellow M,Williams S T,Mordarski M.Actinomycetes in Biotechnology.New York,USA:Academic Press,1988:33-67.
[8] Tanaka Y,Omura S.Agroactive compounds of microbial origin[J].Annual Reviews in Microbiology,1993,47(1):57-87.
[9] Nolan R D,Cross T.Isolation and screening of actinomycetes[M].//Goodfellow M,Williams S T,Mordarski M.Actinomycetes in Biotechnology.New York,USA:Academic Press,1988:1-32.
[10] Roger P A,Heong K L,Teng P S,et al.The biodiversity of microorganisms and invertebrates:its role in sustainable agriculture[C]//Proceedings of the 1st Workshop on the Ecological Foundations of Sustainable Agriculture,(WEFSA'91),Hawksworth,DL.1991:117-136.
[11] Wu X,Chen W F,Qian C D,et al.Isolation and identification of newly isolated antagonisticStreptomycessp.strain AP19-2 producing chromomycins[J].Journal of Microbiology-Seoul,2007,45(6):499-504.
[12] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:245-246.
Fang Z D.Disease research methods[M].3rd ed.Beijing:China Agriculture Press,1998:245-246.
[13] 陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1991:1-270.
Chen N C.Technology of Pesticides Bioassay[M].Beijing:Beijing Agricultural University Press,1991:1-270.
[14] 喻融,周瑞,刘芳遐,等.一种筛选溶藻放线菌的新方法[J].华中师范大学研究生学报,2005,12(4):142-144.
Yu R,Zhou R,Liu F X,et al.A new method of isolation of algicidal actinomycete[J].Huazhong Normal University Journal of Postgtaduates,2005,12(4):142-144.
[15] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:69-70.
Ruan J S,Huang Y.Rapid identification and systematic classification of actinomycetes[M].Beijing:Science Press,2011:69-70.
[16] Shirling E B,Gottlieb D.Methods for characterization of Streptomyces species 1[J].International Journal of Systematic Bacteriology,1966,16(3):313-340.
[17] 中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:119-194.
The group of bacteria classification of the institute of microbiology.Chinese Academy of Science.Common methods of determinative bacteriology[M].Beijing:Science Press,1975:119-194.
[18] Magray M S U D,Kumar A,Rawat A K,et al.Identification ofEscherichiacolithrough analysis of 16S rRNA and 16S-23S rRNA internal transcribed spacer region sequences[J].Bioinformation,2011,6(10):370-371.
[19] 周双清,黄小龙,黄东益,等.Chelex-100 快速提取放线菌 DNA作为PCR扩增模板[J].生物技术通报,2010,2:124-125.
Zhou S Q,Huang X L,Huang D Y,et al.A rapid method for extracting DNA from actinomycetes by Chelex-100[J].Biotechnology Bulletin,2010,2:124-125.
[20] Demain A L.Importance of microbial natural products and the need to revitalize their discovery[J].Journal of industrial microbiology & biotechnology,2014,41:185-201.
[21] Gräfe U,Reinhardt G,Schade W,et al.Interspecific inducers of cytodifferentiation and anthracycline biosynthesis fromStreptomycesbikinensisandS.cyaneofuscatus[J].Biotechnology Letters,1983,5(9):591-596.
[22] Nihira T,Shimizu Y,Kim HS,et al.Structure-activity relationships of virginiae butanolide C,an inducer of virginiamycin production inStreptomycesvirginiae[J].J Antibiot,1988,41(12):1828-1937.
[23] Skarbek J D,Brady L R.Streptomycescavourensissp.nov.(nom.rev.) andStreptomycescavourensissubsp.washingtonensissubsp.nov.,a chromomycin-producing subspecies[J].International Journal of Systematic and Evolutionary Microbiology,1978,28(1):45-53.
[24] Wu X,Wen Y,Qian C,et al.Taxonomic study of a chromomycin-producing strain and reclassification ofStreptomycescavourensissubsp.washingtonensisas a later synonym ofStreptomycesgriseus[J].International Journal of Systematic and Evolutionary Microbiology,2008,58(12):2783-2787.
[25] Rong X,Huang Y.Taxonomic evaluation of theStreptomycesgriseusclade using multilocus sequence analysis and DNA-DNA hybridization,with proposal to combine 29 species and three subspecies as 11 genomic species[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(3):696-703.
[27] Parrot D,Antony-Babu S,Intertaglia L,et al.Littoral lichens as a novel source of potentially bioactive Actinobacteria[J].Scienctific Reports,2015,5:srep15839.
[28] Parrot D,Legrave N,Intertaglia L,et al.Cyaneodimycin,a bioactive compound isolated from the culture ofStreptomycescyaneofuscatusassociated withLichinaconfinis[J].European Journal of Organic Chemistry,2016,2016(23):3977-3982.
[29] 黄苛,刘祝祥,陈奇辉,等.具抗菌活性放线菌菌株JSM20.1的分离和鉴定[J].微生物学杂志,2010,30(1):27-31.
Huang K,Liu Z X,Chen Q H,et al.Isolation and identification of actinomycete JSM 20.1 exhibiting antimicrobial activity[J].Journal of Microbiology,2010,30(1):27-31.
[30] Liu X Y,Ma Y C.Screening and identification of antagonistic endophytes against drug-resistant Bacteria from Medicinal Plants[J].Biotechnology Bulletin,2015,31(3):154-160.
[31] 刘晓瑜,马玉超.抗耐药细菌药用植物内生菌的筛选与鉴定[J].生物技术通报,2015,31(3):154-160.
Xue L,Xue Q,Chen Q,et al.Isolation and evaluation of rhizosphere actinomycetes with potential application for biocontrol of Verticillium wilt of cotton[J].Crop Protection,2013,43:231-240.
[32] Yang L,Maeda H,Yoshikawa T,et al.Algicidal effect of bacterial isolates ofPedobactersp.against cyanobacteriumMicrocystisaeruginosa[J].Water Science and Engineering,2012,5(4):375-382.
[33] Choi H J,Kim B H,Kim J D,et al.Streptomycesneyagawaensisas a control for the hazardous biomass ofMicrocystisaeruginosa(Cyanobacteria) in eutrophic freshwaters[J].Biological Control,2005,33(3):335-343.
