废旧磷酸铁锂正极粉回收制备电池级碳酸锂工艺研究
2018-02-28周有池文小强刘雯雯郭春平
周有池,文小强,刘雯雯,郭春平
(赣州有色冶金研究所,江西 赣州 341000)
近年来,随着新能源汽车产销量的猛增,动力电池退役高峰将至[1-2],据报道,2016年动力电池报废量为2-4万吨,至2018年动力电池报废量将达到17.25万吨。Dewulf[3]分析结果认为回收锂离子电池可节约51.3%的自然资源,包括减少消耗45.3%的矿石和57.2%的化石能源。而磷酸铁锂是目前使用量最多的一种锂离子电池材料,因此回收磷酸铁锂具有一定的意义[5-7]。本文采用部分酸在酸+氧化剂的体系下对磷酸铁锂废料选择性回收锂,并获得电池级碳酸锂,实现锂资源回收利用。
1 实验
1.1 原料及试剂
实验所用原料为江西赣州某公司回收的废旧磷酸铁锂正极材料粉,其成分见表1;浓HCl(分析纯);固体 NaOH(工业级);H2O2(工业级)、NaClO(工业级)、NaClO3(工业级)、Na2CO3(工业级);固体络合剂EDTA(分析纯)。

表1 废旧磷酸铁锂正极材料粉成分(质量分数%)
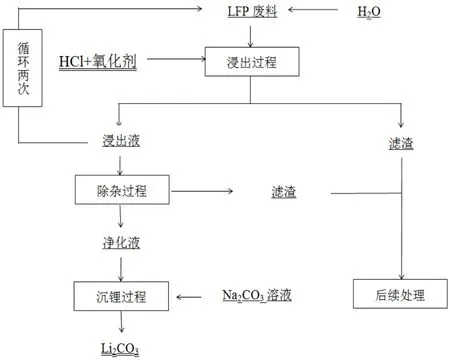
图1 工艺流程图

表2 氧化剂对LFP废料回收锂试验结果
实验仪器:JJ型精密增力电动搅拌器、HH—S4恒温水浴锅、SHZ—Ⅲ循环水式真空泵、LFAD—2蠕动泵驱动器、101A—2型电热鼓风恒温干燥器。
1.2 实验内容
实验采用HCl和氧化剂体系对废旧磷酸铁锂正极材料粉(LFP废料)进行浸出回收锂,实验主要分为锂浸出、除杂、沉锂三个过程。本方案回收工艺总流程图如图1所示。
Li的平均含量为3.75%,采用HCl+H2O2对LFP废料进行浸Li,将浸出液逆流浸出两次,浸出液除杂后的净化液用精制碳酸钠溶液沉锂,HCl+H2O2浸出的滤渣与除杂过滤的滤渣经处理可得到铁盐副产物。主要考察浸出过程中氧化剂选择、氧化剂用量、酸用量、反应时间、液固比对锂浸出率的影响。
2 实验结果与讨论
2.1 浸出过程
2.1.1 氧化剂的选择
酸浸出LFP废料过程中,溶液中铁和锂主要是Fe2+和Li+形成存在。经实验探索,本实验采用部分酸溶,为了提高Li的收率以及后期铁的回收,实验在酸浸过程中加入某氧化剂,氧化剂的选择有H2O2、NaClO3、O2和NaClO。
实验选用某电池厂回收的LFP废料为原料,其主要成分见表3-1。称取180g该LFP废料,加入一定水量制浆,使LFP废料与水充分混合,并均匀地分散在水相中。加入一定量的HCl,加入不同种类的氧化剂,控制一定的液固比,中速搅拌1.5h,磷酸铁锂中的锂基本转化成可溶性锂盐,滤渣经清水洗涤一至两遍,过滤分析滤液总锂量和滤渣的锂含量,并计算其浸出率,结果如表2所示。
由表可知,通入O2的效果远不如其他三种氧化剂,可能是O2的氧化性小于其他三种氧化剂的氧化性,需要的反应时间更长。加入NaClO3,虽然Li的浸出率更高,但溶液中的Fe3+溶出率也随之增加,同时后期沉锂时需要一定的Li浓度,浸出液需进行逆流浸出,加入NaClO3和NaClO氧化剂后,逆流浸出过程加酸时,氧化剂与酸会产生Cl2,大大增加了酸量和氧化剂,恶化了生产环境。因此,本实验氧化剂选择为H2O2。
2.1.2 氧化剂用量
LFP废料在低酸量下与氧化剂(H2O2)反应,H2O2用量过小,不足以将锂大部分浸出,使得锂浸出率降低;H2O2用量过大,增加回收成本,因此需对氧化剂用量进行严格控制。
实验称取180gLFP废料,选择H2O2作为氧化剂,控制H2O2的加量(0倍、0.6倍、0.8倍、1.0倍、1.2倍),加入一定量的HCl在相同的液固比条件下中速搅拌,滤渣经清水洗涤一至两遍,过滤分析不同氧化剂加量的滤液总锂量和滤渣的锂含量,并计算其浸出率,结果如图2所示。

图2 氧化剂用量对LFP废料中锂浸出率的影响

图3 酸耗量对LFP废料中锂浸出率的影响
由图可知,随着氧化剂用量增加,Li浸出率先升后基本不变。当氧化剂用量为0时,锂的浸出率只有65%左右,加入氧化剂后,Li的浸出率明显升高。氧化剂加入的主要目的是使得LFP废料中的Fe在此酸性条件下,不溶于浸出液中,而选择性浸出锂;不加氧化剂时,LFP废料与酸反应时,大部分的铁先溶出来,消耗大量的H+,若想回收Li,则需加入大量的酸进行全溶。故实验选取氧化剂用量为1.0倍。
2.1.3 酸耗量
实验称取180gLFP废料,加入1.0倍的H2O2作为氧化剂,控制不同加量的HCl(0.6倍、0.8倍、1.0倍、1.2倍、1.5倍、2.0倍),在相同的液固比条件下中速搅拌,滤渣经清水洗涤一至两遍,过滤分析不同酸耗量的滤液总锂量和滤渣的锂含量,并计算其浸出率,结果如图3所示。

图4 液固比对LFP废料中锂浸出率的影响

图5 反应时间对LFP废料中锂浸出率的影响
从图3可知,其他条件相同时,浸出率随着酸量的增加而升高,主要是由于浸出过程中H+的浓度不断增大,Li不断浸出;当酸用量小于1.0倍时,Li的浸出速度更快,主要是刚开始浸出时,液相中Li+浓度低,Li由固相向液相的扩散浓度梯度较大,浸出速度较快;当酸用量达到1.5倍时,继续增大酸用量时,Li的浸出率几乎无明显变化。但随着酸量的持续增大时,浸出液中的Fe3+浓度不断升高,回调pH值时显然需耗用大量的碱,且除铁过程中必然损耗部分锂。因此,考虑后续工序及成本,本实验的酸用量选取1.2倍较为合适。
2.1.4 液固比
实验称取180gLFP废料,选择H2O2作为氧化剂,加入1.2倍的HCl和1.0倍的H2O2(以原料的摩尔比计算)。在不同的液固比条件下中速搅拌1.5h,滤渣经清水洗涤一至两遍,过滤分析不同液固比的滤液总锂量和滤渣的锂含量,并计算其浸出率,结果见图4。
液固比对LFP废料中锂的浸出率的影响是先增大后几乎不变。主要原因是该反应体系是一种液体与一种固体反应生成另一种液体和另一种固体,液固比较小时,固体生成物不可避免会包裹部分固体反应物,使得该部分固体反应难以与反应液相接触充分,转化反应不充分,降低了Li的浸出率;其次液固比较小时,各离子浓度高,固液分离后渣中残存液相中所含锂也相应增加,洗涤时需大量的水方可洗脱可溶锂,而实验中采用的是一至二次洗涤,使得渣中含锂量偏高;再次,高浓度的离子浓度存在一定的同离子效应,致使锂溶解部分相对减弱,也在一定程度上削弱了Li的浸出率。当液固比达到一定数值时,上述因素影响逐渐减弱,在图4上可看出,当液固比大于5时,转化率几乎不再有明显变化,呈水平状。考虑Li浓度,本实验选取液固比为4∶1。
2.1.5 反应时间
实验称取180gLFP废料,选择H2O2作为氧化剂,加入1.2倍的HCl和1.0倍的H2O2(以摩尔比计算)。在4∶1的液固比条件下中速搅拌,各实验反映某一设定的时长,滤渣经清水洗涤一至两遍,过滤分析不同浸出时间的滤液总锂量和滤渣的锂含量,并计算其浸出率,结果如图5所示。

表3 酸浸液各成分含量
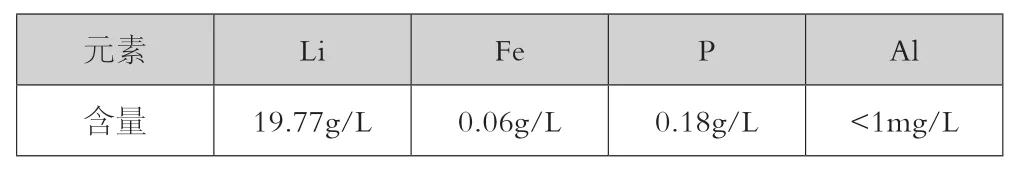
表4 初步净化液各成分含量

表5 初步净化液各成分含量

表6 碳酸锂产品质量与各标准碳酸锂产品质量的比较(%)

表7 Li2CO3产品纯度及收率
浸出时间对锂的浸出率的影响先增大后减小。主要原因是该反应体系是固液反应,在酸性条件下,其反应速率主要取决于H+及氧化化剂,初始时两者浓度都相对较高,所以浸出速率也快,随着浸出时间的推进,H+及氧化化剂浓度降低,浸出速率随之缓慢。故浸出前期浸出率上升较快,至一定时间时,浸出接近平衡,随着时间继续增加,Fe3+会发生转变,致使滤渣过滤效果不佳,夹带的滤液更多,致使锂的损失更大。故本实验选取浸出时间为1.5h。
2.2 除杂过程
在上述的工艺条件下获得的酸浸液各成分见表3,由表可知浸出液中还存在少量的Fe、P等杂质。为保证后续产品质量,浸出液进行除杂处理。
实验量取500 ml浸出液,加NaOH调pH值至8,除杂温度80℃,除杂时间为30min。除杂后的净化液成分见表4。
由于Fe在pH=8时并不能完全沉淀去除,因此继续在80℃的温度下调节pH值至12。过滤后的二次净化液各成分见表5。
收集滤渣烘干称重并分析锂含量,净化过程中的滤渣回收至酸浸渣中,作为后续磷酸铁制备的原料。经计算净化过程中锂损失率为3.75%。为保证后续碳酸锂产品的质量,在二次净化液中加入EDTA搅拌10min,以备沉锂工序使用。
2.3 沉锂过程
除杂后液与Na2CO3发生的沉锂过程是吸热反应[8],且Li2CO3的溶解度随着温度升高而降低,故温度升高有利于沉锂反应的进行。锂的浸出液经两次逆流浸出,锂液浓度可达24g/L。实验将二次净化液缓慢加入到配置好的精制碳酸钠溶液中进行沉锂,沉锂反应温度95℃,锂液浓度24g/L,沉淀剂碳酸钠添加量为理论值的1.0倍,反应时间40min。反应结束后,过滤,滤饼采用纯水洗涤3次,滤液回收获得磷酸锂,获得的Li2CO3产品,其主含量大于99.6%,锂的一次直收率为85%,锂的总回收率达到90%。实验结果见表6。
由表6可知,该工艺制备的碳酸锂产品的各项指标达到电池级碳酸锂的要求。
表7列出了制得的Li2CO3产品的纯度、收率和综合回收率情况。其中的收率指碳酸锂与磷酸锂之和。
由表7可知,生产所得的Li2CO3纯度均大于99.6%,一次沉锂率达85%以上,锂的总收率超过90.2%。
3 结论
(1)采用部分酸和氧化剂进行选择性浸出提锂,避免了传统酸全溶提锂大量耗酸耗碱问题。
(2)酸溶较优工艺条件:氧化剂为H2O2,氧化剂的量为1.0倍,酸耗量为1.2倍,液固比为4∶1,反应时间为1.5h。
(3)本工艺锂液制备碳酸锂,锂液浓度经两次逆流浸出可达到沉锂需求,避免了传统的蒸发浓缩提高锂液浓度,获得的Li2CO3产品主含量均大于99.6%,一次沉锂率达85%以上,锂的总收率超过90.2%。
