重症患者不同负荷剂量替考拉宁早期谷浓度的监测
2018-02-28朱章华罗雪梅
王 妍,朱章华,顾 勤,梁 培,罗雪梅
(南京大学医学院附属南京鼓楼医院,江苏 南京 210008)
替考拉宁是一种糖肽类抗生素,是有效治疗耐甲氧西林阳性球菌感染的药物之一。由于替考拉宁的蛋白结合率高达90%,半衰期长达50 h,因此,需要较大的负荷剂量才能快速达到稳定的血药浓度而发挥作用[1-2]。文献[3-6]报道,严重感染者的替考拉宁血清谷浓度(Cmin)>10 mg/L时才能发挥积极的抗菌作用,治疗感染性心内膜炎、骨关节感染时甚至要求浓度达到20 mg/L。目前研究[7]显示,增加起始负荷剂量可以较快的达到有效血药浓度。然而,危重患者通常合并器官功能不全,如急性肾损伤、感染性休克、低蛋白血症等,替考拉宁的药物分布、代谢势必发生变化。如何调整不同肾功能水平重症感染患者替考拉宁药物剂量是临床工作中亟待解决的问题。因此,本研究对不同肌酐清除率(Ccr)水平的重症感染患者分别给予两种负荷剂量的替考拉宁抗感染治疗,检测其治疗3 d后Cmin及目标Cmin达标情况,旨在为不同肾功能水平的患者调整适合的替考拉宁剂量提供实验室依据。
1对象与方法
1.1 研究对象 选择2016年2月1日—2017年2月28日本院重症医学科收治的疑似或证实多重耐药革兰阳性(G+)菌感染并选用替考拉宁抗感染治疗的重症感染患者,其中2016年2—6月收治的患者给予标准剂量替考拉宁抗感染治疗,列为标准剂量组(GSD);2016年7月—2017年2月收治的患者给予高剂量替考拉宁抗感染治疗,纳入高剂量组(GHD)。再根据患者入组第1天的Ccr水平(以≥50 mL/min为正常肌酐清除率,<50 mL/min为低肌酐清除率)各分为2个亚组,即标准剂量正常肌酐清除率组(GSD1组)、标准剂量低肌酐清除率组(GSD2组)、高剂量正常肌酐清除率组(GHD1组)、高剂量低肌酐清除率组(GHD2组)。
1.2 药物及给药方案
1.2.1 药品 替考拉宁,商品名加立信,浙江医药股份有限公司新昌制药厂生产。
1.2.2 给药方案 按患者体重计算用药剂量,GSD组为6 mg/kg,GHD组为10 mg/kg;用药频次第1天为q12 h,第2天起均改为qd,治疗时间为5~14 d。
1.3 监测指标
1.3.1 Ccr 入组患者在使用替考拉宁第1天、第3天监测血肌酐浓度及24 h尿肌酐值,根据公式Ccr(mL/min)=[24 h尿肌酐值(μmol)×1 000]/[血肌酐浓度(μmol/L)×1 440],计算尿Ccr。
1.3.2 Cmin 采用高效液相色谱法(HPLC)检测替考拉宁浓度。于第4天给药前30 min采血,取血清样品600 μL放入1.5 mL离心管中,加160 μL 20%高氯酸,14 000 r/min 离心5 min,取上清液200 μL,进样HPLC分析。当患者Cmin>10 mg/L时,视为达到目标浓度。
1.4 观察指标 第4天用药前替考拉宁Cmin及各组目标浓度达标率情况,肝肾功能损害、皮疹等不良反应情况。
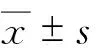
2结果
2.1 一般情况 共纳入研究对象49例,其中GSD1组11例,GSD2组6例; GHD1组25例,GHD2组7例。各组患者一般资料比较,除年龄差异有统计学意义外,其他指标比较,差异均无统计学意义(均P<0.05)。见表1。

表1 不同亚组患者一般资料比较
2.2 替考拉宁Cmin水平 第4天用药前送检49份血清标本,测得替考拉宁Cmin为2.72~20.11 mg/L。GSD组平均 Cmin为(5.98±2.67) mg/L,目标Cmin的达标率为11.76%(2/17);GHD组分别为(9.05±4.25) mg/L、37.50%(12/32);GHD组替考拉宁Cmin高于GSD组(t=3.10,P=0.003),目标Cmin的达标率两组比较,差异无统计学意义(χ2=3.60,P=0.06)。4组间替考拉宁Cmin比较,差异有统计学意义(F=4.766,P=0.006),进一步LSD检验,结果显示GHD2组Cmin高于GHD1组、GSD2组和GSD1组;GSD1组与GSD2组、GHD1组与GSD1组的Cmin比较,差异无统计学意义。4组达标率组间比较,差异有统计学意义(χ2=8.766,P=0.033)。见表2。
2.3 替考拉宁不良反应 替考拉宁治疗期间,各组患者均无明显皮疹、肝功能损害等不良反应发生。监测尿Ccr亦无显著下降。
表2各组第4天用药前替考拉宁Cmin及Cmin达标情况
Table2Teicoplanin Cmin and target result of Cmin of each group on 4thday before administration

组别Cmin(mg/L)Cmin达标例数Cmin达标率(%)GHD1组(n=25)8.21±3.77728.00GHD2组(n=7)12.07±4.81571.43GSD1组(n=11)5.78±2.7219.09GSD2组(n=6)6.34±2.78116.67
3讨论
全球抗菌药物耐药监测结果[8]显示,耐甲氧西林金黄色葡萄球菌(MRSA)是最常见的一种耐药阳性菌,其高耐药性和高致死率已成为全球关注的重点之一。糖肽类药物是临床上最常应用于抗MRSA的一类抗生素,其中替考拉宁因具有肾毒性低、耐药性低等特点受临床医生青睐。然而,重症患者通常合并器官功能不全,使用替考拉宁治疗时容易导致药物表观分布容积、药代动力学发生变化。因此,重症患者如何使用替考拉宁是临床工作的一大难题,亦是近年医学研究的热点之一。替考拉宁是非浓度依赖性抗生素,具有明显的抗生素后效应。研究[7,9]表明,当 AUC/MIC ≥345 时,Cmin>10 mg/L即可达到理想的治疗效果。研究[10]显示,在治疗第4天达到目标Cmin组的治疗效果优于第4天未达目标Cmin组及第4天以后达目标Cmin组,表明发挥替考拉宁最佳药效的前提条件是必须在治疗早期达到目标Cmin。
本研究GSD组患者使用替考拉宁3 d后的Cmin为(5.98±2.67) mg/L,目标Cmin的达标率仅为11.76%,提示标准剂量替考拉宁早期难以达到目标Cmin,与文献[2,11]报道一致。有关提高Cmin负荷剂量的研究[12]陆续有报道,但目前尚无一致意见。本研究对GHD组32例患者增加负荷剂量至10 mg/kg,结果发现Cmin水平较前升高。按不同Ccr进行亚组分析显示,GHD1、GHD2的Cmin水平分别高于GSD1、GSD2,差异有统计学意义,提示提高替考拉宁的负荷剂量有助于提高早期目标Cmin达标率。
替考拉宁主要经肾脏清除,具有蛋白结合率高、半衰期长等特点,目前使用替考拉宁时仍按照标准剂量作为负荷剂量。但是,Ueda等[13]报道肾功能不全患者给予标准剂量替考拉宁时,仅20.3%患者Cmin达到15 μg/mL;Brink等[14]发现肾功能不全者,若给予标准剂量替考拉宁均不能达到目标Cmin。本研究进行亚组分析同样发现,Ccr<50 mL/min者给予标准剂量替考拉宁治疗,3 d后的Cmin仅为(6.34±2.78) mg/L,Cmin达标率仅为16.67%。由此可见,肾功能不全患者使用替考拉宁治疗时,若要提高早期目标Cmin达标率,也须提高替考拉宁的负荷剂量。Nakamura等[15]研究发现,给予高负荷剂量(12 mg/kg,2次/d,2 d),Ccr<50 mL/min组在第2、3、4天的Cmin均高于Ccr>50 mL/min组,第3天Ccr <50 mL/min组达目标浓度的比率高于Ccr>50 mL/min组(80% vs 62%),但同时Ccr <50 mL/min组Cmin超过临界高值的比率亦高于Ccr>50 mL/min组(25% vs 2%)。本研究选择低于此文献的剂量10 mg/kg作为高剂量组,对不同Ccr患者进行亚组分析,结果显示GHD2组的Cmin为(12.07±4.81) mg/L,目标Cmin达标率为71.43%;而GHD1组分别为(8.21±3.77) mg/L、28.00%。提示对于低Ccr的重症感染患者,提高负荷剂量至10 mg/kg可有效提高目标Cmin的达标率。对于正常Ccr的患者,为达到所需要的目标Cmin,则应使用>10 mg/kg 的负荷剂量。当然,探索最适负荷剂量的替考拉宁还有待于进一步深入研究。本研究还观察了各组治疗期间的不良反应发生情况,均未发生皮疹、肝肾功能损害等不良反应。由此认为,给予高剂量替考拉宁10 mg/kg的负荷剂量相对安全,患者耐受良好。
本研究存在一定局限性,表现在如下几个方面(1)各亚组样本例数相对较少;(2)本研究中较多患者为早期经验性抗G+球菌治疗,微生物学证据不充分,且多数为混合感染,大部分采取的是联合抗感染治疗;(3)仅对替考拉宁药物浓度进行评价,未对临床治疗效果、微生物学清除效果进行评价;(4)本组患者的清蛋白水平分布在28~30 g/L,各亚组未设立正常清蛋白水平作对照,因此,难以完全排除低蛋白血症对替考拉宁Cmin水平及目标Cmin达标率的影响。下一步研究可考虑开展患者清蛋白水平的分层临床研究,进一步全面了解影响替考拉宁药效浓度的其他因素,将有助于为危重症患者制定更合理的负荷剂量。
综上所述,不论患者Ccr正常与否,给予标准负荷剂量的替考拉宁早期均不能有效达到目标Cmin;对低Ccr者,给予高负荷剂量替考拉宁(10 mg/kg)可有效提高早期Cmin,且相对安全;而对正常Ccr者,为达到所需要的目标Cmin,则需给予更高的负荷剂量。为不同肾功能水平的G+球菌感染重症患者合理选用替考拉宁的负荷剂量提供了重要的参考依据,具有较高的临床指导价值。
[1] Wilson AP. Clinical pharmacokinetics of teicoplanin[J]. Clin Pharmacokinet, 2000, 39(3): 167-183.
[2] Pea F, Brollo L, Viale P, et al. Teicoplanin therapeutic drug monitoring in critically ill patients: a retrospective study emphasizing the importance of a loading dose[J]. J Antimicrob Chemother, 2003, 51(4): 971-975.
[3] Begg EJ, Barclay ML, Kirkpatrick CM. The therapeutic monitoring of antimicrobial agents[J]. Br J Clin Pharmacology, 2001, 52(Suppl 1): 35S-43S.
[4] Schaison G, Graninger W, Bouza E. Teicoplanin in the treatment of serious infection[J]. J Chemother, 2000, 12( Suppl 5): 26-33.
[5] Harding I, MacGowan AP, White LO, et al. Teicoplanin therapy forStaphylococcusaureussepticaemia: relationship between pre-dose serum concentrations and outcome[J]. J Antimicrob Chemother, 2000, 45(6): 835-841.
[6] Tobin CM, Lovering AM, Sweeney E, et al. Analyses of teicoplanin concentrations from 1994 to 2006 from a UK assay service[J]. J Antimicrob Chemother, 2010, 65(10): 2155-2157.
[7] Niwa T, Imanishi Y, Ohmori T, et al. Significance of individual adjustment of initial loading dosage of teicoplanin based on population pharmacokinetics[J]. Int J Antimicrob Agents, 2010, 35(5): 507-510.
[8] Mendes RE, Hogan PA, Streit JM, et al. Zyvox R Annual Appraisal of Potency and Spectrum (ZAAPS) program: report of linezolid activity over 9 years (2004-12)[J]. J Antimicrob Chemother, 2014, 69: 1582-1588.
[9] Kuti JL, Kiffer CR, Mendes CM, et al. Pharmacodynamic comparison of linezolid, teicoplanin and vancomycin against clinical isolates ofStaphylococcusaureusand coagulase-negativestaphylococcicollected from hospitals in Brazil[J]. Clin Microbiol Infect, 2008, 14(2): 116-123.
[10] Ueda T, Takesue , Nakajima K, et al. Enhanced loading regimen of teicoplanin is necessary to achieve therapeutic pharmacokinetics levels for the improvement of clinical outcomes in patients with renal dysfunction[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(9): 1501-1509.
[11] Ahn BJ, Yim DS, Lee DG, et al. Teicoplanin dosing strategy for treatment ofStaphylococcusaureusin Korean patients with neutropenic fever[J]. Yonsei Med J, 2011, 52(4): 616-623.
[12] Ueda T, Takesue Y, Nakajima K, et al. High-dose regimen to achieve novel target trough concentration in teicoplanin[J]. J Infect Chemother, 2014, 20(1): 43-47.
[13] Ueda T, Takesue Y, Nakajima K, et al. Evaluation of teicoplanin dosing designs to achieve a new target trough concentration[J]. J Infect Chemother, 2012, 18(3): 296-302.
[14] Brink AJ, Richards GA, Cummins RR, et al. Recommendations to achieve rapid therapeutic teicoplanin plasma concentrations in adult hospitalised patients treated for sepsis[J]. Int J Antimicrob Agents, 2008, 32(5): 455-458.
[15] Nakamura A, Takasu O, Sakai Y, et al. Development of a teicoplanin loading regimen that rapidly achieves target serum concentrations in critically ill patients with severe infections[J]. J Infect Chemother, 2015, 21(6): 449-455.
