一种龙须菜寄生真菌的种类鉴定及侵染过程研究❋
2018-02-28隋正红商二磊
阙 州, 隋正红, 米 萍, 商二磊
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛266003)
在淡水中,已发现有大量寄生于藻类中的游孢子型真菌(zoosporic true fungi),包括壶菌门(Chytridiomycota),新美鞭菌门(Neocallimastigomycota)和Blastocladiomycota,此外还有许多类似真菌的生物被发现寄生在微藻中,包括卵菌(Oomycetes)、拟网黏菌类(Labyrinthulids)、破囊壶菌类(Thraustochytrids)等[1]。然而寄生于海洋藻类的真菌至今了解甚少。藻类养殖业中由寄生生物引起的疾病会造成大量的经济损失,在所有寄生生物(原生动物、假菌界、真菌、细菌、寄生藻类、线虫和病毒)中,真菌所造成的影响仅次于细菌[2-3]。关于藻类寄生真菌的研究主要集中在致病真菌方面,真菌感染特异性和菌藻关系是菌藻作用的研究重点[4-5],而真菌的致病机理和生理反应相关研究则很少涉及,这也是未来研究藻类致病真菌的主要目标和方向。
海洋藻类寄生致病真菌主要有三个纲:壶菌纲(Chytridiomycetes)、子囊菌纲(Ascomycetes)和半知菌纲(Deuteromycetes)[6-7],已被鉴定的物种包括6种壶菌、31种子囊菌和1种半知菌[5]。6种壶菌为Chytridiumpolysiphoniae,Chytridiummegastomum,Coenomycessp.,Rhizophydiumlittoreum,Olpidiumrostriferum和Thalassochytriumgracilariopsidis。最初的研究表明,Chytridiumpolysiphoniae是一种寄生病原菌,可使红藻Centrocerasclavulatum(C. Agardh)及褐藻Sphacelariasp.和Pylaiellalittoralis致病[3,8]。进一步的研究还发现,Chytridium能够侵染23种褐藻,包括8个目,19个属[9]。Chytridium引起最严重的病害会导致黑顶藻(Sphacelaria)种群消失[3]。Coenomycessp.是一种侵染绿藻Cladophorasp.的寄生菌,然而被侵染的藻体形态不发生改变[10]。Olpidiumrostriferum是一种内共生壶菌可侵染绿藻Cladophora和Rhizoclonium[3,11],被侵染的藻体出现细胞肿大、偏褐色的症状[12]。Thalassochytriumgracilariopsidis首次被发现于龙须菜(Gracilariopsislemaneiformis)中,且是一种龙须菜高度特异的寄生菌,只侵染来自中国青岛的龙须菜,对智利江蓠(Gracilariachilensis)、细枝江蓠(Gracilariatenuistipitata)等其它江蓠物种,甚至美国的龙须菜均没有侵染性,且对寄主无害处[13]。
本研究发现1种龙须菜寄生真菌。基于nucSSU rDNA和nucLSU rDNA的部分序列分析方法建立的系统发育进化树显示,该真菌属于壶菌门(Chytridiomycota),壶菌纲(Chytridiomycetes),Lobulomycetales目;基于ITS1-5.8S-ITS2序列分析方法建立的系统发育进化树显示,该真菌不归属于Lobulomycetales目内任一已知属,可能是Lobulomycetales目内1个新的属。是首次发现寄生于红藻江蓠的Lobulomycetales目物种。为了研究寄生真菌对龙须菜生长发育产生的影响,我们通过切片结合显微观察方法研究真菌侵染龙须菜的整个过程,结果表明真菌会损害龙须菜生长发育,会导致龙须菜细胞出现变形、脱色等症状,严重可致龙须菜藻体断裂。通过PAS、CBB和Nile-red 3种方法染色发现,真菌富含多糖和蛋白质,不含(或少含)脂质;3种染色均可作为判断藻体是否含真菌的方法。本研究为深入阐明菌藻作用提供了基础。
1 材料和方法
1.1 材料准备
通过切片观察选取含有锥状/管状特殊结构(真菌孢子囊)和菌丝体的龙须菜藻体若干株(见图1),去除藻体表面杂质及附生物,单独培养,实验室培养条件为22 ℃, 15 μmol·m-2·s-1, 盐度30‰, 12 h:12h 光暗周期。

( a.龙须菜体内含真菌孢子囊(箭头);b.龙须菜体内含真菌菌丝体(箭头)。a. The sporangium of the fungus(black arrow);b. The hypha of the fungus(black arrows).)
图1 带真菌的龙须菜藻体
Fig.1 The frond ofGp.lemaneiformiscontains endosymbiotic fungi
1.2 序列扩增和测序
参照Timothy等[14]CTAB法提取龙须菜基因组DNA。
由于该真菌游孢子含有单鞭毛的特征,所以初步鉴定其属于壶菌门,选取壶菌门4个目共10个物种的18S和28S rDNA序列进行ClustalX比对,在 18S rDNA 3’侧和28S rDNA 5’侧各找到一段同源性高的序列,运用Primer5.0分别于两段高同源性序列中设计出大小均为23 bp的上游和下游PCR引物,引物序列如下:
正向引物:5′ CGCTA(C/G)TACCGATTGAATGGCTT 3′;
反向引物:5′ TCTTTCCCTCACGGTACTTGTTC 3′。
以提取的基因组DNA为模板,利用上述引物进行PCR扩增,PCR程序为:94 ℃ 5.0 min;94 ℃ 1.0 min,54、56、59、62、65 ℃ 1.5 min,72 ℃ 1.0 min,30 个循环;72 ℃10.0 min。扩增产物直接进行PCR产物测序,测序由青岛擎科公司负责完成。测序采用Sanger双向测序方法,测序完成后,运用ContigExpress软件对测序结果进行拼接。
1.3 重建系统发育进化树
目标序列拼接完成后,与NCBI数据库比对,选取目标序列的18S和28S部分。再用18S+28S序列与NCBI数据库比对,找出与目标序列的18S+28S同源性较高的门类,下载该门类中所有纲、所有目、所有科、所有属的物种的18S+28S序列(如果有的话)。运用ClustalX软件进行序列比对,比对后的序列采用MEGA软件Kimura-2模型构建ML和NJ进化树。18S+28S序列建树可将目标真菌鉴定到属。
根据18S+28S序列的建树结果,下载与目标真菌进化关系最密切的目中所有种的ITS1-5.8S-ITS2序列,运用与上述同样的方法建树。ITS1-5.8S-ITS2序列建树可将目标真菌鉴定到种。
1.4 龙须菜寄生真菌侵染过程的观察
选取带真菌的龙须菜藻体,利用徒手切片方法对带真菌藻体进行连续切片观察。显微观察采用 NIKON Eclipse 80i 显微镜。
1.5 龙须菜寄生真菌的染色观察
为了观察藻体内部的真菌菌丝,以及判断菌丝和孢子囊的化学组分,我们采用希夫氏高碘酸(PAS)、考马斯亮蓝(CBB)和尼罗红(Nile red)方法对其进行染色观察[15-17]。PAS染色多糖为红色,CBB染色蛋白质为深蓝色,尼罗红可与脂质物质结合,结合后在紫外光激发下显示红色。
2 结果
2.1 序列扩增和测序
PCR结果显示5个退火温度都扩增出一个较亮的单一条带,条带大小为 1 100 bp左右,说明扩增条带特异性强。扩增产物经测序和拼接获得1 045 bp的目标序列,该序列已提交NCBI,序列编号为KU869767。
2.2 建立系统发育进化树
用目标序列的18S+28S与NCBI数据库比对,结果显示与该真菌同源性较高的物种都属于壶菌门(Chytridiomycota),根据该真菌具有单鞭毛的特性,也能判定其属于壶菌门。因此我们选取壶菌门中所有含18S+28S序列的属,下载其18S+28S序列。选取物种包括壶菌门2个纲,8个目,16个科,22个属,23个物种;同是真菌界的Mucoromycota门3个物种;以及2个outgroup物种。构建ML树(见图2)。结果显示,龙须菜寄生真菌(Aim)属于Lobulomycetales目,是Lobulomycetales目中起源较早的物种,且不归属于任一已知属,可能是Lobulomycetales目一个新的属。
为了进一步研究该真菌的种的界定,我们选取并下载Lobulomycetales目中所有物种的ITS1-5.8S-ITS2序列。选取的物种包括1个科,4个属,8个种,以及2个未确定属的物种(AF011和AF017);Lobulomycetales目2个物种;以及blastocladiomycota门的2个物种作为outgroup。构建ML树(见图3)。结果显示,目标真菌(Aim)与2个未确定属(AF011、AF017)的物种进化关系最密切,是Lobulomycetales目中起源较早的物种,且不归属于任一已知属,可能是Lobulomycetales目内一个新的属。
NJ树形与ML树形一致。

图2 基于18S+28S部分序列建立的ML进化树(Aim为(目标真菌))Fig.2 ML phylogenetic tree based on partial 18S+28S sequence (Aim is the purpose fungus)

图3 基于ITS1-5.8S-ITS2序列建立的ML树Aim为(目标真菌)Fig.3 ML phylogenetic tree based on ITS1-5.8S-ITS2 sequence(Aim is the purpose fungus)
2.3 龙须菜附生真菌侵染过程的观察
通过切片观察,我们研究了真菌侵染龙须菜过程。真菌首先侵入龙须菜表面胶质层,侵染处形成漏斗状痕迹(见图3 a),然后菌丝通过表皮细胞间隙进入到髓部(见图3 b),并在髓部产生孢子囊(见图3 c),孢子囊产生大量游动孢子,整个孢子囊呈黄色(见图3 d),孢子囊发育成熟后开始放散游孢子(见图3 e),放散完后孢子囊颜色变浅(见图3 f),此时龙须菜表面出现大量孔洞(见图3 g),内部细胞形状异常甚至破裂(见图3 h),严重时藻体出现断枝。
2.4 龙须菜寄生真菌的染色观察
龙须菜寄生真菌菌丝伸入到次表皮细胞和髓部细胞中,孢子囊也嵌入藻体内部细胞间。孢子囊较大浅黄或黄色容易观察(见图4 a),而菌丝较细,颜色与髓部细胞一样都偏白色(见图4 g. 箭头),不易观察。3种染色方法的染色结果显示,真菌的孢子囊可以被PAS和CBB染色(见图4 b、c),菌丝也可以被PAS和CBB染色(见图4 e、f. 箭头),表明真菌的孢子囊和菌丝都富含多糖和蛋白质。Nile red对菌丝和孢子囊染色后,于紫外光激发下并不显示红色,而是显示蓝色(见图4 h. 绿色箭头),表明真菌孢子囊和菌丝不含脂质,而可能含多酚,因为多酚物质能在紫外光激发下发蓝光。菌丝被PAS、CBB和Nile red染色后颜色(或荧光)较深,明显与髓部细胞区别开来。当真菌侵染龙须菜前期孢子囊并没有形成时,只有菌丝存在于藻体内部,菌丝颜色浅(见图4 g. 红色箭头),较难发现,运用这些染色方法即可有效判断藻体是否含真菌菌丝(见图4 h. 红色箭头)。
3 讨论
壶菌门(Chytridiomycota)是游孢子具有一根后生尾鞭式鞭毛,鞭毛具有“9+2”结构的一类真菌。壶菌门的鞭毛结构也是其区别于真菌其它门类的主要依据。多数水生,少数两栖或陆生,腐生、寄生、专性寄生均有。Rhizophydium是壶菌门最早被报道的种类,Schenk(1858)把Rhizophydium纳入Chytridiales目[18]。过去分类学家根据菌丝形态、对称中心、孢子囊盖、隔膜等形态特征把壶菌门分为1个纲:Chytridiomycetes,3个目:Chytridiales,Blastocladiales,Monoblepharidales[19]。然而,壶菌门的物种形态差异较大,随着越来越多壶菌门的物种被鉴定出来,形态的多样性也越来越大,甚至同一属的物种形态特征都很难统一,没有一个统一的分类标准[20],而且还有报道称即便是同一物种,不同培养环境下其形态也会发生变化[21]。1980年,Barr 用游孢子亚细胞显微观察方法把Spizellomycetales从Chytridiales中分离出来成立一个新的目[22],20年后,分子生物学手段的应用支持了游孢子亚细胞结构分析的合理性[23]。近年来综合运用分子生物学和亚显微技术极大推动了壶菌门系统分类研究[14, 23-25],研究发现Spizellomycetales和Chytridiales目不是单系群。2006年,Letcher等通过对SSU和LSU rDNA序列分析和游孢子亚细胞结构观察方法,把Rhizophydium分枝从Chytridiales中分离出来单独成立一个新的目Rhizophydiales[26]。而后研究者又从Spizellomycetales分出来一个新的目Rhizophlyctidales[25]。Sharon等[27]同样通过对SSU 和 LSU rDNA序列分析和游孢子亚细胞结构观察方法,把Cladochytrium进化枝从Chytridiales中分离出来单独成立一个新的目Cladochytriales。Simmons等[28]利用同样的方法,把Chytridiales的一个分支C.angularis分离出来另立一个新目Lobulomycetales。Longcore等[29]把Polychytrium提升为新的目Polychytriales。Karpov等[30]同样通过亚显微观察和rDNA序列分析方法发现了两个新的目:Gromochytriales和Mesochytriales。此外,分类学家Hibbett等[31]通过进一步分析把原属Chytridiomycetes纲的Monoblepharidales目提升为一个新的纲Monoblepharidomycetes;James等[14]把原属壶菌门的Blastocladiales上升为Blastocladiomycota门。所有这些新目的发现不但反映了壶菌门种类的丰富多样性,而且建立了以分子生物学手段为主的壶菌门分类标准[29]。通过亚显微观察和基因序列分析方法在壶菌门分类鉴定中的应用,截至目前,壶菌门分为2个纲和10个目,2个纲分别为Chytridiomycetes和Monoblepharidomycetes,Monoblepharidomycetes有1个目Monoblepharidales,Chytridiomycetes有9个目为:Chytridiales、Spizellomycetales、Rhizophydiales、Rhizophlyctidales、Cladochytriales、Lobulomycetales、Polychytriales、Gromochytriales、Mesochytriales。
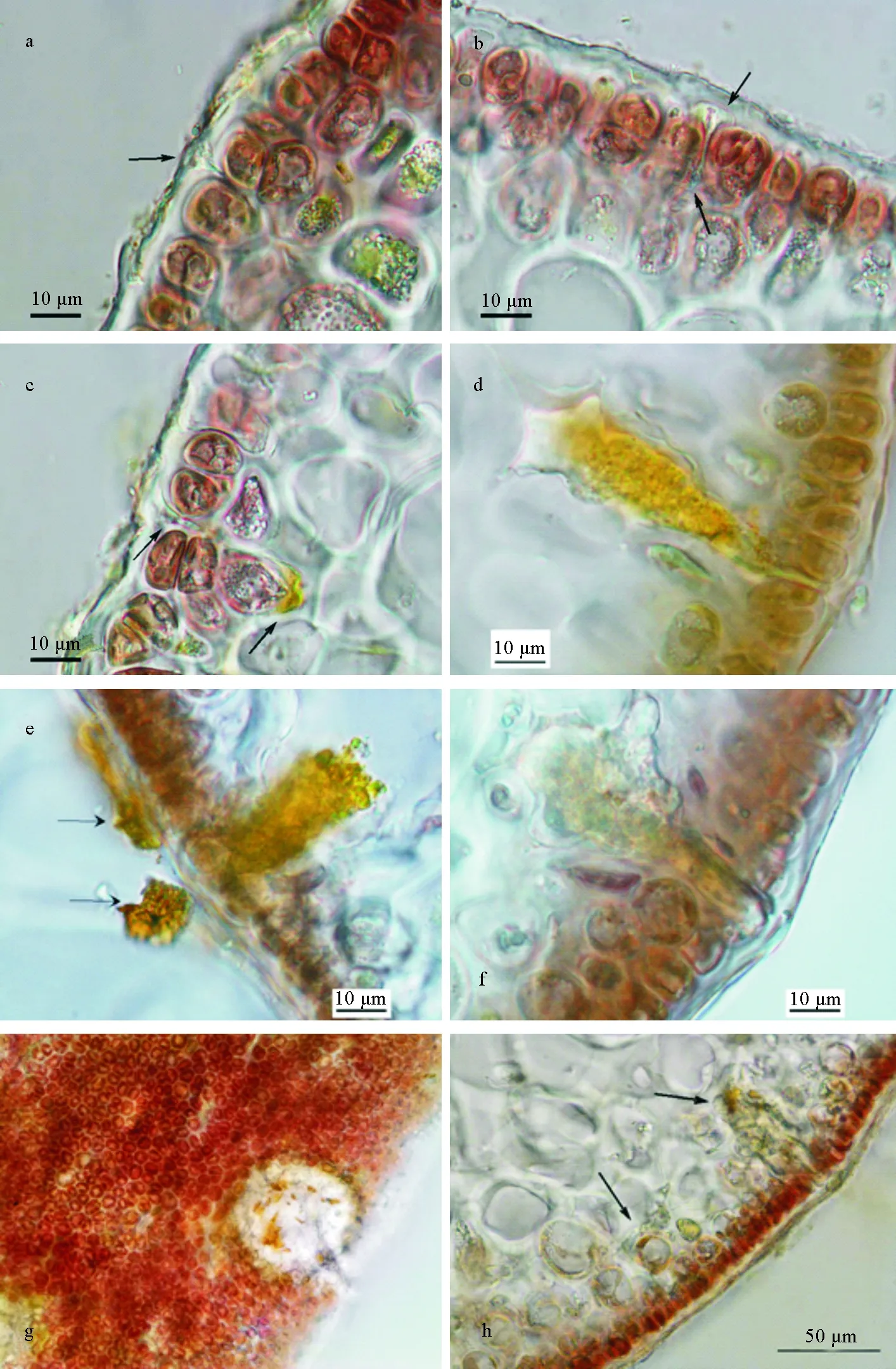
(a.真菌首先侵入龙须菜表面胶质层,侵染处形成漏斗状痕迹(箭头),b.然后菌丝通过表皮细胞间隙(箭头)进入到髓部细胞,并在髓部细胞产生孢子囊(c. 箭头),孢子囊产生大量游动孢子,整个孢子囊呈黄色(d),孢子囊发育到一定程度后开始放散游孢子(e. 箭头),游孢子放散完后孢子囊颜色变浅(f),此时龙须菜表面出现大量孔洞(g),内部细胞形状异常甚至破裂(h. 箭头)。Firstly, the fungi entered into the surface ofGp.lemaneiformisto form a funnel-shaped structure (a). The hypha extended through the intercellular space to reach the medullary cell layer (b). The sporangium was produced by the inner part of the hypha (c) and it developed fast through zoospores mitosis (d). Later, the zoospores were released (e) and the color of sporangium turned to pale yellow (f). Meanwhile, for the algae, there were lots of holes in the surface (g) and the inner cells turnedmorphologically abnormal and evenly died (h).)
图4 龙须菜寄生真菌侵染过程
Fig.4 The endosymbiotic fungal infection process inGp.lemaneiformis
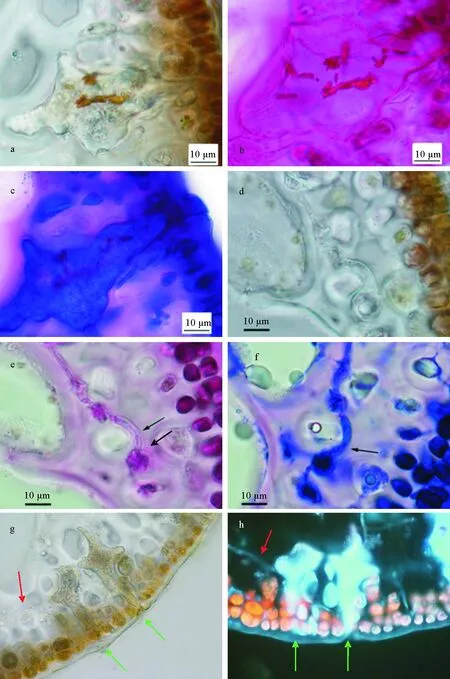
(a.真菌孢子囊;b.PAS染色孢子囊;c.CBB染色孢子囊;d.菌丝(箭头);e.PAS染色菌丝(箭头);f.CBB染色菌丝(箭头);g.孢子囊菌丝(红色箭头)和孢子囊(绿色箭头);h.Nile red染色后菌丝(红色箭头)和孢子囊(绿色箭头)紫外光观察。 a.the sporangium; b. the sporangium stained by PAS; c. the sporangium stained by CBB;d. the hypha (black arrow);e. the hypha stained by PAS. f. the hypha stained by CBB;g. the hypha (red arrow) and sporangium (green arrow) before stained by Nile red; h. the hypha (red arrow) and sporangium (green arrow) under the UV-light after stained by Nile red.)
图5 PAS、CBB和Nile red染色孢子囊和菌丝
Fig.5 The sporangium and the hypha stained by PAS, CBB and Nile red
本研究发现一种龙须菜寄生真菌,利用nucSSU rDNA和nucLSU rDNA的部分序列建立的系统发育进化树表明该真菌属于壶菌门(Chytridiomycota),壶菌纲(Chytridiomycetes),Lobulomycetales目;利用ITS1-5.8S-ITS2序列建立的系统发育进化树显示,该真菌不归属于Lobulomycetales目内任一已知属,可能是Lobulomycetales目内一个新的属。关于Lobulomycetales目的分类依据和基本特征研究Simmons等(2009)已经对其进行了概括[28]。Lobulomycetales目包含4个属:Lobulomyces、Clydaea、Maunachytrium、Alogomyces。Lobulomycetales目的物种存在于土壤、淡水和海洋环境中,甚至于马粪中也有出现[32-35]。其中,ChytridiumpolysiphoniaeCohn是由Cohn 于1865年发现并命名的寄生于多管藻Polysiphoniaviolacea的真菌[36],此后Feldmann[10]和 Sparrow[37]把该菌归属于壶菌目(Chytridiales)壶菌科(Chytridiaceae),但缺乏分子系统进化分析。Simmons等[28]通过rDNA序列分析和游孢子亚细胞结构分析发现Chytridiumpolysiphoniae属于Lobulomycetales目,这是第一个被发现存在于藻类体内的Lobulomycetales目的物种,Kupper等[35]的研究还发现ChytridiumpolysiphoniaeCohn寄生在褐藻中。而本实验研究的龙须菜共生菌则是第二个被发现存在于藻类体内的Lobulomycetales目的物种,因此进一步增加了藻类共生壶菌的认识。
本研究通过切片染色研究真菌的化学组分,运用PAS、CBB和Nile-red 3种方法染色发现,真菌富含多糖和蛋白质,不含(或少含)脂质。当真菌侵染龙须菜前期孢子囊并没有形成时,只有菌丝存在于藻体内部,菌丝颜色浅,较难发现,运用这3种染色方法均可判断藻体是否含真菌。同时,通过切片观察初步研究了真菌侵染龙须菜的过程。发现真菌侵染的前期(游孢子放散前),藻体内部细胞和表面形态都无明显异常,藻体生长状态良好;真菌侵染的后期(游孢子放散后),藻体内部细胞肥大、褪色,藻体表面出现大量孔洞,严重时藻体出现断裂。表明该真菌的侵染会导致龙须菜致病,该真菌对龙须菜的生长发育有害。与本研究不同的是,Nyvall等[13]研究表明Thalassochytriumgracilariopsidis对龙须菜不产生有害影响,而本研究分离的真菌对藻体有明显的破坏作用,这丰富了对龙须菜寄生真菌及其影响的认识。同时,龙须菜作为一种重要的经济海藻,其有害寄生真菌的发现将会引起学界对藻类有害菌的更多关注。过去有学者初步从生理角度研究寄生真菌对藻类的影响,Gachon等[38]通过测定Chytridiumpolysiphoniae侵染褐藻前后的叶绿素荧光曲线,发现Chytridiumpolysiphoniae影响寄主褐藻光合作用速率。Thalassochytriumgracilariopsidis侵染龙须菜后,龙须菜体内的α-1,4-葡聚糖裂解酶活性明显升高[13]。而盐度是寄生菌Olpidiumrostriferum和Coenomycessp.生长的主要影响因子,Raghukumar[12]报道Olpidiumrostriferum和Coenomycessp.在7—9月的时候生物量最大,这段时期是淡水流入海水量最大的时期。进一步从生理和病理的角度研究有害寄生菌的侵染机理及防治措施,将会有效减少藻类栽培中由寄生真菌造成的经济损失,也是未来藻类寄生菌的研究方向之一。
[1] Richards T A, Jones M D M, Leonard G, et al. Marine fungi: Their ecology and molecular diversity [J]. Annual Review of Marine Science, 2012, 4: 495-522.
[2] Weinberger F. Pathogen-induced defense and innate immunity in macroalgae [J].The Biological Bulletin, 2007, 213(3): 290-302.
[3] Ramaiah N. A review on fungal diseases of algae, marine fishes, shrimps and corals [J]. Indian Journal of Marine Sciences, 2006, 35(4): 380-387.
[4] John H. Andrews. The pathology of marine algae [J].Biol Rev, 1976, 51: 211-253.
[5] Li W, Zhang T, Tang X, et al. Oomycetes and fungi: Important parasites on marine algae [J]. Acta Oceanologica Sinica, 2010, 29(5): 74-81.
[6] Kohlmeyer J. Higher fungi as parasites and symbionts of algae [J].Veroffentlichungen des Instituts fur Meeresforschung in Bremerhaven, 1974, 5(Suppl): 339-356.
[7] Hughes G C. Studies of Fungi in Oceans and Estuaries Since 1961: Lignicolous, Caulicolous and Foliicolous Species [M]. G Allen and Unwin, 1975.
[8] Raghukumar C. The occurrence of Chytridium polysiphoniae, a fungal pathogen on the red algaCentrocerasclavulatum(C. Agardh) Montagne from Goa[J]. Indian Journal Marine Sciences, 1986b, 15: 42-44.
[9] Müller D G, Küpper F C, Küpper H. Infection experiments reveal broad host ranges of Eurychasma dicksonii (Oomycota) andChytridiumpolysiphoniae(Chytridiomycota), two eukaryotic parasites in marine brown algae (Phaeophyceae) [J]. Phycological Research, 1999, 47(3): 217-223.
[10] Sparrow F K. Aquatic Phycomycetes[M].2nd ed.Ann Arbor: The University of Michigan Press, 1960: 486-537, 792-822.
[11] Chandramohan D. Recent advances in marine microbiology: The Indian scenario[J]. Journal of Marine Biotechnology, 1997, 5: 73-81.
[12] Raghukumar C. Zoosporic fungal parasites of marine biota[J]. Advances in Zoosporic Fungi, 1996: 61-83.
[13] Nyvall P, Pedersén M, Longcore J E.Thalassochytriumgracilariopsidis(Chytridiomycota), gen. et sp. nov., endosymbiotic inGracilariopsissp. (Rhodophyceae) [J]. Journal of Phycology, 1999, 35(1): 176-185.
[14] James T Y, Letcher P M, Longcore J E, et al. A molecular phylogeny of the flagellated fungi (Chytridiomycota) and description of a new phylum (Blastocladiomycota) [J].Mycologia, 2006b, 98(6): 860-871.
[15] Rover T, Simioni C, Hable W, et al. Ultrastructural and structural characterization of zygotes and embryos during development inSargassumcymosum(Phaeophyceae, Fucales)[J]. Protoplasma, 2015, 252(2): 505-518.
[16] Dring D M. A periodic Acid-Schiff technique for staining fungi in higher plants[J]. New Phytologist, 1955, 54(2): 277-279.
[17] Fowler S D & Greenspan P. Application of Nile red, a fluorescent hydrophobic probe, for the detection of neutral lipid deposits in tissue sections: Comparison with oil red O[J]. Journal of Histochemistry&Cytochemistry, 1985, 33(8): 833-836.
[18] Schenk A. AlgologischeMittheilungen[M]. Stahel, 1858.
[19] Coker W C, Matthews V D, Barnhart J H. Blastocladiales, Monoblepharidales: Blastocladiaceae, Monoblepharidaceae[M]. New York Botanical Garden, 1937.
[20] Bérczi L. Adatok Magyarorszag vizigomba vegetaciojahoz. Vizigom-bakkal vegzett mesterseges fertozesi kiserletek (Angaben zur Wasserpilzvege-tation ungarns nebst nich Wasserpilzen durchgefiihrten Ansteckungsversuchen)[J].Acta Geobot Hung, 1940, 3: 79-99.
[21] Miller C E. Substrate-influenced morphological variations and taxonomic problems in freshwater, posteriorly uniflagellate Phycomycetes[J]. Recent Advances in Aquatic Mycology, 1976: 469-487.
[22] Barr D J S. An outline for the reclassification of the Chytridiales, and for a new order, the Spizellomycetales[J]. Canadian Journal of Botany, 1980, 58(22): 2380-2394.
[23] James T Y, Porter D, Leander C A, et al. Molecular phylogenetics of the Chytridiomycota supports the utility of ultrastructural data in chytrid systematics [J]. Canadian Journal of Botany, 2000, 78: 336-350.
[24] James T Y, Frank K, Schoch C L, et al. Reconstructing the early evolution of Fungi using a six-gene phylogeny [J]. Nature, 2006a, 443(7113): 818-22.
[25] Letcher P M, Powell M J, Barr D J S, et al. Rhizophlyctidales—a new order in Chytridiomycota[J]. Mycological Research, 2008a, 112(9): 1031-1048.
[26] Letcher P M, Powell M J, Churchill P F, et al. Ultrastructural and molecular phylogenetic delineation of a new order, the Rhizophydiales (Chytridiomycota) [J]. Mycological Research, 2006, 110(8): 898-915.
[27] Mozley-Standridge S E, Letcher P M, Longcore J E, et al. Cladochytriales—a new order in Chytridiomycota[J]. Mycological Research, 2009, 113(4): 498-507.
[28] Simmons D R, James T Y, Meyer A F, et al. Lobulomycetales, a new order in the Chytridiomycota[J]. Mycological research, 2009, 113(4): 450-460.
[29] Longcore J E, Simmons D R. The Polychytriales ord. nov.contains chitinophilic members of the rhizophlyctoid alliance[J]. Mycologia, 2012, 104(1): 276-294.
[30] Karpov S A, Kobseva A A, Mamkaeva M A, et al. Gromochytriummamkaevae gen. & sp. nov.and two new orders: Gromochytriales and Mesochytriales (Chytridiomycetes)[J]. Persoonia: Molecular Phylogeny and Evolution of Fungi, 2014, 32: 115.
[31] Hibbett D S, Binder M, Bischoff J F, et al. A higher-level phylogenetic classification of the Fungi[J]. Mycological Research, 2007, 111(5): 509-547.
[32] Bass D, Howe A, Brown N, et al. Yeast forms dominate fungal diversity in the deep oceans[J]. Proceedings of the Royal Society of London B: Biological Sciences, 2007, 274(1629): 3069-3077.
[33] Le Calvez T, Burgaud G, Mahe ′ S, et al. Fungal diversity in deep-sea hydrothermal ecosystems[J]. Appl Environ Microbiol, 2009, 75: 6415-6421.
[34] Simmons D R, Letcher P M, Powell M J, Longcore J E. Alogomycestanneri gen. et sp. nov., a chytrid in Lobulomycetales from horse manure[J]. Mycologia, 2012, 104(1): 157-163.
[35] Kupper F C, Maier I, Muller D G, et al. Phylogenetic affinities of two eukaryotic pathogens of marine macroalgae,Eurychasmadicksonii(Wright) Magnus and Chytridium polysiphoniae Cohn[J]. Cryptogamie Algologie, 2006, 27(2): 165-184.
[36] Cohn F. Chytridii species novae marinae [J].Hedwigia, 1865, 12: 169-170.
[37] Feldmann J. Inventaire De La flore Marine de Roscoff: Algues, Champignons, Lichens Et Spermatophytes[M]. Roscoff: Station Biologique de Roscoff, 1954.
[38] Gachon C M M, Küpper H, Küpper F C, et al. Single-cell chlorophyll fluorescence kinetic microscopy ofPylaiellalittoralis(Phaeophyceae) infected byChytridiumpolysiphoniae(Chytridiomycota)[J]. European Journal of Phycology, 2006, 41(4): 395-403.
