先天性脊柱畸形合并泌尿系畸形患者的肾功能评估
2018-02-27高正超刘俭涛牛斌斌李宇欢李浩鹏贺西京
高正超,刘俭涛,牛斌斌,李宇欢,梁 辉,李浩鹏,贺西京
(西安交通大学第二附属医院骨科,陕西西安 710004)
先天性脊柱畸形是指由椎体形成缺陷或分节障碍导致的脊柱在矢状位、冠状位或轴位的位置偏离正常,表现为脊柱侧凸、前后凸和旋转畸形[1],被认为是在脊柱的胚胎发育期间受到致畸因子的作用而形成[2]。脊柱的发育来源于中胚层,与其相同起源的器官系统有骨骼肌、心血管系统以及泌尿生殖系统,因此先天性脊柱畸形常常合并其他系统畸形[1]。先天性泌尿系统畸形指以泌尿系统结构性或功能性缺陷为特征的一组先天性畸形,主要表现在肾脏和尿道,因此又称为先天性肾脏和尿路畸形(congenital anomalies of the kidney and urinary tract, CAKUT)[3]。
研究报道,约11%~37%的先天性脊柱畸形患者合并泌尿系统畸形,且泌尿系统畸形是其最常见的合并畸形之一;大部分患者在早期无任何临床症状,因不影响脊柱畸形的外科治疗而不被发现[4-6]。然而,CAKUT是导致儿童终末期肾病(end-stage renal disease, ESRD)和接受肾替代治疗(renal replacement therapy, RRT)的主要原因,且CAKUT患者接受RRT的年龄要明显小于非CAKUT患者(31岁vs. 61岁)[7-9]。与其他系统不同,CAKUT因其位置隐匿且大部分患者没有任何临床症状而常常被忽略,一些患者就诊时就已经发生了肾脏不可逆性损害甚至是ESRD。
目前的文献报道均聚焦于先天性脊柱畸形合并泌尿系统畸形的流行病学、形态学和病理学等,该类患者的肾功能状况未见相关文献报道。因此,本研究通过前瞻性募集先天性脊柱畸形合并泌尿系统畸形的患者,并与年龄、体质量相近的健康儿童做比较以评估先天性脊柱畸形合并泌尿系统畸形患者的肾功能。
1 对象与方法
1.1 研究对象 前瞻性地收集2015年8月-2017年5月于西安交通大学第二附属医院就诊的先天性脊柱畸形合并泌尿系畸形的患者,同时,在本院健康体检中心选取年龄和体质量接近的健康儿童。患者纳入标准:①诊断明确的先天性脊柱畸形合并先天性肾脏和尿路畸形的患者。其椎体异常可根据HEDEQUIST[10]提出的分型方法分为:Ⅰ型,椎体形成障碍,包括楔形椎、半椎体和蝶形椎畸形;Ⅱ型,椎体分节障碍,包括一侧“骨桥”和阻滞椎;Ⅲ型,为前两型的混合。先天性肾脏和尿路畸形指包含以下一项或多项:肾缺如、异位肾、马蹄肾、双集合系统、肾盂输尿管连接部梗阻、膀胱输尿管反流、巨输尿管症、输尿管异位开口、尿道下裂等;②不合并心肺肝肾等器官疾病。排除标准:①近期服用对肾脏有影响的药物;②家长或患者本人不同意参与本研究,未签署书面知情同意书者。健康儿童的纳入标准:①年龄、体质量与患者匹配;②不合并心肺肝肾等器官疾病。排除标准:与患者的排除标准一致。
1.2 实验室与影像学检查 收集所有研究对象的隔夜空腹静脉血以及清洁中段晨尿,分别用于血常规、生化测试、尿常规、尿肾脏早期损伤标记物的检测。所有的实验室检查均在本院检验中心执行。尿微量白蛋白(mALB)、α1-微球蛋白(α1-MG)和β2-微球蛋白(β2-MG)质量浓度的测定采用散射免疫比浊法(各指标参考范围分别为:0~30 mg/L;0~12 mg/L;0~0.23 mg/L);尿N-乙酰-β-D-葡萄糖苷酶(NAG)的测定采用比色法(参考范围为:0.3~12 U/L)。
所有患者在接受全面体格检查后,先接受超声检查(心脏彩超、腹部器官彩超)以明确心脏、腹部器官是否存在合并畸形,进而再接受X线、CT扫描以及MRI检查,进一步明确脊柱畸形与合并畸形的诊断。健康儿童只做系统查体、实验室检查以及超声检查,不做放射性检查。
1.3 数据收集 收集所有研究对象的年龄、性别、体质量、体格检查以及生化检查结果。此外,收集患者的脊柱畸形类型、合并的畸形、既往病史等信息。以肝功能检查同时结合影像学检查评价研究对象的肝功能;以左室射血分数结合影像学检查来评价研究对象的心功能;以血肌酐、尿素、胱抑素C以及估计肾小球滤过率(eGFR)等指标来评价研究对象的一般肾功能;以mALB、α1-MG、β2-MG以及NAG等指标来评价研究对象的早期肾功能。
2 结 果
2.1 研究对象的一般资料 共前瞻性收集到30例患者和20例健康儿童。30例患者中,有2例患者同时合并有肾脏和尿道畸形(其中1例诊断为脊柱侧凸、肾盂输尿管连接部狭窄并肾积水,该患者曾于5月龄时对输尿管连接部狭窄行手术治疗,治疗后肾积水消失,且患者本次肾脏影像学检查未见明显异常,因此将该患者归于尿路畸形组;另1例患者为左侧重复肾,与正常肾融合,同时合并双集合系统,但无开口异常,考虑到重复肾与正常肾融合,而输尿管开口无异常,因而把该患者归于肾脏畸形组)。合并尿道下裂、肾盂输尿管连接部狭窄的患儿均已在早期接受治疗。先天性椎体畸形合并泌尿系统畸形统计情况见表1。
按畸形的部位将30例患者分为肾脏畸形组16例、尿道畸形组14例。各组的人口统计学特征以及实验室基线数据见表2,其基线资料的比较未见有统计学差异。
2.2 血清一般肾功能指标 30例患者除体格检查发现手术瘢痕以及影像学表现外,均无泌尿系方面的临床症状。尿常规以及一般肾功能指标均未见明显异常。与健康对照组相比,肾脏畸形组与尿路畸形组的血清肌酐、尿素、胱抑素C以及eGFR均未见统计学差异(图1)。
2.3 早期肾功能指标 肾脏畸形组与尿路畸形组的mALB、α1-MG、β2-MG以及NAG浓度均高于健康对照组,仅mALB、α1-MG以及NAG浓度在3组之间具有统计学差异(图2A、2B和2D),而β2-MG浓度未见统计学差异(图2C)。与尿路畸形组相比,肾脏畸形组的mALB以及NAG浓度显著性增高,且存在统计学差异(图2A和2D)。
表1 先天性脊柱畸形合并泌尿系畸形的统计表
Tab.1 Summary of malformations in congenital spinal deformities children with urinary malformations

畸形类型畸形例数比例(%)椎体Ⅰ1446.67Ⅱ826.67Ⅲ826.67肾脏孤立肾723.33异位肾413.33马蹄肾26.67重复肾26.67异位融合肾13.33尿路尿道下裂516.67双集合系统26.67肾盂输尿管连接部狭窄310.00神经源性膀胱26.67膀胱输尿管反流13.33输尿管开口异位13.33
表2 研究对象的人口统计学特征及实验室基线数据
Tab.2 Demographic characteristics and laboratory baseline data of the subjects
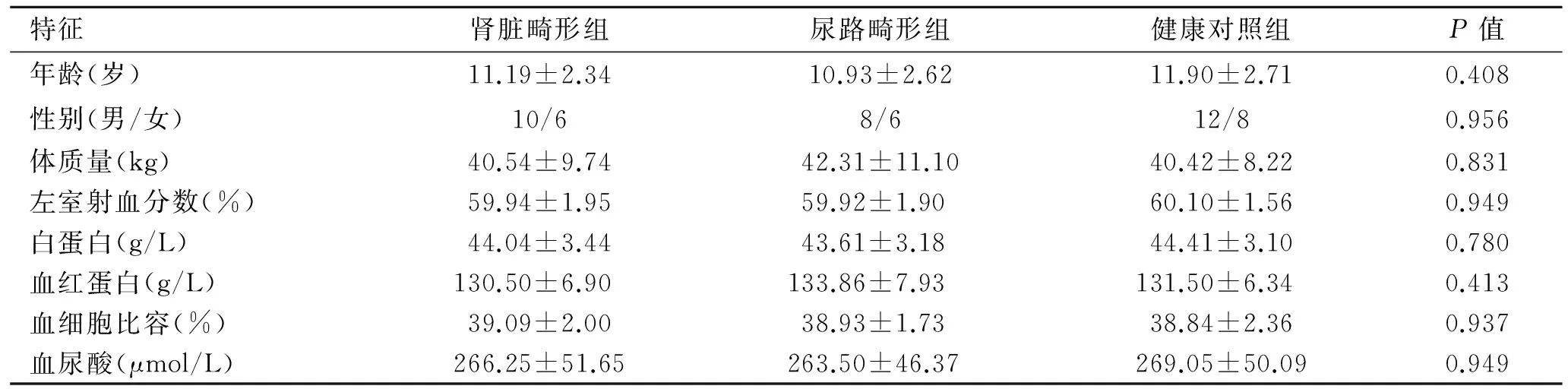
特征肾脏畸形组尿路畸形组健康对照组P值年龄(岁)11.19±2.3410.93±2.6211.90±2.710.408性别(男/女)10/68/612/80.956体质量(kg)40.54±9.7442.31±11.1040.42±8.220.831左室射血分数(%)59.94±1.9559.92±1.9060.10±1.560.949白蛋白(g/L)44.04±3.4443.61±3.1844.41±3.100.780血红蛋白(g/L)130.50±6.90133.86±7.93131.50±6.340.413血细胞比容(%)39.09±2.0038.93±1.7338.84±2.360.937血尿酸(μmol/L)266.25±51.65263.50±46.37269.05±50.090.949

图1 3组血清肾功能指标的比较
Fig.1 Comparison of serum renal function biomarkers in the three groups
3 讨 论
肾功能评估的金标准是注入技术,如菊粉、乙二胺四乙酸等的清除率[11-12],但该技术具有有创、费时、操作繁琐等缺点,尤其是针对年龄较小的儿童。血清肌酐、尿素、胱抑素C以及eGFR等是常用而且重要的评价患者肾功能状态的指标。研究报道:血清肌酐是最常应用、最重要的参数[12];血清胱抑素C水平是评价

图2 3组尿液的早期肾功能指标的比较
Fig.2 Comparison of early renal function biomarkers in urinary in the three groups
aP<0.05,肾脏畸形组与健康对照组比较;bP<0.05,肾脏畸形组与尿路畸形组比较;cP<0.05,尿路畸形组与健康对照组比较。除尿β2-MG外,其余3项指标组间比较具有统计学意义(P<0.05)。
肾脏功能更精确、更特异的指标,其水平代表着肾小球滤过率功能,且被认为比血清肌酐更敏感[13];而eGFR被普遍认为是评价肾功能最好的总体指标[14]。因此,我们选取以上指标来评价患者的一般肾功能。正常情况下,以上指标的内源性产生是一个常量,其血浆水平代表着肾小球滤过功能。当肾小球滤过功能发生损伤而下降时,该类指标浓度则上升。然而,以上指标的产生与生长发育、体质量、肌肉的发达程度具有显著的正向线性关系。因此,本研究选取年龄、性别、体质量等相近的健康儿童作为对照组,来消除以上因素对结果产生的影响。
肾脏畸形组、尿路畸形组与健康对照组相比,结果显示:血清肌酐、尿素、胱抑素C、血尿酸浓度以及eGFR 值无显著性差异,说明该类患者的一般肾功能情况良好。而且,所有患者均无泌尿系方面的症状。这可能就是该类患者早期在临床上被忽略,未进行有效随访,直至发生肾脏不可逆性损害时才被引起重视的原因。
近年来,越来越多的血清和尿标志物被用于评价肾脏早期功能,比如:中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾脏损伤分子-1(KIM-1)、白介素-18(IL-18)、尿胱抑素C、尿胎球蛋白A以及尿mALB、α1-MG、β2-MG以及NAG等[7,12,15]。KIM-1已被研究证实是一个比NAG等更加敏感的用于评价肾脏早期损伤的指标[16]。然而,以上指标如KIM-1、NGAL、IL-18以及尿胎球蛋白A在临床实践中并未得到广泛的应用。相反,mALB、α1-MG、β2-MG以及NAG等指标是临床上广泛应用且被广大学者所接受的用于评价早期肾脏功能的标记物。因此,我们选择以上尿液指标来评估先天性脊柱畸形合并先天性泌尿系畸形患者的早期肾功能损害情况。
尿mALB,分子量为69 kD,是用于评价早期肾小球功能最常用、最有价值的指标。本研究结果显示,所有研究对象的mALB均在正常范围内。然而,肾脏畸形组的浓度显著高于健康对照组,且存在统计学差异。出现该显著性差异的原因可能是:尿mALB主要是反映肾小球滤过膜的电荷选择性屏障功能,在该类患者中,肾小球的电荷选择性屏障损伤程度较轻,不足以引起尿mALB的病理性升高,但其浓度的升高造成了显著性差异。同时,本研究还显示:肾脏畸形组的mALB浓度显著高于尿路畸形组,而尿路畸形组与健康对照组之间无显著性差异,此差异可能是由于肾脏畸形患者更容易出现肾小球滤过膜的选择性电荷屏障的损害而造成。
尿α1-MG、β2-MG以及NAG等是临床上用于评价早期肾小管功能的重要指标。本研究结果表明:肾脏畸形组和尿路畸形组的尿α1-MG以及NAG浓度均显著高于健康对照组,且超出了生理值,说明先天性脊柱畸形合并先天性泌尿系畸形的患者,其肾小管已经发生了损害,且其损害先于肾小球功能的损害。类似的结论在一些急性或慢性肾脏损伤的患者中同样得到了证实[17-18]。
尿α1-MG、β2-MG均属于低分子量蛋白质,均可自由透过肾小球,且99%以上均被近端肾小管吸收。二者的排泄、吸收过程类似,但在本研究中,仅有尿α1-MG在3组间检测出显著性差异。分析原因可能如下[19-20]:①β2-MG稳定性差,易受尿pH值的影响,在尿液pH<6.0时,大部分被分解,尿液标本的收集、存储过程以及存储时间的长短均会影响到尿标本中的β2-MG浓度;②肾小管损伤时,对α1-MG的重吸收障碍通常优先于β2-MG的重吸收障碍;③尿β2-MG显著低于α1-MG浓度,在进行检测时灵敏性低,不易被检测。
本研究结果说明,先天性脊柱畸形合并先天性泌尿系统畸形的患者在早期就已出现肾脏功能损害。尽管所有患者都没有临床症状,但仍需临床医生和患者或家属重视,以避免30%~60%的CAKUT患者发展成儿童早发型慢性肾脏病以及儿童ESRD[8]。目前,临床上尚无可靠的指标来预测CAKUT患者是否会向终末期肾病进展,因此,加强随访、注意保护和及时干预可能是避免肾功能出现不可逆性损害的重要措施。
[1] BEAUREGARD-LACROIX E, TARDIF J, CAMURRI MV, et al. Retrospectiveanalysis of congenital scoliosis: Associated anomalies and genetic diagnoses[J]. Spine, 2017, 42(14):E841.
[2] PAHYS JM, GUILLE JT. What’s New incongenital scoliosis? [J]. J Pediatr Orthop, 2016.
[3] NICOLAOU N, RENKEMA KY, BONGERS EM, et al. Genetic, environmental, and epigenetic factors involved in CAKUT[J]. Nat Rev Nephrol, 2015, 11(12):720.
[4] 孙保胜,谢向辉,孙琳,等. 儿童先天性脊柱侧凸合并泌尿系畸形临床分析[J]. 临床小儿外科杂志, 2016, 15(6):562-565.
[5] SHEN J, WANG Z, LIU J, et al. Abnormalitiesassociated with congenital scoliosis: A retrospective study of 226 Chinese surgical cases[J]. Spine (Phila Pa 1976), 2013, 10:814-818.
[6] DOS SJA, DE MIRANDA DM, SIMOES ESA. Congenitalanomalies of the kidney and urinary tract: An embryogenetic review[J]. Birth Defects Res C Embryo Today, 2014, 4:374-381.
[7] NEPHROLOGY JSO. Evidence-Based Clinical Practice Guideline for CKD 2013[J]. Clini Exp Nephrol, 2014, 3:346-423.
[8] HARAMBAT J, VAN STRALEN KJ, KIM JJ, et al. Epidemiology of chronic kidney disease in children[J]. Pediatr Nephrol, 2012, 3:363-373.
[9] TIAN YL, LU H, LIN CY, et al. Incidence and risks of congenital anomalies of kidney and urinary tract in newborns: A population-based case-control study in Taiwan[J]. Medicine (Baltimore), 2016, 5: e2659.
[10] HEDEQUIST D, EMANS J. Congenital scoliosis[J]. J Am Acad Orthop Surg, 2004, 4:266-275.
[11] 彭纪临,刘莉,曹文富. 胱抑素C与慢性肾功能衰竭的相关研究进展[J]. 内蒙古中医药, 2016, 35(6):113-114.
[12] OLVERA-POSADA D, DAYARATHNA T, DION M, et al. KIM-1 is a potential urinary biomarker of obstruction: Results from a prospective cohort study[J]. J Endourol, 2016, 31(2).
[13] 刘莉娟,袁清茹,赵明中. 血清胱抑素C与肌酐在评估75岁以上老年慢性心衰患者预后中的价值[J]. 西安交通大学学报(医学版), 2017, 38(1):58-61.
[14] SUPPLEMENTS KI. Chapter 1: Definition and Classification of CKD[J]. Kidney Int Suppl, 2013, 3(1):19-62.
[15] DEVARAJAN P. Proteomics for the investigation of acute kidney injury[J]. Contrib Nephrol, 2008, 160:1-16.
[16] RUANGYUTTIKAM W, PANYAMOON A, NAMBUMEE K, et al. Use of the kidney injury molecule-1 as a biomarker for early detection of renal tubular dysfunction in a population chronically exposed to cadmium in the environment[J]. Springerplus, 2013, 2(1):1-8.
[17] ZHENG J, YAO Y, HAN L, et al. Renal function and injury in infants and young children with congenital heart disease[J]. Pediat Nephrol, 2013, 28(1):99-104.
[18] EOM SY, SEO MN, LEE YS, et al. Low-Level Environmentalcadmium exposure induces kidney tubule damage in the general population of Korean adults[J]. Arch Environ Contam Toxicol, 2017, 73(3):401-409.
[19] 黄琼莲,覃西,李浩,等. 尿α1-MG 检测对肾损害早期诊断的应用价值[J]. 临床误诊误治, 2014(7):87-89.
[20] SCHAUB S, WILKINS JA, ANTONOVICI M, et al. Proteomic-based identification of cleaved urinary beta2-microglobulin as a potential marker for acute tubular injury in renal allografts[J]. Am J Transplant, 2005, 5(4 Pt 1):729-738.
