RUNX3基因对RAW264.7巨噬细胞极化的调控作用
2018-02-27李苏童王娟红王琦侠姜小健田普训
李苏童,雷 洁,王娟红,王琦侠,申 远,姜小健,田普训
(1. 西安市中心医院肾病科,陕西西安 710003;2. 西安市中心医院病理科,陕西西安 710003; 3. 西安交通大学医学部统计教研室,陕西西安 710061;4. 西安市中心医院检验科, 陕西西安 710003; 5.西安交通大学第一附属医院肾脏病医院肾移植科,陕西西安 710061)
巨噬细胞作为重要的免疫细胞,广泛参与了机体免疫应答、炎症、组织重塑、衰老等多种病理生理过程,不同表型的巨噬细胞发挥不同的免疫学作用。既往研究已发现,巨噬细胞活化具有不均一性,可能有2种主要的极化模式:经典激活的巨噬细胞M1和替代激活的巨噬细胞M2。M1和M2在免疫过程中有不同的病理生理作用,可能通过巨噬细胞表面表达的一系列受体分子介导而发挥作用,其分子受体包括了活化性受体和抑制性受体[1]。转化生长因子(transforming growth factor β1, TGF-β1)通路广泛参与了巨噬细胞极化过程,而RUNX3是TGF-β1通路中的关键分子。RUNX3作为一种核转录因子,能够调节包括PIR-A/B在内的多种靶分子的转录与活化过程[2]。本研究通过沉默RAW264.7 RUNX3并检测细胞表面标志物和细胞分泌因子的变化,初步探讨RUNX3 在调节巨噬细胞极化状态中的作用。
1 材料与方法
1.1 材料 RAW264.7细胞系和mRTEC细胞系均购自武汉巴菲尔生物技术公司;胎牛血清购自Gibco公司;RPMI1640购自Gibco公司;羊抗鼠RUNX3多克隆抗体、兔抗鼠E-cadherin多克隆抗体、兔抗鼠α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)多克隆抗体、羊抗鼠β-actin单克隆抗体(mAb)购于Sigma公司;CD86、arginase-1、iNOS抗体购自BD公司;HRP标记的抗兔IgG、HRP标记的抗小鼠IgG购自北京中杉金桥公司;LipofectamineTM2000购自Invitrogen公司。
1.2 RAW264.7细胞培养及刺激分化和检测
1.2.1 RAW264.7细胞培养及刺激分化 将RAW264.7(细胞数1×104)接种至6孔板,用含100 mL/L胎牛血清的RPMI 1640培养液同步培养24 h,光学显微镜下观察照相;随机分为M1组、M2组及对照组(M0组),每组3孔。M1组刺激分化采用先加入IFN-γ(100 u/mL)刺激20 h,再追加LPS(100 μg/mL)刺激6 h;M2组刺激分化采用加IL-4(20 μg/mL)刺激26 h;对照组不更换培养液,同步化培养26 h,收取各组细胞进行后续分组培养和检测实验。
1.2.2 诱导生成的M1和M2 RAW264.7巨噬细胞中RUNX3的检测 采用免疫荧光法检测。将1.2.1中各组细胞按1×104接种至24孔板,同步化培养2 h,室温PBS液洗涤2次,多聚甲醛(1 mL/孔)固定20 min,PBS洗5 min×3次;加PBST室温孵育10 min;PBS洗涤5 min×3次;50 mL/L牛血清封闭1 h;加入兔抗鼠RUNX3单克隆抗体(1∶100)湿盒4 ℃过夜;吸除一抗,PBS洗5 min×3次;加入山羊抗兔荧光二抗(1∶50)室温孵育1 h;PBS洗5 min×3次;加入DAPI (1 μg/mL);避光5 min;PBS洗5 min×3次;抗淬灭封片剂封片,荧光显微镜照相。
1.2.3 RT-PCR检测各组细胞RUNX3 mRNA的表达 分别提取各组(M1、M2、M0组)细胞RNA并进行RT-PCR检测。内参GAPDH引物分别为,正义5′-AGCCTTCTCCATGGTGGTGAA-3′、反义5′-ATCACCATCTTCCAGGAGCGA-3′;RUNX3引物分别为,正义5′-GATGGCAGGCAATGACGA-3′,反义5′-TGCTGAAGTGGCTTGTGGT-3′,扩增条件:95 ℃ 3 min;95 ℃变性5 s,62 ℃退火20 s,72 ℃延伸12 s,45个循环。PCR产物进行分析。
1.2.4 RT-PCR检测M1组细胞iNOS和M2组细胞arginase-1 mRNA的表达 方法同1.2.3。iNOS引物分别为,正义5′-CCCTTCCGAAGTTTCTGGCAGCA-
GC-3′、反义5′-CCAAAGCCACGAGGCTCTGACAGCC-3′;arginase-1引物分别为,正义5′-CAGAAGAATGGAAGAGTCAG-3′、反义5′-GGTGA-
CTCCCTGCATATCTG-3′。
1.3 siRNA载体的构建及质粒转染 根据GenBank已知人RUNX3 基因序列设计siRNA:TGACGAGAACTACTCCGCT。合成编码发夹结构siRNA,正义链RUNX3-F:5′-GATCCTGACGA-GAACTACTCCGCTTTCAAGAGAAGCGGAGT-AGTTCTCGTCATTTTTTGGAAA-3′,反义链RUNX3-R:5′-AGCTTTTCCAAAAAATGACGA-GAACTACTCCGCTTCTCTTGAAAGCGGAGT-
AGTTCTCGTCAG-3′。据此序列合成双链DNA,55 ℃退火,16 ℃连接过夜,转化大肠杆菌,挑选菌落,碱裂解法提取质粒,进行酶切鉴定,扩增后得到重组质粒RUNX3-siRNA。
将正常培养的RAW264.7细胞(细胞数1×104)接种至6孔板,贴壁细胞达70%底板面积时进行转染。每孔加1 mL无血清DMEM,洗涤1次,弃去。100 mL无血清培养液稀释0.8~1.0 μg(6 μL)质粒作为空载体对照;100 mL无血清培养液稀释6 μL LipofectamineTM2000,室温下放置5 min后,将其与相应质粒混合,室温下放置30 min,将此混合物200 μL加入6孔板,每孔加入0.8 mL无血清培养液,培养6 h,每孔加入1 mL含250 mL/L胎牛血清的RPMI 1640培养液,继续培养24 h;然后加入G418选择性培养基(选用400 mg/L进行筛选)筛选转染克隆。沉默RUNX3基因的RAW264.7细胞系克隆株和正常培养的RAW264.7细胞分别命名为RAW264.7-siRUNX3和RAW264.7-cont,分别用RT-PCR法和Western blot检测RUNX3的表达情况以进行鉴定。RT-PCR方法同1.2.3;Western blot:用Bradford法测定各组蛋白浓度,每孔10 μL上样,100 g/L SDS聚丙酰胺凝胶电泳,半干法转至PVDF膜,丽春红染色标记,100 g/L脱脂奶粉室温封闭2 h,加50 g/L脱脂奶粉稀释的一抗(兔抗鼠RUNX3多克隆抗体,1∶200稀释),4 ℃过夜。TBST洗膜3次,每次10 min,加入50 mL/L脱脂奶粉稀释二抗(HRP标记的抗兔IgG,1∶400稀释),室温孵育2 h,洗膜3次,ECL显影。
1.4 ELISA法测定细胞培养上清液中的TNF-α水平 收集RAW264.7-siRUNX3和RAW264.7-cont组细胞上清液,按照ELISA试剂盒操作说明,测定各组细胞TNF-α的分泌水平,全自动酶标仪在450 nm 处读取吸光度值。
1.5 RT-PCR法测定转染克隆中iNOS和CD86的mRNA表达 分别提取各转染组细胞RNA并进行RT-PCR检测。方法同1.2.3。CD86引物分别为,正义5′-TCAGTCAGGATGGGAGTGGTA-3′,反义5′-ATCCAAGAGCCATTCCTACCT-3′。
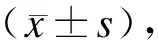
2 结 果
2.1 IFN-γ、LPS共刺激RAW264.7细胞iNOS的表达变化和IL-4刺激RAW264.7细胞arginase-1的表达变化 IFN-γ、LPS共刺激RAW264.7细胞24 h后提取总RNA,使用RT-PCR方法检测发现,与M0组(4.69±0.96)相比,M1组(1.13±0.25)iNOS表达明显减少(P=0.002);而通过IL-4刺激RAW264.7细胞24 h后arginase-1表达升高,分别为M0组(2.09±0.2),M2组(13.28±1.1) (P=0.021,图1)。这提示IFN-γ、LPS共刺激促进RAW264.7细胞向M1型巨噬细胞极化,而IL-4刺激RAW264.7细胞向M2型极化。

图1 INF-γ和LPS刺激或IL-4刺激RAW264.7细胞后iNOS和arginase-1的mRNA表达变化
Fig.1 The mRNA expressions of iNOS and arginase-1 in RAW264.7 cells stimulated by INF-gamma and LPS or stimulated by IL-4
与对照组(RAW264.7组)相比,*P<0.05。
2.2 各组细胞(M0、M1、M2)RAW264.7 RUNX3的表达
2.2.1 各组细胞RUNX3免疫荧光染色结果 荧光显微镜下观察到,M1组细胞呈多边形,触角较多,细胞较大;而M2组细胞较小,形状偏圆形,触角较少;RUNX3是一种核转录因子,主要表达于RAW264.7核膜部位;与M0组比较,M2组荧光较弱,而M1组荧光较强,并且M1组RUNX3荧光明显较M2组亮(图2)。
2.2.2 各组细胞RUNX3 mRNA的检测结果 与M0组(0.86±0.08)相比,M1组RUNX3 mRNA表达增高(1.16±0.37)(P=0.001),M2组表达相比降低(0.53±0.1)(P=0.041),而M1较M2组RUNX3 mRNA高表达(P<0.001,图3)。
2.3 RUNX3低表达细胞模型的建立 经过细胞转染和G418培养筛选,获得细胞系RAW264.7-siRUNX3和 RAW264.7-cont。PCR结果显示,RUNX3在RAW264.7-siRUNX3细胞中的表达(0.26±0.06)低于RAW264.7-cont组细胞(0.86±0.07);Western blot检测结果显示,RUNX3在RAW264.7-siRUNX3细胞中的表达低于RAW264.7-cont组细胞(图4)。提示获得稳定转染的低表达RUNX3的RAW264.7 细胞系。
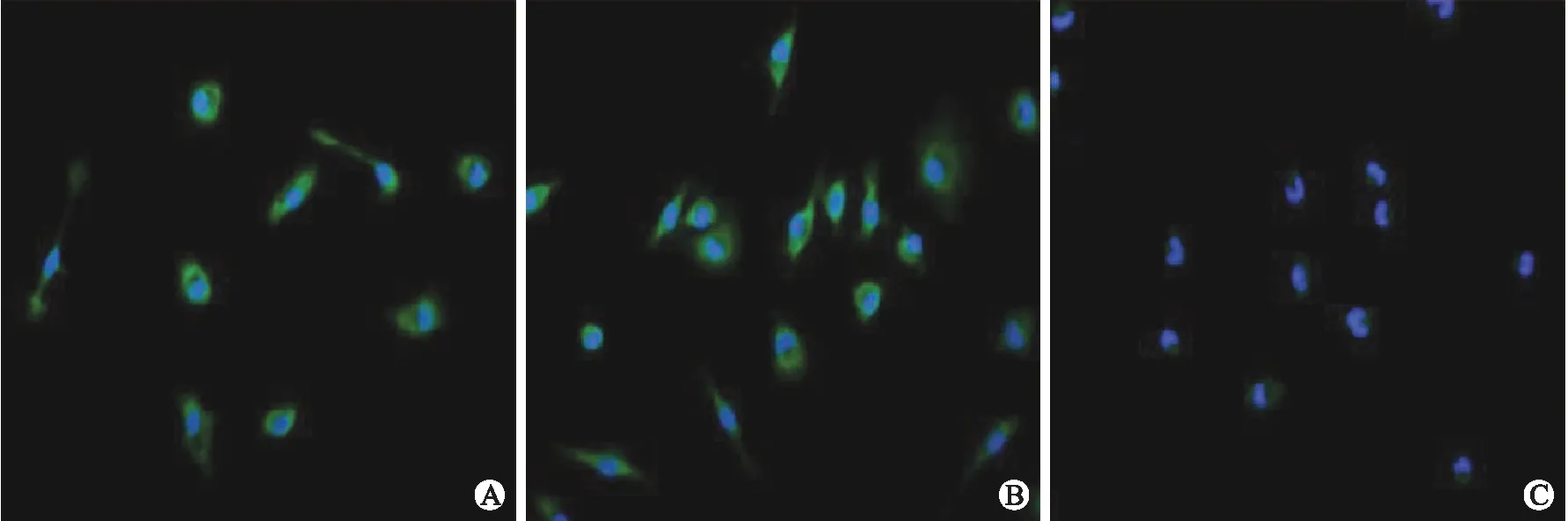
图2 M1型和M2型巨噬细胞RUNX3免疫荧光染色结果
Fig.2 RUNX3 immunofluorescence staining results of M1 and M2 macrophages (×400)
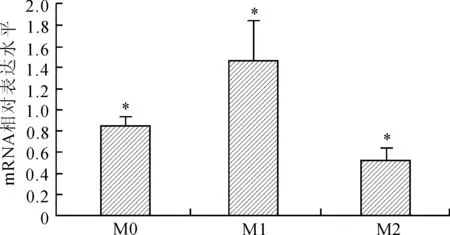
图3 M1型和M2型巨噬细胞RUNX3 mRNA的表达
Fig.3 RUNX3 mRNA expressions in M1 and M2 macrophages
RUNX3 mRNA水平在M1中表达最高(P=0.001),M0中表达水平次之,而M2中表达最低(P=0.041),差异均具有统计学意义。

图4 PCR和Western blot检测RUNX3-siRNA转染后RAW264.7中RUNX3的mRNA(A)和蛋白(B)表达
Fig.4 mRNA and protein expressions of RUNX3 in RUNX3-siRNA transfected RAW264.7 detected by PCR (A) and Western blot (B)
与RAW264.7-cont组比较,P<0.05(P=0.036)。
2.4 RAW264.7-siRUNX3抑制RAW264.7细胞 iNOS和CD86 mRNA表达 RAW264.7-siRUNX3组iNOS(0.61±0.13)较RAW264.7-cont表达降低(2.96±0.19)(P<0.001);CD86 mRNA表达(0.67±0.09)较RAW264.7-cont组降低(4.72±0.38)(P=0.005,图5)。

图5 RAW264.7-siRUNX3抑制RAW264.7 iNOS(A)和CD86(B)mRNA的表达
Fig.5 RAW264.7-siRUNX3 inhibited the mRNA expressions of RAW264.7 iNOS (A) and CD86 (B)
与RAW264.7-cont组相比,RAW 264.7-siRUNX3组细胞iNOS(P<0.001)和CD86(P=0.005)表达明显下降,差异具有统计学意义。
2.5 RUNX3低表达RAW264.7分泌的TNF-α变化 与RAW264.7-cont组(55.11±4.32)相比,RAW264.7-siRUNX3组培养液中TNF-α含量(34.8±4.29)较低(P<0.001,图6),这说明RUNX3低表达抑制了TNF-α的分泌。
3 讨 论
巨噬细胞是具有高度异质性的固有免疫细胞,其激活形式多种多样,称为巨噬细胞极化(polarization),不同极化方式的巨噬细胞发挥着完全不同的免疫学作用。现有的研究将巨噬细胞分为经典活化型(M1)和选择活化型(M2)。在不同的微环境下M0可分化成为M1或者M2,发挥不同的免疫作用。M1型巨噬细胞吞噬细菌,释放炎症因子,促进炎症反应发生;而M2型巨噬细胞抑制炎症,促进组织修复。不同的信号通路以及多种信号转导因子、转录活化因子、干扰调节因子、核因子、激活蛋白等都参与了巨噬细胞极化过程。近些年的研究证实Wnt信号通路除了在传统胚胎发育和内环境稳定中发挥重要作用以外,还参与了多种炎症性疾病的免疫调节[3]。Wnt信号通路同样也参与了巨噬细胞极化过程,研究结核病的学者们发现Wnt6上调能够促进巨噬细胞向M2方向极化[4];而Wnt5a低表达也能够促进巨噬细胞向M2方向极化[5]。动物来源的原代巨噬细胞增殖困难,不利于进行基因敲除等实验研究,因此,本研究选用巨噬细胞细胞系RAW264.7作为分子生物学研究对象,并在实验中证实了IFN-γ和LPS刺激促进RAW264.7细胞向M1亚型极化,而IL-4促进RAW264.7细胞向M2亚型极化,这与其他学者的研究结果相符合。
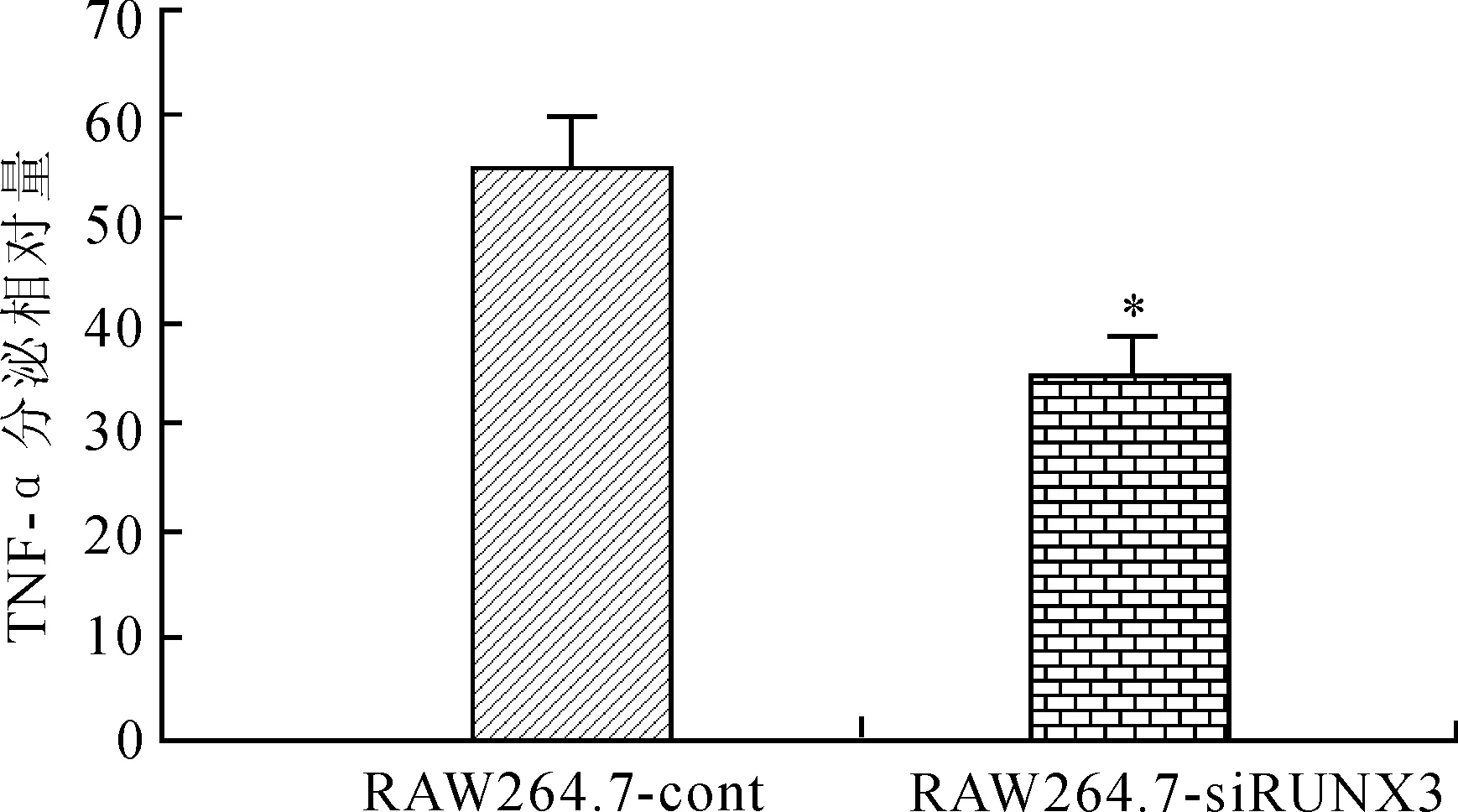
图6 RUNX3低表达抑制RAW264.7 TNF-α分泌
Fig.6 The low expression of RUNX3 inhibited the TNF-α secretion in RAW264.7
与RAW264.7-cont比较,*P<0.001。
RUNX3属于转录因子中runt结构域家族,是一种器官组织发育过程中重要的核转录因子;RUNX3能够调控多种基因表达,并且参与了Wnt信号通路调节过程。在胃癌相关的研究中,有学者认为RUNX3能够通过调控TCF4/β-catenin结合而正向或者负向调控Wnt通路激活[6]。本研究通过免疫荧光实验直观观察到RUNX3在RAW264.7刺激极化形成的M1和M2细胞中表达的强弱不同,而通过RT-PCR的定量结果,也证实了RUNX3在RAW264.7刺激极化形成的M2细胞中表达高于M1。PIR-B是RUNX3的靶分子之一,在B淋巴细胞中,RUNX3和PU.1共同调控B细胞表面PIR-B受体的表达;PIR-B是表达在多种免疫细胞表面的抑制性受体。研究证实,M1型巨噬细胞表面PIR-B受体表达显著降低,而M2型巨噬细胞表面PIR-B受体
表达明显增高[7];另有研究证实RUNX3在巨噬细胞极化的过程中调节粘附分子的表达[8];而TGF-β、Wnt通路明确参与了巨噬细胞极化过程,而RUNX3与巨噬细胞极化是何种关系尚不清楚。对此,本研究敲除了RAW264.7巨噬细胞的RUNX3基因,建立了RUNX3低表达细胞模型,通过RT-PCR发现在RAW264.7细胞表面M2型巨噬细胞的表面标记分子iNOS和CD86 mRNA表达有所下降;虽然与对照组相比TNF-α的分泌量显著下降,但仍有部分分泌量,这表明,敲除了RUNX3的巨噬细胞有向M1方向极化的趋势,RUNX3可能部分参与了巨噬细胞极化的过程。不同类型的巨噬细胞在纤维化消解、创伤修复、移植免疫排斥、炎症反应等多种病理生理过程中发挥着截然不同的重要作用,调节巨噬细胞极化是治疗脏器纤维化、创伤修复、自身免疫性及炎症性疾病新的重要切入点,本研究为这些疾病治疗提供了可能的新靶点。
[1] MARTINEZ FO. Regulators of macrophage activation[J]. Eur J Immunol, 2011, 1(6):1531-1534.
[2] DONG CS, ZHAO GP, ZHONG M, et al. RNA sequencing and transcriptomal analysis of human monocyte to macrophage differentiation[J]. Gene, 2013, 519(2):279-287.
[3] ZHOU D, HUANG C, LIN Z, et al. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J]. Cell Signal, 2014, 26(2):192-197.
[4] SCHAALE K1, BRANDENBURG J, KISPERT A, et al. Wnt6 is expressed in granulomatous lesions of mycobacterium tuberculosis-infected mice and is involved in macrophage differentiation and proliferation[J]. J Immunol, 2013, 191(10):5182-5195.
[5] CHEN D, LI G, FU X, et al. Wnt5a deficiency regulates inflammatory cytokine secretion, polarization, and apoptosis in mycobacterium tuberculosis-infected macrophages[J]. DNA Cell Biol, 2017, 36(1):58-66.
[6] JU X, ISHIKAWA TO, NAKA K, et al. Context-dependent activation of Wnt signaling by tumor suppressor RUNX3 in gastric cancer cells[J]. Cancer Sci, 2014, 105(4):418-424.
[7] ARITA K, ENDO S, KAIFU T, et al. Transcriptional activation of the Pirb gene in B cells by PU.1 and Runx3[J]. J Immunol, 2011,186(12):7050-7059.
[8] ESTECHA A, AUILERA-MONTTILLA N, SANCHEZ-MATEOS P. RUNX3 regulates intercellular adhesion molecule 3 (ICAM-3) expression during macrophage differentiation and monocyte extravasation[J]. PLoS One, 2012;7(3):e33313.
