肠系膜淋巴管结扎对脓毒症相关肺脏损伤及 肠道损伤的作用
2018-02-27张靖垚毕建斌刘苏顺
张靖垚,毕建斌,刘苏顺,庞 青,刘 昌
(西安交通大学第一附属医院:1. 肝胆外科;2. 外科ICU,陕西西安 710061)
脓毒症(sepsis)常常继发于烧伤、外伤、手术创伤、休克及感染等临床情况,早期得不到及时妥善处理,进一步发展可导致多器官功能障碍综合征(MODS)甚至死亡[1]。肠道是大多腹腔感染所致脓毒症的始动器官,肠壁的缺血、缺氧及再灌注损伤,可以导致肠道屏障的破坏,进而引起肠道菌群移位及内毒素扩散,通过血液系统、淋巴系统、直接扩散等途径引起菌血症,最终导致全身感染[2-3]。肺脏因其特殊解剖结构,毛细血管网丰富,成为脓毒症最易受损的器官,早期即可出现急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)[4]。近年来随着科技的发展及医疗进步,对于脓毒症的认识越来越深入,但是针对脓毒症的治疗尚未取得突破性进展,因此寻找新的或者辅助的临床治疗手段非常重要。已有研究表明,肠淋巴途径在MODS中发挥重要作用,阻断休克时肠淋巴液回流可减轻大鼠肺、心、肾、肝等重要器官的炎症反应及器官损伤程度[5];也有研究发现,肠系膜淋巴管结扎(mesenteric lymph duct ligation, MLDL)可以减轻休克大鼠的肝损伤[6];最新的研究也表明其对热射病所致的肺损伤有保护作用[7]。但是MLDL在脓毒症所致的器官损伤中的作用尚未见报道。本研究即重点探讨MLDL后阻断肠淋巴液回流对盲肠结扎穿孔(cecal ligation and puncture, CLP)所致大鼠脓毒症的肺脏及肠道损伤的作用。
1 材料与方法
1.1 实验动物及分组 清洁级Sprague Dawley雄性大鼠45只,购自西安交通大学医学部动物实验中心,体质量220~260 g。本研究将实验大鼠随机分为假手术对照组(Sham组,n=15)、脓毒症组(CLP组,n=15)和MLDL组(CLP+MLDL组,n=15)。各组大鼠于CLP造模24 h后再次使用戊巴比妥钠全身麻醉,开腹游离腹主动脉并采集动脉血进行相应指标检测;同时收集距离回盲部约10 cm处的近端回肠组织及肺脏组织,行相应的病理及生化指标检测。
1.2 模型制备及干预
1.2.1 脓毒症大鼠模型的制备 采用CLP法建立脓毒症大鼠模型[8]:腹腔注射20 g/L戊巴比妥钠50 mg/kg 麻醉大鼠后,沿腹部正中线切3 cm长切口,开腹、暴露盲肠,在距盲肠根部1/2处结扎盲肠,用21G针头穿刺盲肠1次,挤出少量肠内容物,还纳盲肠并缝合切口。Sham组只开腹进行盲肠探查、不结扎穿孔,术后给予大鼠皮下注射生理盐水30 mL/kg 补液;MLDL组于CLP造模时行MLDL操作;CLP组于CLP造模时暴露肠系膜淋巴管(mesenteric lymph duct, MLD),未予结扎,术后给予等量液体补液。
1.2.2 MLDL处理 腹腔注射20 g/L戊巴比妥钠50 mg/kg麻醉大鼠后,沿腹部正中线切3 cm长切口,打开腹腔,轻轻推开肠管,暴露肠系膜根部,游离肠系膜上动脉(superior mesenteric artery, SMA),仔细分离与SMA相伴行的MLD,在MLD下穿线结扎[9]。
1.3 肺泡灌洗液的收集 根据刘彦[10]的报道采用在体全肺肺灌洗法收集支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)。将7号塑料输液管的针头端剪掉,留出约3 cm长的一段输液管,将该段输液管的一端套在5 mL注射器上,暴露大鼠气管,在气管上剪一小切口,将输液管插入气管腔内,并用缝线固定。将2 mL、37 ℃无菌生理盐水缓慢注入肺内,间隔30 s后,将其抽回,如此进行3次,共收集到BALF约5 mL,1 500 r/min、4 ℃离心10 min,将离心沉淀的细胞团用0.3 mL生理盐水悬浮,制成细胞悬液。
1.4 动脉血气分析 将收集的动脉血采用ALB5型全自动血气分析仪检测动脉血氧分压(PaO2)。
1.5 肺脏及肠道组织的HE染色 将部分切取的肺脏及回肠组织,用40 g/L中性甲醛固定,进行常规HE染色,在光学显微镜下进行病理组织学观察。
1.6 急性肺损伤(ALI)评分及肠道Chiu’s评分 根据FALLER等[11]的方法评估大鼠的ALI评分及CHIU等[12]的方法评估大鼠的肠道损伤。
1.7 BALF中炎症因子、细胞及总蛋白水平的检测 根据ELISA检测试剂盒说明书指示,测定BALF中TNF-α、IL-6及总蛋白的含量;用Neubauer Chamber
方法测定BALF中细胞总数及分类[13]。
1.8 血液D-乳酸的检测 根据ELISA检测试剂盒说明书指示,测定血液中D-乳酸含量。
1.9 肠道组织二胺氧化酶(DAO)的检测 根据南京建成购买的生化试剂盒说明书指示,检测肠道组织DAO的含量。
1.10 细菌负荷实验 取血液组织(1 mL)、肺脏(1 g) 及回肠组织(1 g)称重切碎后再匀浆,加9 g/L生理盐水连续稀释成不同倍数的稀释液,取各种不同倍数的稀释液分别定量滴入血琼脂培养基内,37 ℃培养24~48 h,采用平板活菌计数法读出菌落数,并根据组织重量和稀释倍数计算出每毫升组织悬液中的细菌数。
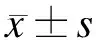
2 结 果
2.1 MLDL减轻脓毒症大鼠的肺损伤 CLP造模后的脓毒症大鼠可表现出不同程度的精神差、毛发湿冷倒立、反应迟钝、活动减少以及脱水等临床表现。在大鼠麻醉恢复后,经过MLDL处理的大鼠可更快地从脓毒症打击中恢复,其活动能力明显强于CLP组大鼠。大鼠肺脏组织的HE染色可见,CLP组大鼠肺组织内可见大量肺泡组织破裂、结构紊乱,大量炎性细胞浸润,肺实变严重;MLDL组大鼠肺组织内则可见少量炎性细胞浸润,散在的肺泡壁充血、增厚,但肺实变明显减轻,肺泡组织结构较完整(图1A)。血气分析结果显示,MLDL可明显改善脓毒症大鼠的氧合状况,提升PaO2(图1B);通过统计各组大鼠的肺脏湿/干比,提示MLDL可以减轻脓毒症时肺水肿、出血及充血情况(图1C)。综合各组大鼠临床及病理学特点,计算ALI评分,发现MLDL可以明显降低脓毒症大鼠的肺损伤评分(图1D)。
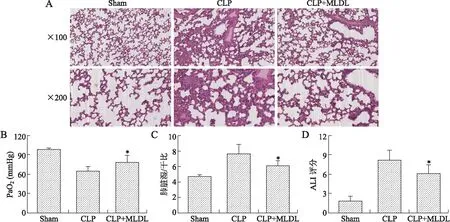
图1 MLDL对脓毒症大鼠肺损伤的影响
Fig.1 Mesenteric lymph duct ligation (MLDL) alleviated sepsis-induced lung injury in rats
A:大鼠肺脏组织的HE染色;B:PaO2水平;C:肺脏湿/干比;D:ALI评分。Sham:假手术对照组,CLP:脓毒症组,CLP+MLDL:MLDL处理组。与CLP组比较,*P<0.05。
2.2 MLDL降低脓毒症大鼠BALF中炎症因子、蛋白及细胞外溢水平 CLP造模24 h后收集各组大鼠的BALF,首先通过ELISA方法检测了炎症因子TNF-α和IL-6的水平,评估肺部局部炎症水平。结果显示,MLDL可以明显减少BALF中TNF-α和IL-6的水平(图2A、2B)。检测灌洗液中细胞及蛋白的水平,以评估肺泡的渗出情况,结果显示,MLDL可以明显减少BALF中细胞总数及总蛋白水平(图2C、2D)。
2.3 MLDL对脓毒症大鼠肠道无明显保护作用 大鼠处死后取距离回盲部约10 cm处的回肠组织行HE染色,结果显示,CLP组大鼠小肠绒毛结构破坏明显,炎性细胞大量聚集在黏膜及黏膜下层,而MLDL处理组大鼠的小肠组织病理与CLP组未见明显异常(图3A)。通过计算大鼠Chiu’s评分(图3B),检测血液D-乳酸(图3C)及肠道组织DAO的水平(图3D),结果表明MLDL对脓毒症大鼠的肠道损伤无明显保护作用。

图2 MLDL对脓毒症大鼠肺泡灌洗液中的炎症因子(A、B)、细胞总数(C)及蛋白水平(D)的影响
Fig.2 Mesenteric lymph duct ligation (MLDL) decreased bronchoalveolar lavage fluid (BALF) inflammatory cytokines, total cells and protein levels in septic rats
Sham:假手术对照组,CLP:脓毒症组,CLP+MLDL:MLDL处理组。与CLP组比较,*P<0.05,#P<0.01。

图3 MLDL对脓毒症肠道损伤的影响
Fig.3 Mesenteric lymph duct ligation (MLDL) had no effect on sepsis-induced intestinal injury in rats
A:回肠组织的HE染色结果;B:Chiu’s评分;C:D-乳酸水平;D:DAO水平的影响。Sham为假手术对照组,CLP为脓毒症组,CLP+MLDL为MLDL处理组。
2.4 MLDL降低脓毒症大鼠血液及肺脏组织的细菌负荷,但对肠道中的细菌水平无明显影响 CLP造模24 h后收集各组大鼠的血液、肺脏及肠道标本,制成10%的匀浆后检测上述3种组织中的细菌负荷水平。结果显示,MLDL可以明显降低脓毒症大鼠血液及肺脏组织中的细菌负荷水平,但是对大鼠肠道组织的细菌水平则无明显影响,甚至有加重细菌负荷趋势(图4)。
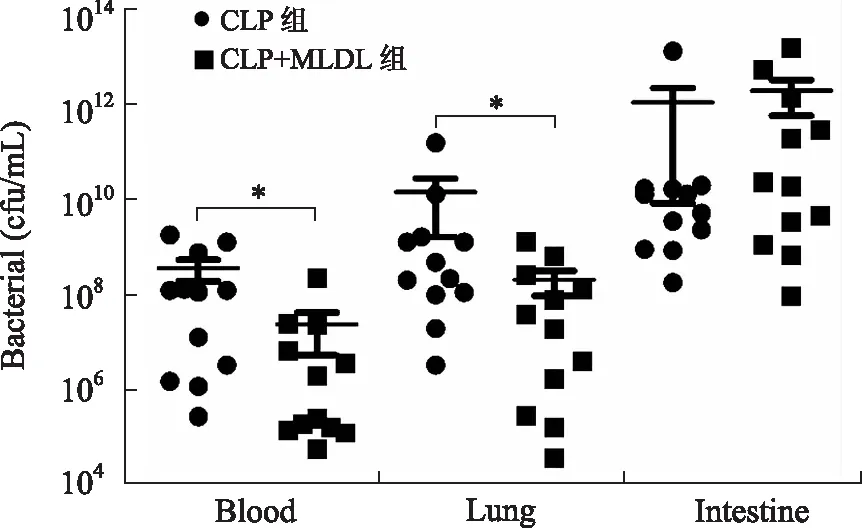
图4 MLDL对脓毒症大鼠血液、肺脏及肠道组织细菌负荷的影响
Fig.4 Effect of mesenteric lymph duct ligation (MLDL) on bacterial load of the blood, lung and intestines
CLP为脓毒症组,CLP+MLDL为MLDL处理组,血液(blood)、肺脏(lung)及肠道(intestine)。*P<0.01。
3 讨 论
脓毒症是感染引起的宿主反应失调所致的致命性器官功能障碍,是感染诱发的全身机体生理、病理及功能的异常综合表现,全球每年约有数百万人患脓毒症,近年来越来越受到临床医生及科学家的关注[1,14]。脓毒症时致病因子可激活炎症细胞产生、表达和过度释放细胞因子和炎症介质,启动炎症瀑布连锁反应,通过激活中性粒细胞、损伤内皮细胞,释放氧自由基、脂质代谢产物及溶酶体酶,引起机体微循环障碍、凝血机制紊乱及细胞凋亡等机体病理变化[15]。腹腔感染所致脓毒症时,由于肠屏障功能损伤、肠源性内毒素血症和肠道细菌移位,可引起远隔器官如肺脏、肝脏、心脏等的功能损害。肠道屏障功能障碍致肠道内细菌/内毒素移位(bacteria/endotoxin translocation, BET)所引起的肠源性感染,是脓毒症发展为MODS的始动环节[16-17]。
随着学者们对肠源性BET的肠淋巴途径研究逐渐深入,发现肠淋巴液回流在脓毒症进展中的重要作用,深入揭示其作用机制成为危重病医学领域的研究热点[18]。腹膜组织存在丰富的毛细淋巴管网,脏层腹膜,尤其是消化管表面的毛细淋巴管和淋巴管网共同形成淋巴管丛,发出集合淋巴管注入局部淋巴结,MLD是一个主要的流出通道。在脓毒症情况下,腹腔内脏器所吸收的有害物质及细菌也会通过MLD转运。研究证实,腹膜的毛细淋巴管对一些大分子物质具有一定的吸收作用[19]。本研究表明,脓毒症大鼠的肺损伤(肺脏病理、PaO2,肺脏湿/干比、肺泡灌洗液中的炎症因子、细胞及蛋白外溢)显著重于Sham组,但MLDL组大鼠的上述指标均显著轻于CLP组,提示MLDL使淋巴液断流,可以减少甚至抑制腹腔内的细菌及内毒素进入淋巴循环,对肺脏功能具有一定的保护作用。
同时,肠道是腹腔感染所致脓毒症时TNF-α的重要细胞来源。内毒素刺激肠黏膜肥大细胞释放大量的TNF-α,进而可以激活补体及巨噬细胞,释放大量的炎症介质和细胞因子,如IL-6及IL-8等,启动免疫细胞、细胞因子、炎症介质所构成的炎性反应系统和细胞因子网络,促进全身炎症反应综合症MODS的发生[16]。本研究结果显示,MLDL组肺泡灌洗液中的TNF-α及IL-6水平均明显低于CLP组,其原因,一方面可能是MLDL可以“直接”阻断并减少了脓毒症时炎症因子从淋巴途径向肺脏的扩散;另一方面,也可能是对“因肠道向肺脏扩散的细菌及毒素引起的肺损伤”所致的继发炎症反应的抑制作用。由于微淋巴管具有主动吸收大分子物质的功能,结扎肠系膜淋巴管可能阻断了TNF-α等细胞因子及炎症介质自腹腔及肠的吸收和转运。通过对肺脏组织的通透性检测,MLDL也可以减轻肺部损伤时的通透性,综合考虑,这种“减轻通透性的作用”可能是继发于减少了脓毒症时肺部的细菌感染时造成的损伤,为一个“继发性”保护作用。总的来说,MLD对于肺脏的保护作用,其“直接”机制为减少了脓毒症时腹部细菌往肺部的扩散,“间接”机制为减轻了肺部的炎症及肺泡通透性。
然而,通过对肠道的病理学以及屏障功能相关的指标检测,发现MLDL对其无保护作用,这一点与之前研究结果不同。我们又检测了血液、肺脏及肠道组织内的细菌水平,发现MLDL可以减少血液及肺脏等“远隔脏器”的细菌含量,但是肠道内的细菌水平无明显变化,甚至有增加的趋势,我们考虑结扎MLD可以阻断来自肠道及腹膜的淋巴流,使得脓毒症产生的有害物质及细菌,难以轻易地经MLD播散全身,但是这些被阻断的有害物质可能会在肠道及肠系膜淋巴结内积聚,进而引起甚至加重肠道损伤。
淋巴学研究虽然在组织液回流、维持体液稳态、机体免疫、肿瘤转移及淋巴水肿等方面有了很大进展,但和血液学相比,淋巴学的基础理论和临床应用研究长期以来发展甚为缓慢[19-20]。本研究结果表明,淋巴微循环在脓毒症的发病过程中有重要作用,MLDL可阻断细菌经肠系膜淋巴液运输,有效地降低炎症因子及细菌往肺部的释放,对脓毒症大鼠的肺损伤有显著的保护作用,减轻肺脏的功能障碍和形态损伤。但是其对于肠道损伤的作用则可能需要进一步的研究,因为目前的研究结果表明这种操作甚至可能会加重肠道的损伤,加重细菌在肠道组织内的积聚。因此,需要综合考虑此种手术操作的利弊,如何能规避肠道损伤是下一步研究的重点及难点。
[1] SINGER M, DEUTSCHMAN CS, SEYMOUR CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8):801-810.
[2] FAY KT, FORD ML, COOPERSMITH CM. The intestinal microenvironment in sepsis[J]. Biochim Biophys Acta, 2017, 1863(10 PtB):2574-2583.
[3] DEITCH EA. Gut-origin sepsis: Evolution of a concept[J]. Surgeon, 2012, 10(6):350-356.
[4] KIM WY, HONG SB. Sepsis and acute respiratory distress syndrome: Recent update[J]. Tuberc Respir Dis (Seoul), 2016, 79(2):53-57.
[5] 赵自刚,牛春雨,张静,等. 肠系膜淋巴管结扎对MODS大鼠的器官保护作用[J]. 中国病理生理杂志, 2005, 21(2):308-313.
[6] 赵自刚,牛春雨,张静,等. 肠淋巴途径在大鼠休克致肝脏炎症反应中的作用[J]. 中国危重病急救医学, 2008, 20(7):385-389.
[7] TONG H, CHEN R, YIN H, et al. Mesenteric lymph duct ligation alleviating lung injury in heatstroke[J]. Shock, 2016, 46(6):696-703.
[8] LILLEY E, ARMSTRONG R, CLARK N, et al. Refinement of animal models of sepsis and septic shock[J]. Shock, 2015, 43(4):304-316.
[9] 刘春艳. 肠系膜淋巴管结扎对急性失血大鼠血液流变性的影响[D]. 石家庄:河北医科大学, 2009.
[10] 刘彦,杜海科,高默杰,等. 染矽尘大鼠早期肺组织的病理学与支气管肺泡灌洗液炎性细胞的关系[J]. 武警医学院学报, 2003, 12(5):332-335.
[11] FALLER S, FOECKLER M, STROSING KM, et al. Kinetic effects of carbon monoxide inhalation on tissue protection in ventilator-induced lung injury[J]. Lab Invest, 2012, 92(7):999-1012.
[12] CHIU CJ, MCARDLE AH, BROWN R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970, 101(4):478-483.
[13] ROGERIO AP, FONTANARI C, BORDUCCHI E, et al. Anti-inflammatory effects of Lafoensiapacari and ellagic acid in a murine model of asthma[J]. Eur J Pharmacol, 2008, 580(1-2):262-270.
[14] RHODES A, EVANS LE, ALHAZZANI W, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3):304-377.
[15] CHONG DL, SRISKANDAN S. Pro-inflammatory mechanisms in sepsis[J]. Contrib Microbiol, 2011, 17:86-107.
[16] ATTAR N. Bacterial pathogenesis: Gut bugs in the lung link sepsis to ARDS[J]. Nat Rev Microbiol, 2016, 14(9):546.
[17] HAAK BW, WIERSINGA WJ. The role of the gut microbiota in sepsis[J]. Lancet Gastroenterol Hepatol, 2017, 2(2):135-143.
[18] 张萍. 肠-淋巴液途径在大鼠脓毒症发病机制中的作用及淋巴液差异蛋白质组学研究[D]. 上海:第二军医大学, 2013.
[19] 刘执玉. 淋巴学[M]. 北京:中国医药科技出版社, 1996.
[20] CABRERA-PEREZ J, BADOVINAC VP, GRIFFITH TS. Enteric immunity, the gut microbiome, and sepsis: Rethinking the germ theory of disease[J]. Exp Biol Med (Maywood), 2017, 242(2):127-139.
