单侧卵巢子宫内膜异位囊肿术后GnRHa联合反向添加疗法对卵巢储备功能的影响
2018-02-27王晓静刘春华
周 密 王晓静 刘春华 席 岚
陕西省宝鸡市妇幼保健院(721000)
子宫内膜异位症(EMs)是育龄期妇女常见病与高发病[1],病变广泛且形态各异,累及卵巢的子宫内膜异位囊肿较常见,又称为卵巢子宫内膜异位囊肿,临床治疗多主张采用腹腔镜下囊肿剥除术[2]。由于卵巢子宫内膜异位囊肿自身具有浸润性,囊肿占位效应可引起卵巢结构损伤,病灶与正常卵巢皮质之间粘连充血,导致界限层次不清,实施手术剔除时容易损伤正常卵巢组织,导致术后卵巢储备功能下降[3]。相关研究发现,单侧卵巢子宫内膜异位囊肿术后卵巢功能的变化较双侧手术轻,但术后是否需要巩固用药及用药方案的选择目前尚存争议[4]。抗苗勒管激素(AMH)能较准确反映卵巢储备功能[5]。本研究观察了单侧卵巢子宫内膜异位囊肿腹腔镜保守手术后应用促性腺激素释放激素类似物 (GnRHa)联合反向添加疗法的效果,并观察了血清AMH及卵巢性激素水平变化。
1 资料与方法
1.1 研究对象
选取2014年1月—2016年3月本院拟行腹腔镜保守手术治疗的单侧卵巢子宫内膜异位囊肿患者150例作为研究对象。纳入标准:①经病理证实为累及单侧卵巢子宫内膜异位囊肿;②年龄18~45岁;③自愿要求保留生育功能且具有腹腔镜保守手术指征;④美国生育学会(AFS)修正分期为Ⅲ~Ⅳ期。排除标准:①术前3个月内使用雌孕激素及接受其他内分泌治疗者;②合并糖尿病、高血压、恶性肿瘤、自身免疫性疾病及严重心、脑、肝、肺、肾等脏器功能障碍或疾病者;③术前发现生殖器官发育异常、生殖器官急性炎症者;④既往EMS手术史、卵巢输卵管手术史者;⑤既往血栓栓塞病史者;⑥伴发不明原因性子宫出血者。脱落标准:①术后出现严重并发症需紧急处理者;②用药期间退出或自愿要求停药者;③随访资料不完整或其他因素影响临床评估者。患者按随机数字表法分为3组,各50例。观察期间退出或脱落共7例,总脱落率4.7%(7/150),3组最终有效样本数依次46例、48例、49例。本研究获得医院伦理委员会审核批准。所有患者均自愿参与本次临床试验,均签署知情同意书。
1.2 手术方法
3组患者均在月经干净后3~7d,在全身麻醉下由同一医生主持手术。常规腹腔镜下切除囊肿。采用3-0微乔缝线进行连续缝合,以重塑卵巢形态。创面均涂抹透明质酸钠以预防粘连。不孕患者实施输卵管美蓝通液术评价输卵管通畅性,如合并输卵管伞端粘连闭锁,实施输卵管造口术。
1.3 术后治疗
①单纯手术组术后常规应用抗生素治疗3~5d,不予以其他药物巩固治疗。②GnRHa组在抗生素治疗基础上,于术后3~5d或恢复月经3d内,应用GnRHa经腹部皮下注射,3.6mg/次,每28d注射1次,共注射3次。③反向添加组在前两组治疗基础上,于第二次注射GnRHa时启动反向添加治疗,反向添加药物为口服戊酸雌二醇1mg/d和安宫黄体酮胶囊5mg/d,维持GnRHa治疗3个月。
1.4 观察指标
①术前1天及术后1,3,6,12个月末,采集患者空腹外周静脉血5ml,离心取上清液置-80℃冰箱保存待检。采用酶联免疫吸附法(ELISA)测定血清AMH。性激素检测标本均在月经第2~5d采集,采用采用全自动化学发光免疫分析仪测定血清卵泡刺激素(FSH)、雌二醇(E2)、黄体生成素(LH)。②统计观察期间围绝经期症状发生情况,如失眠、阴道干涩等。③随访24个月,统计完全缓解患者的复发情况及术前不孕患者自然妊娠情况。以完全缓解患者再度出现慢性盆腔痛症状(含性交痛、痛经),或月经复潮后经阴道超声检查提示囊肿直径>2cm,维持2个月以上。
1.5 疗效标准[6]
①完全缓解:痛经、性交痛等慢性盆腔痛症状完全消失,盆腔触痛结节消失,经妇科检查或超声检查未见异位囊肿病灶;②部分缓解:疼痛症状缓解,盆腔结节缩小、变软,经妇科检查或超声检查显示异位囊肿病灶缩小或消失;③未缓解:疼痛症状无缓解甚至加重,盆腔结节无改善甚至扩大。
1.6 统计学分析

2 结果
2.1 一般资料比较
3组患者一般资料比较无差异(P>0.05),见表1。
2.2 3组治疗前后血清AMH水平比较
3组术前血清AMH水平比较差异无统计学意义(P>0.05);术后1个月3组均较术前降低,术后3个月始逐步回升,术后6,12个月,GnRHa组和反向治疗组均高于单纯手术组(P<0.05)。见表2。

表1 3组患者一般资料比较
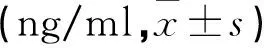
表2 3组治疗前后血清AMH水平比较
a与本组术前比较b与同期单纯手术组比较P<0.05
2.3 3组治疗前后激素水平比较
3组术前血清E2水平比较无差异(P>0.05);术后1个月3组E2均较术前降低,术后3个月逐步回升, GnRHa组、反向治疗组血清E2低于单纯手术组(P<0.05)。LH和FSH术后1个月升高,术后3个月逐步回降,GnRHa组、反向治疗组高于单纯手术组(P<0.05)。3组术后6个月时E2、LH、FSH基本恢复正常。见表3。
2.4 3组临床疗效比较
GnRHa组、反向治疗组的总缓解率高于单纯手术组(χ2=4.73,P=0.030;χ2=6.70,P=0.010),但GnRHa组、反向治疗组间比较差异无统计学意义(χ2=0.23,P=0.629)。见表4。
2.5 副作用发生情况
单纯手术组阴道不规则出血1例,未见其他不良反应或并发症,因术后未巩固治疗,不参与副作用比较。反向治疗组副作用发生率低于GnRHa组(P<0.05),见表5。
2.6 3组复发情况比较
完全缓解患者术后随访2年,术后12,24个月总复发率单纯手术组22.2%(6/27)、33.3%(9/27);GnRHa组 9.8%(4/41)、7.3%(6/41),反向治疗组 9.3%(4/43)、11.6%(5/43)。GnRHa组和反向治疗组均低于单纯手术组(P=0.027,P=0.000)(P=0.021,P=0.000),但GnRHa组和反向治疗组间比较差异无统计学意义(P=0.944,P=0.683)。
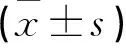
表3 3组治疗前后血清性激素水平比较
a与本组术前比较b与同期单纯手术组比较c与同期GnRHa组比较P<0.05

表4 3组临床疗效比较[例(%)]

表5 各组副作用发生情况比较[例(%)]
2.7 3组妊娠情况比较
单纯手术组、GnRHa组、反向治疗组分别有19,20,23例合并不孕;术后随访12、24个月,单纯手术组累积妊娠率21.1%(4/19)、26.3%(5/19),GnRHa组为50.0%(10/20)、60.0%(12/20),反向治疗组分别为52.2%(12/23)、60.9%(14/23)。GnRHa组与反向治疗组的妊娠率均高于单纯手术组(P=0.050,P=0.039),GnRHa组、反向治疗组比较无差异(P=0.887,P=0.954)。
3 讨论
腹腔镜下囊肿剥除术是当前临床治疗卵巢子宫内膜异位囊肿的首选手段,但其对卵巢储备功能的负面影响也日益受到关注[2-3]。既往评价卵巢储备功能主要依靠超声窦状卵泡计数(AFC)、FSH、LH、E2水平测定等,但影响因素众多,敏感性不足。AMH在女性体内仅由卵巢细胞分泌,尤其是在窦前卵泡以及小窦卵泡(直径≤4mm)中具有高表达[7],在女性卵泡的产生及生长过程中具有重要作用。相关研究显示,血清AMH水平与卵巢原始卵泡数密切相关,在卵巢储备功能异常时,AMH水平先于E2、FSH水平改变[8]。此外,AMH在体内的半衰期较长,需8d方可完全清除,在正常排卵女性的月经周期内基本可维持恒定,可在月经周期中任意时间测定[9]。因此,血清AMH水平较激素水平能够较好地反映女性卵巢储备功能。
本研究通过连续观察患者腹腔镜保守手术前及术后12个月内血清AMH及激素水平变化发现:无论是单纯手术组还是术后辅助用药组,术后1个月内血清AMH水平均急剧下降。说明单侧卵巢子宫内膜异位囊肿腹腔镜保守术后存在一定的卵巢储备功能损伤。Alborzi等[10]研究显示,50%~65%的患者卵巢囊肿剥除术后1年血清AMH水平可恢复至术前水平,但近半数的患者术后1年AMH水平仍明显降低,甚至有部分患者低于术后1个月水平。还有研究发现,术后卵巢储备功能暂时性下降与术中卵巢组织急性损伤有关,而术后随着卵泡群重整,血清AMH水平可逐步恢复[11]。本研究术后随访显示,患者在术后3个月始血清AMH水平逐步上升,但单纯手术组直至术后12个月血清AMH水平均未恢复至术前状态,而血清E2、FSH及LH水平基本在6~12个月内恢复至术前水平,证实单侧卵巢囊肿剥除术后所致卵巢储备功能受损可能是长期存在的,而检测E2、FSH及LH往往并不可能准确地反映患者的卵巢储备功能,术后持续检测AMH水平变化非常必要。
本研究还发现,术后辅助用药巩固治疗组术后6、12个月时血清AMH明显高于单纯手术组,考虑是由于GnRHa的应用使垂体功能受抑后卵巢处于暂时性“休眠状态”,缺乏高雌激素的反馈性抑制作用下,更多不依赖于FSH的原始卵泡不断被募集、生长和发育,而其表面颗粒细胞可分泌更多的AMH而表现为血清AMH水平升高,这也有利于术后卵泡池的调节与恢复,从而促进卵巢功能恢复。GnRHa短期内可刺激垂体释放LH和FSH,随着用药时间的延长,GnRH-R耗尽后又产生反向垂体降调节作用,使LH、FSH的合成减少,而形成低雌激素状态,促使异位内膜退化、缺血性坏死并逐渐吸收。此外,GnRHa还具有抑制炎症反应、抑制血管新生和改善腹腔免疫内环境等作用,对缓解慢性疼痛及预防复发具有积极作用[12]。但因GnRHa从多途径抑制雌激素分泌而产生低刺激状态,极易诱发围绝经期症状。因此,学者们主张采用雌激素类药物反向添加疗法,以维持体内雌激素水平,在保留治疗效果的同时,削弱或消除GnRHa所致围绝经期症状或不良反应。根据雌激素“窗口剂量”理论,认为应用雌激素反向添加维持雌激素阈值窗口(E2水平109.8~164.7pmol/L)内不会造成EMS病灶生长,且可预防低雌激素症状的发生[13]。本研究术后辅助用药巩固治疗组术后1年治疗总有效率显著高于单纯手术组,复发率显著低于单纯手术组,这与上述机制密切相关。同时术后辅助用药巩固治疗组中的GnRHa组与反向添加组总有效率、复发率并未见差异,而围绝经症状发生率反向添加组低于GnRHa组。证实术后应用GnRHa能够提高治疗效果,而启动反向添加疗法能够缓解GnRHa所致围绝经期症状,改善患者的生活质量。采用术后辅助用药巩固治疗组在治疗效果、复发率及妊娠率方面并未见差异,仅在术后3个月时表现出更高的E2和更低的FSH、LH,且E2仍处于治疗窗浓度内。认为术后应用GnRHa和反向添加疗法是安全可行的。
综上所述,单侧卵巢子宫内膜异位囊肿腹腔镜保守手术后存在一定程度的卵巢储备功能受损,术后追加GnRHa治疗3个月能够有效减轻临床症状,降低术后复发率并提高自然妊娠率;配合反向添加疗法可减少GnRHa所致围绝经期症状,且有利于术后卵巢储备功能的恢复,值得临床借鉴。
