家蚕醇提物逆转脂肪细胞胰岛素抵抗作用的研究
2018-02-27许光辉黄亦琦庄媛戚欢阳赵淑飞马雪云
许光辉 黄亦琦 庄媛 戚欢阳 赵淑飞 马雪云
家蚕治疗消渴病的历史悠久, 在国内外传统药物记载中亦不乏关于家蚕治疗消渴病的介绍, 如《本草纲目》对家蚕描述有:蚕蛹, “煎汁饮, 止消渴”;蚕茧, “煮汁饮, 止消渴”;缫丝汤, “止消渴, 大验”等[1,2]。目前文献表明, 在治疗糖尿病等相关疾病方面, 家蚕均以幼虫的全体的冻干粉末入药, 但少见有关家蚕有效成分提纯、精制的研究。本研究在开展家蚕提取、精制基础上进一步对有效成分家蚕醇提物(silkworm alcoholic extract, SAE)在细胞水平开展药效活性研究。现报告如下。
1 材料与方法
1.1SAE的制备 取一定量的5龄蚕, 经冷冻干燥、粉碎制备成家蚕冻干粉, 加10~30倍的70%乙醇水溶液, 充分搅拌, 浸泡 2 h, 超声 10 min, 重复 3次, 间隔 10 min/次, 过滤 ;沉淀再按以上方法提取1次;将2次滤液合并, 减压浓缩成含有家蚕1 g/ml的贮液, 4℃保存, 用前DMSO稀释至所需浓度, 22 μm滤膜过滤除菌。
1.23T3-L1前脂肪细胞的培养与分化、脂肪细胞IR模型的复制 3T3-L1前脂肪细胞接种于培养皿中, 用含10%胎牛血清(FBS)的高糖DMEM培养基培养, 隔天换液;待细胞长满至完全融合48 h后, 采用分化培养基开始进行分化, 隔天换液;分化72 h后更换含100 ng/ml Insulin的维持培养基,隔天换液;维持培养基培养10 d后, 95%以上的细胞完全分化为成熟的脂肪细胞。
分化成熟的脂肪细胞在含有0.2 nM TNF-α的维持培养基培养96 h后, 可成功复制成IR模型[3]。
1.3SAE对正常脂肪细胞糖摄取的影响 3T3-L1前脂肪细胞接种于12孔板中, 实验分为空白对照组和SAE处理组,每组至少3个重复。95%以上的3T3-L1前脂肪细胞完全分化为成熟的脂肪细胞后, 给药组分别加入SAE浓度为250、500 μg /ml和1.0 mg /ml的含药培养基继续培养24 h。
24 h后空白组与各给药组用磷酸盐缓冲液(PBS)淋洗3次, 空白对照组与各给药组分别更换无血清培养基和含药(浓度为250、500 μg /ml、1.0 mg/ml)的无血清培养基饥饿培养8 h,然后先加入含胰岛素100 μM的PBS, 37℃ 孵育20 min, 再加入终浓度为1 mM的2-DG, 37℃ 孵育20 min;用含200 uM phloretin的冷PBS淋洗3次, 然后每孔加入1.5 ml样品稀释液,超声裂解细胞, 收集细胞悬液, 80℃加热15 min;4℃, 15000 g离心20 min, 收集上清液;按照葡萄糖摄取试剂盒要求测定各组糖摄取情况[4]。
1.4SAE对IR模型糖摄取的影响 3T3-L1前脂肪细胞接种于12孔板中, 实验分为空白对照组、IR模型组和SAE处理组, 每组至少3个重复。95%以上的细胞完全分化为成熟的脂肪细胞后, IR模型组与SAE处理组更换含0.2 nM TNF-α的维持培养基作用96 h、隔天换液, 诱导IR状态;在诱导IR模型的同时, 药物处理组加入一定浓度的SAE, 直到实验结束[5]。其余步骤同1.3。
1.5SAE对IRS-1蛋白表达及其酪氨酸磷酸化的影响3T3-L1前脂肪细胞接种于10 cm培养皿中, 实验分为空白对照组、IR模型组和SAE处理组, 每组至少3个重复, IR模型复制及给药方法同1.4。0.2 nM的TNF-α处理96 h后,实验组细胞更换无血清培养基饥饿12 h, 然后加入100 nM的胰岛素处理3 min诱导酪氨酸磷酸化, 用预冷的PBS淋洗细胞, 加入蛋白裂解液提取总蛋白。免疫印迹法检测IRS-1 及其磷酸化蛋白, 各取30 μg蛋白上样10%聚丙烯酰胺凝胶电泳分离蛋白后转到聚偏二氯乙烯(PVDF)膜上, 5%脱脂牛奶室温摇床封闭 1 h, 一抗4℃孵育过夜。次日与辣根过氧化物酶标记的二抗孵育1 h后, 加化学发光(ECL)试剂反应, 显像,成像。采用Image J 软件分析目标条带和内参光密度值, 目标条带与内参的比值为该目的蛋白相对含量。
1.6统计学方法 采用SPSS16.0统计学软件对数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;单因素方差分析;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
500 μg/ml和1.0 mg/ml的SAE均能显著性增强细胞的葡萄糖摄取。见图1。SAE能显著增强IR细胞的葡萄糖摄取。见图2。表明SAE可显著促进脂肪细胞的葡萄糖摄取、明显改善脂肪细胞的IR状态。与正常3T3-L1脂肪细胞比较, TNF-α显著抑制IR模型组IRS-1的表达及其磷酸化水平(P<0.01);与IR模型组比较, SAE可以纠正TNF-α刺激IRS-1的表达及其磷酸化水平。见图3、图4。

图1 SAE增强3T3-L1脂肪细胞葡糖糖摄取的作用注:与空白对照组比较, aP<0.05

图2 SAE改善的3T3-L1脂肪细胞IR模型葡糖糖摄取的作用注:与空白对照组比较, aP<0.01
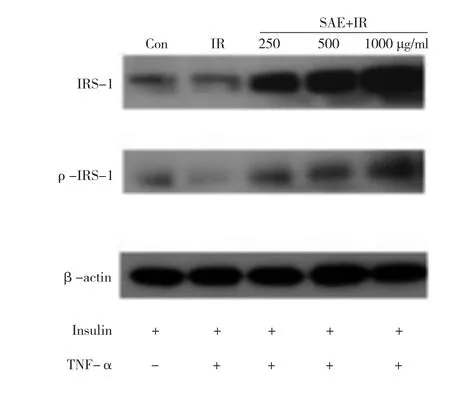
图3 SAE对IRS-L1脂肪细胞IRS-1及其酪氨酸磷酸化蛋白表达的电泳
3 讨论
通常葡萄糖摄取实验是在一定浓度的胰岛素诱导下进行[6], 而本研究发现家蚕提取物SAE对正常脂肪细胞和IR的脂肪细胞的葡萄糖摄取均有显著的增强作用。本研究结果表明, SAE具有类似胰岛素的药理作用, 且明显改善炎症因子引发的细胞IR状态。
在慢性高胰岛素血症和TNF-α导致的IR中, IRS-1蛋白及其酪氨酸磷酸化蛋白水平明显下降[7,8], 本研究发现SAE可以逆转TNF-α导致的脂肪细胞IR的状态, 同时IRS-1表达和酪氨酸磷酸化也恢复到正常水平。
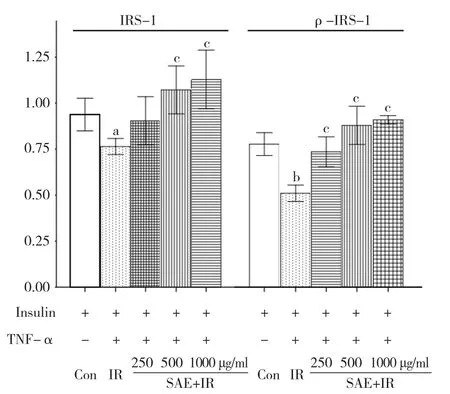
图4 SAE对3T3-L1脂肪细胞IRS-1及其酪氨酸磷酸化蛋白表达的相对含量
以往研究表明, 家蚕对2型糖尿病大鼠具有降糖作用[9], 但具体有效成分不明确。本研究通过细胞药效筛选实验, 证明SAE可能为家蚕降糖的有效部位;SAE通过恢复IRS-1表达水平改善IR。有关SAE增强细胞葡萄糖摄取和改善IR的具体分子机制, 有待于下一步整体动物实验验证。
[1] 桂仲争, 陈杰 , 陈伟华 , 等 .全蚕粉 (SP)降血糖的作用效果及其机理的研究.蚕业科学, 2001, 27(2):114-118.
[2] Ryu KS, Chung SH , Kang PD, et al.An activity ofloweringblood-glucose levels according to preparativecondition of silkworm powder.Koeran J Seric Sci, 1997, 39(1):79-85.
[3] Prabhakar PK, Doble M.Effect of Natural Products on Commercial Oral Antidiabetic Drugs in Enhancing 2-Deoxyglucose Uptake by 3T3-L1 Adipocytes.Therapeutic Advances in Endocrinology &Metabolism, 2011, 2(3):103-114.
[4] Yamamoto N, Sa to T, Ka wasaki K, et al.A n onradioisotope,enzymatic assay for 2-deoxyglucose uptake in L 6 skeletal muscle cells cultured in a 96-well microplate.Analytical Biochemistry,2006, 351(1):139-145.
[5] Guo D, Donner DB.Tumor necrosis factor promotes phosphorylation and binding of ins ulin receptor substrate 1 to phos phatidylinositol 3-kinase in 3T3-L1 adipocytes.Journal of Biological Chemistry,1996, 271(2):615-618.
[6] Tagami S, Inokuchi JJ, Kabayama K, et al.Ganglioside GM3 participates in the pathological conditions of insulin resistance.Journal of Biological Chemistry, 2002, 277(5):3085-3092.
[7] Shulman GI.Cellular mechanisms of insulin resistance.J Clin Invest, 2000, 106(2):171-176.
[8] Takano A, Usui I, Haruta T, et al.Mammalian Target of Rapamycin Pathway Regulates Insulin Signaling via Subcellular Redis tribution of Insulin Receptor Substrate 1 and Integrates Nutritional Signals and Metabolic Signals of Insulin.Molecular & Cellular Biology,2001, 21(15):5050.
[9] 庄媛, 康小红, 黄亦琦, 等.家蚕对2型糖尿病大鼠脂代谢及脂肪细胞因子的影响.中国药物与临床, 2014, 14(4):420-423.
