高蛋氨酸饮食对大鼠颈动脉基因甲基化的影响研究
2018-02-27陈立杰常明秀靳京美
张 岩,陈立杰,常明秀,靳京美,王 锐
(1.哈尔滨医科大学附属第一医院 神经内科,哈尔滨150001;2.哈尔滨医科大学附属第二医院,哈尔滨150086;3.哈尔滨医科大学附属第四医院,哈尔滨150001;4.大庆龙南医院,黑龙江 大庆163000)
近年来我国因脑血管疾病死亡的人数逐年上升,对其危险因素的研究已成为近几年的热点。1969年McCully首次报道动脉粥样硬化(atherosclerosis,AS)患者血浆中HCY升高,使人们意识到HCY可能是除高血压、高血脂、糖尿病等疾病外又一重要的脑血管疾病危险因素,随后的研究发现AS时有DNA异常甲基化表达的现象[1]。现已证实,许多调节细胞增殖或凋亡基因的甲基化改变与AS的关系密切,如雌激素受体基因、P53基因等[1,2]。可以确定基因的甲基化改变是AS发生的重要机制之一[3]。而HCY的前体物质SAH作为甲基供体,与AS的关系十分密切。本实验主要研究高蛋氨酸饮食与颈动脉基因甲基转移酶的关系,进而探讨AS的发生机制,以便合理改善饮食结构,减少脑血管疾病的发生。
1 材料与方法
1.1 材料来源
1.1.1实验模型制备:成年、雄性、健康wistar大鼠21只,体重(100±10)g,由长春实验动物中心提供。采用随机分组的方法将大鼠分为正常对照组(C组)、实验组(M组)和干扰组(F组),每组7只。实验组饲喂食含1%蛋氨酸的全日饲料,干扰组饲喂食含有1%蛋氨酸、0.003%叶酸、0.00002%维生素B12的全日饲料,对照组饲喂食普通饲料,饲料由春龙实验动物饲料机械厂提供,模型制备期为10周。
1.1.2样品的采集与处理 在喂养10周后,大鼠禁食水24 h,剥离大鼠颈总动脉、颈内动脉和颈外动脉,留取动脉血约10 ml,3 000 r离心后取上清液分装于EP管中,于-80℃保存,留待进行后续试验。迅速取下颈动脉约1 cm,于4℃PBS中迅速剥离多余的脂肪、筋皮等结缔组织,冲洗干净血管内残留的血液,在滤纸上将残留的PBS吸去后置于冻存管中放入液氮后于-80℃冻存,用于检测甲基转移酶蛋白表达水平和整体基因甲基化水平。
1.2 方法
1.2.1大鼠的体重测定 分别于第0、4、8、10周时给老鼠称重并进行记录。
1.2.2血浆HCY和SAH浓度测定 从-80°冰箱取出血浆标本,在室温下静止10 min后,采用化学发光微粒子免疫检测法(雅培i2000化学发光仪)、酶联免疫吸附法(ELISA)分别测定HCY和SAH浓度。
1.2.3Western blot检测甲基转移酶的表达 取适量组织裂解、匀浆,离心提取蛋白;采用BCA试剂盒绘制出蛋白标准曲线并进行蛋白浓度测定。制备浓缩胶浓度为5%,分离胶浓度为7%、10%,分别取上样液20ìl、含30ìg蛋白进行电泳;将分离的蛋白转移至PVDF膜,用5%脱脂奶粉封闭1 h。随后用1:200 Dnmt抗体4℃过夜,TBS充分洗涤,再将该膜用1∶500羊抗兔IgG-HRP抗体室温孵育45 min,TBS充分洗涤,最后使用ECL试剂盒显影、定影、洗片。
1.3 统计学处理
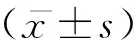
2 结果
2.1 实验期间三组大鼠体重变化情况
实验期间,严格按照饲养管理标准饲养大鼠,三组大鼠体重逐渐增加,未见发生其他疾病而死亡的大鼠。对照组大鼠发育良好,表现正常;实验组大鼠初期精神状态尚可,但随着时间的延长逐渐出现反应减慢,活动迟钝,7周后偶有大鼠出现行走略不稳,摄食及饮水量较对照组减少;干扰组大鼠精神状态好,对声音刺激敏感,运动异常活跃,偶有精神过度紧张,摄食及饮水量较对照组和实验组略多。
喂养4周后,三组大鼠体重开始有差异,但差异无统计学意义(P>0.05);喂养8周开始,实验组体重明显低于对照组和干扰组,且差异有统计学意义(P<0.05),见表1。

表1 实验期间三组大鼠体重变化情况
注:a:实验组与对照组相比,P<0.05;b:实验组与干扰组相比,P<0.05。
2.2 实验期满三组大鼠血浆HCY和SAH浓度测定结果
实验期满,经过不同饲料饲养后,实验组大鼠血浆HCY浓度均高于对照组和干扰组,经过叶酸和维生素B12干扰后,干扰组血浆HCY浓度虽然高于对照组,但明显低于实验组,而血浆SAH浓度实验组低于对照组,且差异具有统计学意义(P<0.05),见表2。

表3 三组大鼠血浆HCY和SAH浓度测定结果
注:a:实验组与对照组相比,P<0.05;b:实验组与干扰组相比,P<0.05。
2.3 实验期满三组大鼠甲基转移酶蛋白1和3a的蛋白表达情况
实验期满,经过不同饲料饲养后实验组大鼠甲基转移酶1和3a的蛋白表达均低于对照组和干扰组,经过叶酸和维生素B12干扰后,干扰组大鼠甲基转移酶1和3a的蛋白表达虽然低于对照组,但明显高于实验组,且差异具有统计学意义(P< 0.05),见图1。

注:*表示实验组与对照组相比,P<0.05;**表示干扰组与实验组相比,P<0.05
实验期满时所测甲基转移酶3b表达情况,三组所得数据比较,差异无统计学意义(P>0.05),见图2。

图2 甲基转移酶蛋白3b的蛋白表达
3 讨论
有研究表明,HCY在体内的含量增高时,可以在氨基酰-tRNA合成酶的催化下,生成同型半胱氨酸硫内酯(homocysteine thiolactone,HTL)。组织细胞培养研究发现,HTL只需要极少的浓度(0.05 mmol/L)就可以使血管内皮细胞发生凋亡,其机制可能与诱导氧化应激以及NF-êB活化、诱导人HL-60细胞的凋亡[4]有关。而HCY本身也可以引起细胞凋亡,其浓度是(3 mmol/L),可见,HCY及其生成的HTL均具有明显的细胞毒性作用[5]。同时人们还发现HCY的神经毒性作用,在脑血管病及脑外伤时,10 μmol/L的HCY即可通过过度兴奋N-甲基-D-天冬氨酸受体产生钙离子内流,引起大量的活性氧生成,从而产生神经毒性作用。这种神经毒性作用使得人的认知功能受到严重损伤,所以,人们认为HCY是老年痴呆的一个独立的危险因素[6],并且起到一定的预测作用[7]。
本实验研究发现,高蛋氨酸组大鼠体重明显减轻,精神状态、反应速度均较正常对照组减弱,活动量少,偶有大鼠出现肢体力弱,行走不稳。给予叶酸及维生素B12干扰后的大鼠摄食饮水量及体重较对照组均增加,精神状态良好,对声音光线刺激敏感。说明高蛋氨酸饮食对于大鼠确实具有细胞毒性和神经毒性作用,叶酸、维生素B12具有神经保护作用。
高蛋氨酸饮食引起的高HCY血症,可以引起甲基化异常及基因表达紊乱,同时血管动脉粥样硬化改变中存在异常甲基化,这引起了我们对甲基化、同型半胱氨酸、血管动脉硬化三者关系的思考[8]。有研究结果表明,增加HCY浓度可以反馈性地抑制SAH水解酶导致SAH的浓度升高,同时导致SAM浓度的减少,并使SAM/SAH的比值降低,从而下调了DNA甲基化状态[9,10]。刘玲娟等的研究亦显示在HCY浓度升高可以引起平滑肌细胞整体基因组去甲基化改变的同时,人脐动脉平滑肌细胞内源性DNMT1的活性同步下降,因此,推测DNMT1与Hcy引起的平滑肌细胞增殖有关[11]。可见,HCY引起DNA低甲基化,同时与血管动脉硬化的关系密切。
本实验结果显示,经过高蛋氨酸饮食喂养大鼠后,血浆HCY浓度实验组明显高于对照组和干扰组,说明高蛋氨酸饮食可以引起高HCY血症,而大鼠颈动脉甲基转移酶1和甲基转移酶3a的表达实验组均较对照组和干扰组明显减低,这与HCY血浆浓度变化呈一致性,说明高HCY血症可以使甲基转移酶1和3a表达减低,进而引起低甲基化表达。本实验同时证明叶酸和维生素B12不仅可以拮抗高蛋氨酸饮食诱导的高HCY血症,也可以拮抗高HCY血症引起的甲基转移酶低表达。以往的研究亦证明叶酸水平和甲基转移酶1蛋白表达改变在宫颈癌变过程中有协同作用,可见,叶酸和甲基转移酶关系密切[12]。与本实验结果相符。
以往有研究表明高蛋氨酸饮食可以增加SAH的血浆浓度,与本实验结果相反,但亦有实验证明高HCY可以使甲基转移酶的活性代偿性增高,导致SAM大量消耗,引起SAM的浓度减少[13]。我们考虑:SAH作为SAM的代谢产物与SAM的含量有直接关系,高HCY血症引起的SAM的高消耗,可能是SAH的含量减低的因素之一。并且SAH在血中含量低,且其测定方法复杂,进行大规模血浆SAH测定具有一定的难度,所以,对SAH与高蛋氨酸饮食的关系、与甲基转移酶蛋白表达的关系仍需进一步研究。
[1]Leach NV,Dronca E,Vesa,SC,et al.Serum homocysteine levels,oxidative stress and cardiovascular risk in non-alcoholic steatohepatitis[J].Eur J Intern Med,2014,25(8):762.
[2]Cao Q,Wang X,Jia L,et al.Inhibiting DNA methylation by 5-Aza-2'-deoxycytidine ameliorates atherosclerosis through suppressing macrophage inflammation[J].Endocrinology,2014,155(12):4925.
[3]Nazarenko MS,Markov AV,Lebedev IN,et al.DNA methylation profiling of the vascular tissues in the setting of atherosclerosis[J].Mol Biol (Mosk),2013,47(3):398.
[4]刘玉晖,游 宇.同型半胱氨酸硫内酯损伤血管内皮细胞的机制研究[J].中国病理生理杂志,2011,27(10):1879.
[5]卢 艳,王海琴,王 新.高同型半胱氨酸血症孕鼠与其仔鼠发生先天性心脏病的关系 [J].中南大学学报(医学版),2011,36(01):68.
[6]杨昊翔,尹立勇,崔志杰.高同型半胱氨酸血症与老年人认知功能障碍相关性研究[J].临床荟萃,2011,26 (12):1026.
[7]王 璐,王国玉,赵 翠,等.血浆同型半胱氨酸水平对老年高血压患者轻度认知功能障碍的预测价值[J].华南国防医学杂志,2014,28(11):1070.
[8]Baccarelli A,Tarantini L,Wright RO,et al.Repetitive element DNA methylation and circulating endothelial and inflammation markers in the VA normative aging study[J].Epigenetics,2010,5(3):222.
[9]王义勇,罗彩琴,丛广志,等.高同型半胱氨酸和高胆固醇血症联合作用对大鼠基因组DNA总甲基化状态的影响[J].天津医药,2012,40(04):366.
[10]Yideng J,Jianzhong Z,Ying H,et al.Homocysteine-mediated expression of SAHH,DNMTs,MBD2,and DNA hypomethylation potential pathogenic mechanism in VSMCs[J].DNA Cell Biol,2007,26(8):603.
[11]刘玲娟.DNA甲基转移酶1在同型半胱氨酸致人脐静脉平滑肌细胞增殖中的作用研究[D].银川:宁夏医科大学,2011.
[12]白 兰.叶酸与DNMT1对FHIT基因在宫颈癌细胞中表达的影响[D].太原:山西医科大学,2013.
[13]Yideng J,Jianzhong Z,Ying H,et al.Homocysteine-mediated aberrant DNA methylation in vascular smooth muscle cells and its potential pathogenic mechanism[J].Progress in biochemistry and biophysics,2007,34(5):479.
