多发性骨髓瘤患者血清lncRNA HOTAIR表达量与血清β2微球蛋白及预后的相关性
2018-02-27徐声鸣吕龙龙张泽天靳凤艳
徐声鸣,沙 辉,吕龙龙,黄 琦,陈 龙,张泽天,赵 松,靳凤艳,牛 丰*
(1.吉林大学第一医院 脊柱外科,吉林 长春130021;2.吉林大学第一医院血液肿瘤中心,吉林 长春130021)
多发性骨髓瘤(MM)是一种骨髓恶性浆细胞疾病,患者的病理改变以局灶性骨及软组织病变、弥漫性骨髓浸润为主,浆细胞的异常增生可导致免疫功能降低、骨质破坏等后果,最终引发贫血、肾功能不全、感染、多系统多器官损害等复杂的临床并发症[1]。化疗是目前临床上针对MM的主要治疗方法,而对于难治性、复发性MM患者,化疗的临床疗效一般较差[2]。近年来,随着新型化疗药物及造血干细胞移植等新疗法的不断应用,MM患者的缓解率和生存质量得到了一定程度的提高[3],但MM患者对药物反应存在较大的个体差异,这导致了患者的预后也存在着较大的差异,患者的生存期可从数月到10多年不等[4],因此,对于MM患者的治疗效果和预后做出有效的预测和评价具有积极的意义。从20世纪60、70年代开始,研究者先后对血红蛋白、血清钙、血肌酐、溶骨数目等多种MM预后相关因素进行了研究并建立了Durie Salmon分期标准,在其后的研究中,血清β2微球蛋白(β2-MG)水平与MM预后的相关性被越来越多的研究证实,C反应蛋白、白蛋白、浆细胞标记指数、S期比例、13号染色体缺失等多种新型预后相关因素也被引入相关研究[5],国外学者也提出了一系列针对MM的新分期系统,但学术界至今仍未对MM的最佳预后因素和分期达成一致的意见[6]。随着分子生物学研究科技的发展,针对MM的预后预测研究已向血清游离轻链、细胞遗传学和分子生物学检测等方向发展[7]。长链非编码RNA(lncRNA)是一种能够对正常细胞与肿瘤细胞的基因表达发挥调控作用的非编码RNA,能够参与肿瘤细胞的增殖、侵袭、转移等调控过程,因而近年来被作为一种新型标志物用于评价恶性肿瘤的预后[8],本研究针对MM患者血清lncRNA HOTAIR表达量与血清β2-MG及预后的相关性进行研究,现报告如下。
1 材料与方法
1.1 一般资料
选取2008年1月至2015年6月我院收治的100例MM患者为病例组,患者均符合人民卫生出版社出版的《血液病诊断与鉴别诊断图谱》中的诊断标准,患者年龄44-64岁,平均(54.2±4.5)岁,男性68例,女性32例,其中,IgG型44例、IgA型18例、IgD型8例、κ轻链型10例、λ轻链型12例、不分泌型6例、IgM型2例,排除合并有心、肝、肾等器官功能不全及感染性疾病的患者。患者均具有化疗治疗指证,采用美法仑+泼尼松(MP方案)或长春新碱+阿霉素+地塞米松(VAD方案)进行化疗治疗。根据欧洲血液和骨髓移植组(EMBT)的疗效评定标准对化疗3-4个疗程时的治疗效果进行评价,将疗效为完全缓解(CR)、部分缓解(PR)的74例患者作为有效组,将疗效为无变化(NC)、病情进展(PD)的26例患者作为无效组。选取同期50例我院接受体检的健康志愿者作为对照组,年龄为43-65岁,平均年龄为(53.3±4.8)岁,其中,男性为30例,女性为20例。两组研究对象在年龄、性别构成等方面的差异均无统计学意义(P>0.05),具有可比性。所有纳入患者均对本研究知情并签署知情同意书,本研究方案经我院医学伦理委员会审核通过。
1.2 观察指标和检测方法
于治疗前采集病例组患者的外周静脉血标本,于体检当日采集对照组研究对象的外周静脉血标本,均经常规离心后分离血清,采用TRIzol LS试剂盒提取血清总RNA,操作步骤严格按试剂盒说明书进行,用35 μl、65℃无酶水溶解RNA,置于-80℃的冰箱内保存待测。采用PrimeScript RT Reagent Kit with gDNA Eraser 试剂盒对总RNA进行逆转录,合成cDNA,采用SYBR Premix Ex Taq Ⅱ 试剂盒对cDNA 进行扩增,采用实时荧光定量PCR法(q-RT PCR法)定量检测血清标本中的lncRNA HOTAIR表达水平,以18S作为内参,引物序列见表1,反应体系见表2,反应条件为:95℃反应2 min,40 个循环,于95℃反应15 s、58℃反应30 s,在58℃时采集荧光,从58℃增加至95℃,每增加0.5℃采集1次荧光。读取目的lncRNA及内参的循环阈值(Ct值),计算Ct 值差值(△Ct),以2-△△Ct的数值表示目的lncRNA的相对表达水平;应用放射免疫法对上述血清标本中的β2-MG水平进行检测和比较;对患者进行随访,对患者的总生存期(OS)和无疾病进展生存期(PFS)进行观察和分析,其中,OS为开始治疗至死亡或最后一次随访的时间,FPS为从开始治疗至疾病进展、死亡或最后一次随访的时间。
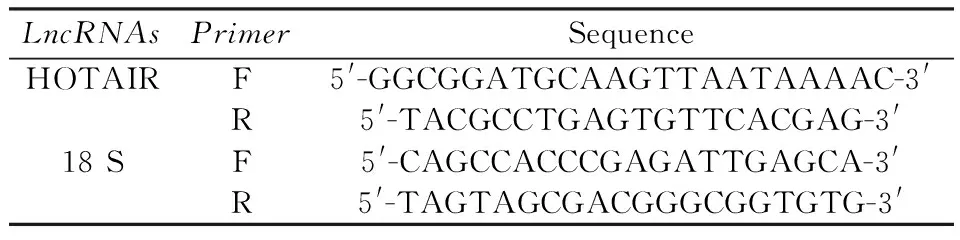
表1 目的lncRNA引物序列

表2 q-RT PCR反应体系
1.3 统计学分析
应用 SPSS 22.0进行统计学分析,计量资料采用(均数±标准差)表示,两组之间比较应用t检验处理,血清lncRNA HOTAIR水平与β2-MG水平的相关性应用Pearson直线相关分析进行处理,患者OS和PFS的比较应用Kaplan-Meier生存分析法,采用Log-rank检验分析其差异是否具有统计学意义,均以P<0.05为差异有统计学意义。
2 结果
2.1 各组研究对象血清lncRNA HOTAIR水平和β2-MG水平的比较
病例组患者的血清lncRNA HOTAIR水平和β2-MG水平均显著高于对照组,无效组的血清lncRNA HOTAIR水平和β2-MG水平均显著高于有效组,差异均有统计学意义(t=18.445、45.023、16.212、22.679,P<0.05),见表1、2,图1、2。

表1 病例组与对照组研究对象血清lncRNA HOTAIR水平和β2-MG水平的比较

表2 有效组与无效组患者血清lncRNA HOTAIR水平和β2-MG水平的比较
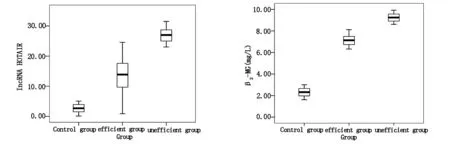
图1各组研究对象血清lncRNAHOTAIR水平的比较图2各组研究对象血清β2-MG水平的比较
2.2 MM患者血清lncRNA HOTAIR水平与β2-MG水平的相关性分析
直线相关结果显示,病例组患者及有效组、无效组患者的血清lncRNA HOTAIR水平均与β2-MG水平具有相关性(r=0.880、0.695、0.893,P<0.05),见表3,图3、4、5。

表3 各组患者血清lncRNA HOTAIR水平与β2-MG水平的相关性
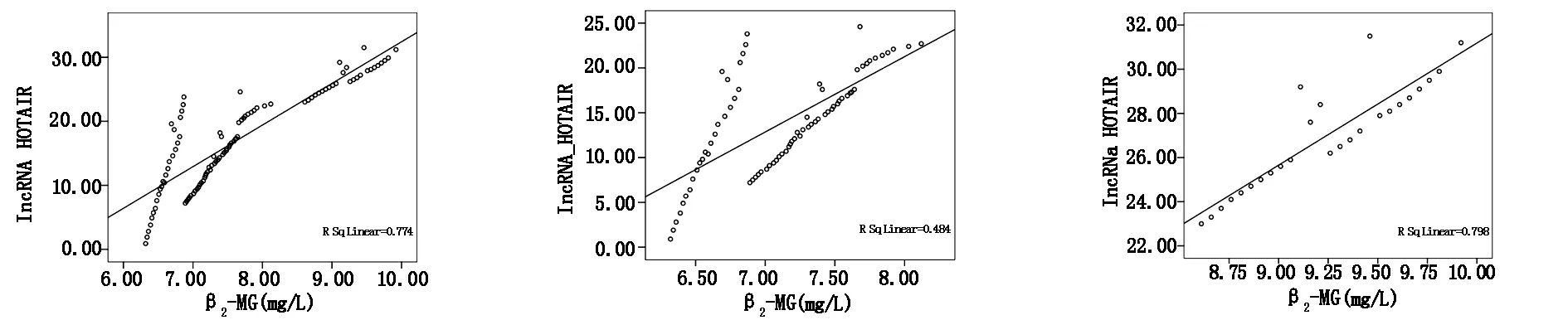
图3病例组患者血清lncRNAHOTAIR水平与β2-MG水平的相关性图4有效组患者血清lncRNAHOTAIR水平与β2-MG水平的相关性图5无效组患者血清lncRNAHOTAIR水平与β2-MG水平的相关性
2.3 不同血清lncRNA HOTAIR水平和β2-MG水平患者生存期的比较
病例组患者的OS和PFS估计值及95%置信区间见表4,图6、7。
分别以病例组患者血清lncRNA HOTAIR水平和β2-MG水平的均值为分组界值,将病例组分为lncRNA HOTAIR高表达组(48例)和lncRNA HOTAIR低表达组(52例),高β2-MG水平组(36例)和低β2-MG水平组(64例),生存分析结果显示,lncRNA HOTAIR高表达组患者的OS、PFS均显著低于lncRNA HOTAIR低表达组,高β2-MG水平组患者的OS、PFS均显著低于低β2-MG水平组,差异均有统计学意义(χ2=39.435、37.371、38.054、34.696,P<0.05),见表5、6,图8、9、10、11。

表4 病例组患者的OS和PFS估计值及95%置信区间
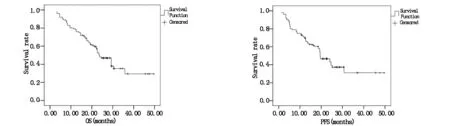
图6病例组患者OS的Kaplan-Meier生存分析曲表图7病例组患者PFS的Kaplan-Meier生存分析曲线
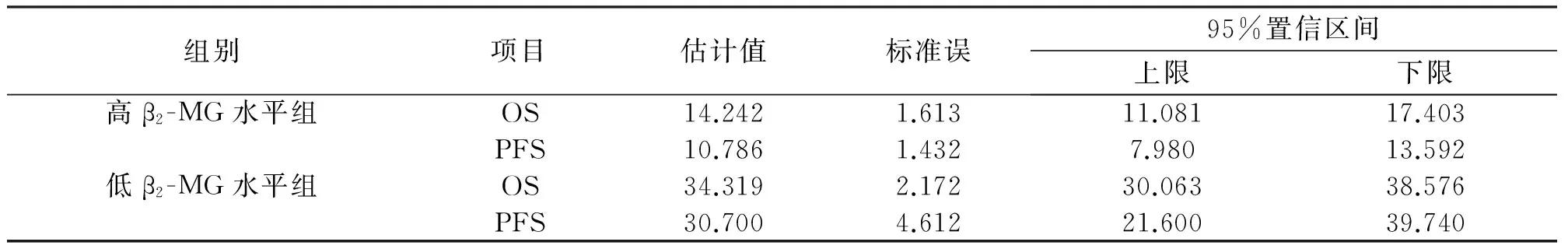
表6 不同血清β2-MG水平患者的OS和PFS的比较

图8不同血清lncRNAHOTAIR水平患者OS的Kaplan-Meier生存分析曲线图9不同血清lncRNAHOTAIR水平患者PFS的Kaplan-Meier生存分析曲线

图10不同血清β2-MG水平患者OS的Kaplan-Meier生存分析曲线图11不同血清β2-MG水平患者PFS的Kaplan-Meier生存分析曲线
3 讨论
本研究结果显示,MM患者表现为血清lncRNA HOTAIR水平和β2-MG水平的升高,治疗无效的患者的血清lncRNA HOTAIR水平和β2-MG水平更高,而且各组MM患者的血清lncRNA HOTAIR水平与β2-MG水平均具有良好的相关性,这体现了外周血lncRNA HOTAIR水平的升高与MM的发病具有相关性,其水平与β2-MG水平具有密切的相关性,而且这两种血清标志物水平的上升幅度与患者对于化疗药物的反应性和治疗效果具有相关性,上升的幅度越高,化疗的治疗效果越差。HOTAIR即为HOX转录反义RNA,是第一个被发现具有反式作用的lncRNA[9],位于人类染色体12q13.13区域HOX基因家族HOXC11基因的反义链。HOTAIR与HOXC基因簇共表达,除特定的区域外,总体的保守性较差[10]。HOTAIR首次是在人成纤维细胞中被发现,随着研究的不断深入,研究者在乳腺癌、肝癌、结肠癌等肿瘤组织中均发现了HOTAIR表达的上调,而且其表达水平与肿瘤的复发及耐药性均密切相关[11-13]。相关实验研究证实,IRF1、OPN、c-myc等基因均可调控HOTAIR的表达水平,而HOTAIR则可通过重编程染色体状态控制以HOXD10为代表的多个基因表达实现其功能,HOXD 10已被证实为一种与肿瘤发病密切相关的基因,并且在有淋巴结转移个体的癌组织中表达也呈现显著升高[14-16]。β2-MG是单核细胞人类组织相容性抗原(HLA)的轻链,通常以非结合的形式存在于外周血中,并通过肾脏进行排泄,能够反映MM患者的肿瘤负荷和肾功能损害程度,同时与其免疫功能损害也具有相关性,在国外的Bataille分期、ISS分期、SWOG分期等多个针对MM的临床分期体系均包含针对β2-MG指标的检测[17,18],因此,β2-MG也成为国际上公认的反映MM病情和进展的重要指标。
本研究结果显示,血清lncRNA HOTAIR水平和β2-MG水平较高的MM患者的生存期显著短于血清lncRNA HOTAIR水平和β2-MG水平较低的患者,这反映了这两种标志物的水平与患者的预后具有相关性,可作为预测患者预后的辅助指标。相关研究结果显示,HOTAIR参与肿瘤进展的主要机制是通过诱导PRC2复合物的重定位,增加了WIF-1启动子区域第27位赖氨酸的甲基化程度从而抑制了WIF-1基因的作用,而WIF-1基因是Wnt/β-catenin信号通路的关键性抑制因子,因此,HOTAIR的高表达可激活Wnt通路,破坏细胞质中的β-catenin APC/Axinl降解复合物被,使核内β-catenin水平上升,最终对VEGF、MMP-7、cyclinD1等下游基因的表达量产生影响,对肿瘤的侵袭转移、逃避生长抑制、抵抗细胞凋亡等生物学特性产生显著的影响,HOTAIR参与了恶性肿瘤的细胞增殖、凋亡、血管生成、侵袭转移等多种恶性表型的调控,还可以增加肿瘤对化疗药物的耐药性,因而也被视为与恶性肿瘤预后高度的相关的标志物[19,20]。β2-MG主要由淋巴细胞产生,在正常的代谢环境下,血清中的游离β2-MG从肾小球毛细血管壁自由滤过,其中的绝大部分会被近端肾小球重吸收,而MM患者机体内的肿瘤细胞增生、细胞周期加速及肾功能损害等病理变化可引发血、尿β2-MG水平的增高,故β2-MG水平能够敏感地反映肿瘤负荷的大小,与患者的预后具有密切的关系[21]。
综上所述,MM患者表现为血清lncRNA HOTAIR水平的升高,其水平与β2-MG水平具有密切的相关性,而且这两种血清标志物水平与化疗药物的治疗效果和生存期有关,可作为评价治疗效果和预测预后的辅助指标。
[1]张海波,薛华丹,李 烁.多发性骨髓瘤的影像学进展及临床意义[J].中国医学科学院学报,2014,36(6):671.
[2]王红娟,葛繁梅.多发性骨髓瘤治疗新进展[J].中国肿瘤临床与康复,2014,21(5):638.
[3]耿传营,陈文明.2013年美国血液学会年会:多发性骨髓瘤的研究进展[J].国际输血及血液学杂志,2014,37(3):229.
[4]He H,Fu W,Jiang H,et al.The clinical characteristics and prognosis of IGH deletion in multiple myeloma[J].Leuk Res,2015,39(5):515.
[5]Younes M,Hachfi H,Hammouda F,et al.Survival prognosis factors in multiple myeloma[J].Tunis Med,2014,92(6):399.
[6]Chawla SS,Kumar SK,Dispenzieri A,et al.Clinical course and prognosis of non-secretory multiple myeloma[J].Eur J Haematol,2015,95(1):57.
[7]杨蕊雪,高 露,施菊妹,多发性骨髓瘤的诊断进展与分期[J].中国癌症杂志,2014,24(10):727.
[8]郑巳年,王恒兵,傅广波.长链非编码RNA与膀胱癌的研究进展[J].临床泌尿外科杂志,2015,30(3):265.
[9]Wan Y,Chang HY.HOTA1R:Flight ofnoncoding RNAs in cancer memsmsis[J].Cell Cycle,2010,9(17):3391.
[10]Shah N,Sukumar S.The Hox genes and their roles in oncogenesis[J].Nat Rev Cancer,2010,10(5):361.
[11]Gupta RA,Shah N,Wang KC,et al.Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J].Nature,2010,464(7291):1071.
[12]Yang Z,Zhou L,Wu LM,et al.Overexpression of long non-coding RNA HOTAIR predicts tunlor recurrence in hepatocellular carcinoma patients following liver transplantation[J].Ann SurgOncol,2011,l8(5):1243.
[13]Kogo R,Shimamura T,Mimofi K,et al.Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J].Cancer Res,2011,71(20):6320.
[14]Yang G,Zhang S,GaG F,et al.Osteopontin enhances the expression of HOTAIR in cancer cells vie IRF1[J].BiGchim Biophys Acta,2014,1839(9):837.
[15]Zhang X,Zhou L,Fu G,et al.The identification of an ESCC susceptibility SNP rs920778 that regulates the expression of IncRNA HOTAIR via a novel intronic enhancer[J].Carcinogenesis,2014,35(9):2062.
[16]Wang L,Chen S,Xue M,et al.Homeobox DIO gene,a candidate tumor suppressor,is down regulated through promoter hypermethylation and associated with gastric carcinogenesis[J].MolMed,2012,9(18):389.
[17]D'Anastasi M,Notohamiprodjo M,Schmidt GP,et al.Tumor load in patients with multiple myeloma:β2-microglobulin levels versus whole-body MRI[J].AJR Am J Roentgenol,2014,203(4):854.
[18]Fedele PL,Choy KW,Doery JC,et al.Inter-laboratory discordance of beta-2 microglobulin results:impact on the validity of the international staging system for multiple myeloma[J].Br J Haematol,2014,166(6):951.
[19]李雨薇,王裕民,张雪莹,等.长链非编码RNA HOTAIR在恶性肿瘤中的研究进展[J].生物化学与生物物理进展,2015,42(3):228.
[20]Wu H,Liu J,Li W,et al.LncRNA-HOTAIR promotes TNF-α production in cardiomyocytes of LPS-induced sepsis mice by activating NF-κB pathway[J].Biochem Biophys Res Commun,2016,471(1):240.
[21]况小红,童 浩,贾 霖.血清β2-微球蛋白和C-反应蛋白水平检测在多发性骨髓瘤患者诊断、疗效监测和预后判断中的临床意义[J].四川医学,2011,32(3):347.
