大菱鲆鳗弧菌灭活疫苗原液发酵条件的优化
2018-02-26孙承文赖迎迢江小燕黄志斌陶家发
孙承文,李 杰,赖迎迢,江小燕,黄志斌,陶家发*
(1.中国水产科学研究院 珠江水产研究所,广东 广州 510380;2.中国水产科学研究院 黄海水产研究所,山东 青岛 266071)
鳗弧菌(Vibrioanguillarum)是一种革兰阴性、能动性海洋细菌,是引起鱼类、甲壳类及贝类弧菌病的主要病原菌之一;海水鱼类发病的主要特征为全身性出血性败血症。该病流行区域广泛,危害严重,给海水养殖业带来了严重的经济损失[1-3]。目前生产中防控鳗弧菌的主要方法仍是使用见效快、疗效好的抗菌素类药物。但随着抗菌素的大量使用,病原弧菌的耐药性特别是多重耐药性日益严重,出现了大量的耐药菌株。随着对抗菌素等药物使用安全性的日益重视,人们的认识已从“靶动物安全”提升到”人类食品安全”和“环境安全”[4]。开发预防水产病害的相关鳗弧菌疫苗,对于水产养殖业的发展和水产品安全具有十分重要的意义,已有多家科研单位研发了鳗弧菌疫苗,实验室研究对海水鱼类有良好的免疫效果。目前该疫苗的产业化生产研究及应用未见报道,本研究通过对鳗弧菌灭活疫苗原液规模化发酵工艺条件的优化,为更好培养鳗弧菌菌液,制备鳗弧菌全菌灭活疫苗及疫苗的产业化生产工艺提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株 大菱鲆鳗弧菌菌株VAM003株由黄海水产研究所莫照兰研究员提供,分离自山东省荣成市某养殖场发病鱼肝脏。
1.1.2 培养基(g/L) ①TSB培养基:胰蛋白胨17,大豆蛋白胨 3,葡萄糖 2.5,磷酸氢二钾 2.5,氯化钠 25,pH 7.2~7.5,加入15 g/L琼脂,为固体TSA;②LB培养基:胰蛋白胨 10,酵母粉 5,氯化钠 25,培养基原料均购自试剂公司。
1.1.3 仪器设备 恒温摇床(上海智诚分析仪器制造有限公司ZWY-211B)、5 L自动发酵罐(日本Bioneer-N 5 L MDL-8c)、紫外分光光度计(上海奥析科学仪器有限公司UV1800PC)、50~500 L自动发酵罐(福州福尔流体设备有限公司)。
1.2 方法
1.2.1 种子液制备 将冻干鳗弧菌的VAM003菌种用含2.5%NaCl的TSB液体培养基溶解后,划线接种于含2.5% NaCl的TSA平板,28 ℃培养18~22 h,挑取典型菌落接种于含2.5% NaCl的TSB液体培养基,28 ℃震荡培养12~14 h,作为一级种子液。
1.2.2 二级种子液培养时间的确定 将一级种子液按培养基总量的10%接种三角瓶,28 ℃、180 r/min 恒温培养,每2 h取样1次,测定OD600值,直到菌液OD600值不再增长,并绘制生长曲线。
1.2.3 不同盐度对制苗菌液浓度的影响 将菌株VAM003种子液分别接种于含1.5%、2.0%、2.5%、3.0%、3.5% NaCl 的TSB培养基,以培养基总量的10%接种种子液,28 ℃,180 r/min 恒温培养10 h,收获菌液,进行活菌计数。
1.2.4 不同培养基对制苗菌液浓度的影响 将菌株VAM003种子液分别接种于300 mL含2.5% NaCl的TSB、LB培养中,28 ℃、180 r/min恒温培养10 h,收获菌液,进行活菌计数,比较两种培养基对培养菌液浓度的影响。
1.2.5 不同接种量对制苗菌液浓度的影响 将菌株VAM003种子液分别按5%、10%、15%的接种量接种5 L发酵罐(含2.5% NaCl的TSB培养基3 L),28 ℃发酵培养10 h,收获菌液,进行活菌计数。
1.2.6 补料对发酵制苗菌液浓度的影响 配制2罐5 L发酵罐(含2.5% NaCl的TSB培养基3 L),其中一罐另配制20%葡萄糖、10倍浓缩TSB各 200 mL作为补料进行补料发酵;按培养基总量的10%接种量发酵培养,培养温度28 ℃,通气搅拌培养。补料发酵时,发酵4 h后开始匀速添加补料葡萄糖,5 h后开始匀速添加补料10倍浓缩TSB。每2 h取样1次,测定OD600值,直到菌液OD600值不再增长,并绘制生长曲线,取样,平板计数测定菌液活菌数。
1.2.7 菌株VAM003500 L发酵罐放大发酵 按照1.2.6方法进行500 L发酵罐放大发酵验证试验。配制300 L含2.5% NaCl的TSB液体发酵培养基(其中种子罐30 L,发酵罐270 L),同时按培养基容量的0.02%加入消泡剂,121 ℃高压灭菌20 min;另配制20%葡萄糖、10倍浓缩TSB各 20 L作为补料;按培养基总量的10%接种二级种子液到50 L种子罐,28 ℃培养12 h,通风搅拌培养,每隔2 h取样,测定OD600值,平板计数测定菌液活菌数。种子罐培养结束接种到500 L发酵罐,28 ℃,通风搅拌培养,发酵4 h后开始匀速添加补料葡萄糖,5 h后开始匀速添加补料10倍浓缩TSB。每隔 2 h取样,同上测定菌液OD600值,直到菌液OD600值不再增长,取样,平板计数测定菌液活菌数。
2 结果与分析
2.1 二级种子液培养时间的确定
二级种子液培养12 h后,OD600值到达高峰,菌液浊度最大,14 h后OD600值下降,表明菌株VAM003三角瓶培养时间不超过14 h。作为种子液培养以12~14 h为佳,结果见图1。
2.2 盐度对制苗菌液浓度的影响
培养10 h活菌计数结果表明,随着盐度的增加,活菌量也增加,在含2.5% NaCl的TSB培养基活菌数最高,活菌数为1.23×109cfu/mL;随着盐度继续增加,在含3.0%、3.5%NaCl的TSB培养基活菌量减少。因此选择含2.5% NaCl的盐度作为菌株VAM003发酵培养基盐度,结果见图2。
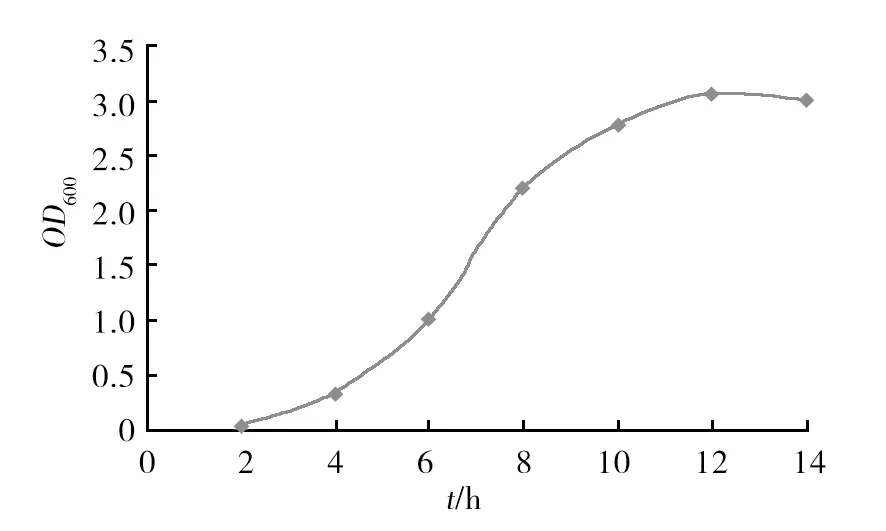
图1 菌株VAM003二级种子液生长曲线Fig.1 Culture oscillated growth curve of Vibrioanguillarum VAM003 strain

图2 盐度对菌株VAM003生长结果的影响Fig.2 Effects of diffent culture salinity on the growth of Vibrio anguillarum VAM003 strain
2.3 培养基对制苗菌液浓度的影响
培养10 h后活菌计数结果表明,以TSB培养基培养菌株VAM003菌液浓度更高,活菌数为1.21×109cfu/mL,表明TSB培养基更适合作为发酵培养基,结果见图3。
2.4 接种量对制苗菌液浓度的影响
随着二级种子接种量的增加,活菌数也增高,培养基接种10%~15%种子液,可以获得较好的接种效果,活菌数达到5×109cfu/mL以上。同时试验结果也表明,培养基接种10%~15%种子液其最终菌液浓度结果差异不明显,因此从成本及培养效果因素考虑,选择10%的接种量为适宜接种量,结果见图4。

图3 培养基对菌株VAM003生长结果的影响Fig.3 Effects of diffent culture medium on the growth of Vibrio anguillarum VAM003 strain
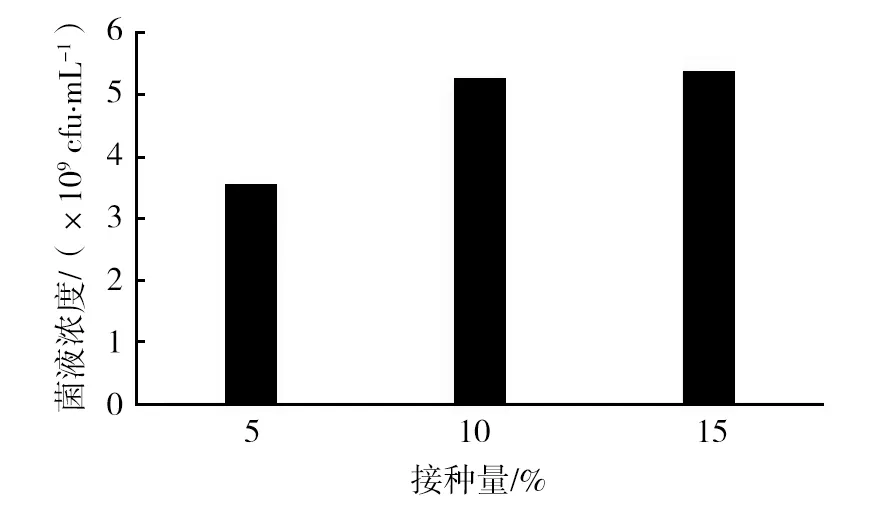
图4 接种量对菌株VAM003生长结果的影响Fig.4 Effects of diffent inoculum size on the growth of Vibrio anguillarum VAM003 strain
2.5 补料对发酵制苗菌液浓度的影响
菌株VAM003发酵罐培养液在8 h内生长较快,之后生长减慢,12 h左右达到生长最大值,随后菌液浓度降低。而通过发酵培养过程添加补料培养基使得菌株VAM003发酵培养OD600值增加1.5倍以上,活菌数增加160%,结果见图5、表1。

图5 菌株VAM003在5 L发酵罐的生长结果Fig.5 Ferment growth curve of Vibrio anguillarum VAM003 strain in 5 L fermenter

表1 菌株VAM003在5 L发酵罐补料发酵活菌结果Table 1 Result of feeding fermentation of Vibrio anguillarum VAM003 strain in 5 L fermenter
2.6 菌株VAM003 500 L发酵罐放大发酵
50 L种子罐发酵培养10 h后进入稳定生长期,培养12 h左右达到最高值。转入500 L发酵罐补料培养8 h进人稳定生长期,培养10 h左右鳗弧菌生长达到最大值(图6、图7)。补料培养活菌数可达1.20×1010cfu/mL,活菌数增加120%以上,结果表明补料培养能显著提高大菱鲆鳗弧菌发酵菌液的浓度,结果见表2。
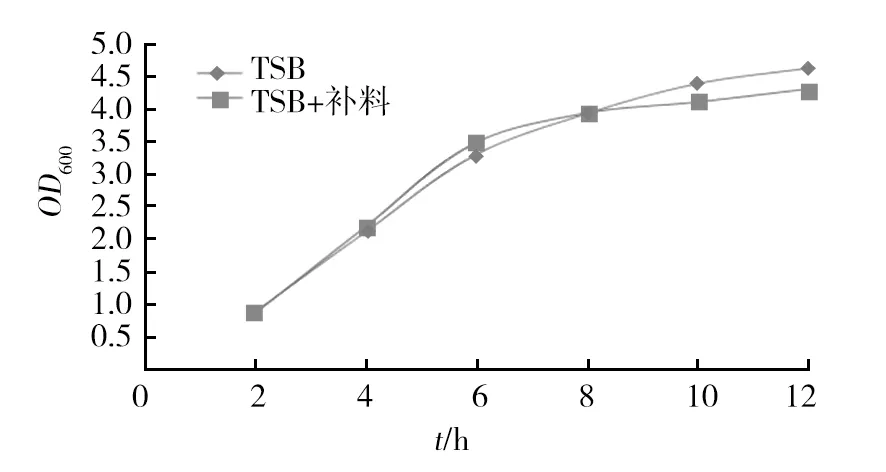
图6 菌株VAM003在50 L种子罐的生长曲线Fig.6 Ferment growth curve of Vibrio anguillarum VAM003 strain in 50 L fermenter

图7 菌株VAM003在500 L发酵罐的生长曲线Fig.7 Ferment growth curve of Vibrio anguillarum VAM003 strain in 500 L fermenter

表2 菌株VAM003 50~500 L发酵罐发酵活菌结果Table 2 Results of feeding fermentation of Vibrio anguillarum VAM003 strain in 50 L and 500 L fermenter
3 讨 论
有学者研究报道了鳗弧菌疫苗接种杂交鲟[4]、大菱鲆[5-7]及牙鲆[8]等的免疫效果研究,目前该疫苗研制处于实验室阶段,尚未进入商品化疫苗生产。很多学者对鳗弧菌的培养条件进行了研究报道,鳗弧菌适宜生长的培养基包括Zobell 2216E、TSB、LB等,培养温度在28~37 ℃,适宜盐度4%以下[9-10],对发酵罐规模化培养鳗弧菌较少报道。由于Zobell 2216E培养基配方含有陈海水组分,陈海水易对发酵罐不锈钢罐体造成腐蚀,因而不适合作为规模化发酵培养基。影响发酵的因素很多,如发酵菌种种类、培养基基质、基质配比、发酵时间、接种方式、pH、温度等。陶家发等[11]通过对种子液量、pH、泡敌等条件优化构建了哈维氏弧菌、溶藻弧菌发酵工艺;商伟伟等[12]通过对4种假单胞菌产脓菌素培养基进行筛选,使其脓菌素产量最高可达到265 mg/dm3,约是基础培养基产量的7倍以上;梁永增等[13]通过对温度、pH 值、接种量、碳源、氮源、无机盐对鱼类水霉病原真菌拮抗菌菌株生长的优化,使该菌株发酵培养达到对数生长末期的时间缩短了2 h ,能较快进入菌体密度最大的时期。刘润泽等[14]通过对1株合成聚-β-羟基脂肪酸酯嗜盐菌发酵碳氮比、温度、pH值、转速及装液量等条件因子进行优化得到最佳发酵条件,PHB产量达到峰值,为5.88 g/L。分批补料技术通过控制培养过程基质浓度,解除细胞生长底物抑制,实现菌株的高密度生长与目标酶的高表达,已成为微生物发酵工艺研究和工业化应用的重要策略[15-16],马红叶等[17]构建了重组大肠埃希菌产疏绵状嗜热丝孢菌脂肪酶分批补料发酵工艺,文瑶等[18]通过补料发酵方法使乳酸产量和糖酸转化率分别提高了21.1%和21.2%,发酵周期缩短了一半。
本研究通过对盐度、培养基、接种量的优化,利用发酵罐补料发酵工艺,在5 L发酵罐可以获得1.37×1010cfu/mL活菌数。鳗弧菌在500 L发酵罐补料发酵,通气搅拌培养,10~12 h左右达到生长的最大值,活菌数可达1.20×1010cfu/mL,活菌数增加120%以上。
