扁桃蔗糖合成酶对幼果生理脱落的响应研究
2018-02-25郭春苗朱正阳木巴热克阿尤普
郭春苗,朱正阳,木巴热克·阿尤普,许 娟,肖 丽,龚 鹏,杨 波
(新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】扁桃(AmygdaluscommunisL.),蔷薇科李亚科桃属扁桃亚属植物,是世界著名珍贵干果树种,新疆喀什地区是我国扁桃的唯一主产区,栽培面积超过了百万亩,扁桃生产已成为当地农民增收的支柱产业[1]。扁桃的栽培生产中调查发现,幼果生理脱落现象严重影响产量。果树的幼果生理脱落。研究扁桃蔗糖合成酶基因功能与幼果生理落果的关系。【前人研究进展】前人研究发现,糖代谢是影响幼果生理脱落的重要因素[2]。国外内外学者在苹果[3]、梨、蜜桔[4]、柑橘、龙眼[6]等各个南北方树种上探讨了树体糖代谢与开花坐果的关系密切相关[3-9]。而糖代谢途径中蔗糖代谢是最主要的途径,处于中心位置,其合成积累及分解受多种酶的调控,其中主要由蔗糖合成酶(Sucrose Synthase,EC2.4.1.13,SuSy)和转化酶(Invertase, EC3.1.2.26, Inv)调节其分解与合成,使库源保持一定的蔗糖浓度梯度,影响蔗糖运输,因而SuSy和Inv活性的改变直接影响库强。在甜橙等果树中,在果实发育早期,SuSy是影响甜橙果实库强的主要因子[10],这一点在番木瓜[11]上也有证实。Chengappa等[12]也在转基因番茄植株幼果上发现SuSy有调控果实输入蔗糖的多少和代谢蔗糖的能力,并且SuSy既具有可催化蔗糖合成又具有可催化蔗糖分解的能力,故在蔗糖代谢中起着极其重要作用。目前国外研究者已经成功地将SuSy基因从马铃薯、甜菜、胡萝卜、水稻、玉米和甘蔗等作物中克隆出来[13]。D’Aoust等[14]研究转基因番茄更是得出SuSy有影响果实坐果和发育能力的结论。而最为干果的扁桃与其他树种不同的是,该树种春季先开花,而后叶片、新梢、果实同期迅速生长,加之新生幼嫩叶片行使光合作用功能有限,无法通过合成有机质补充树体所需养分,这种营养竞争形成了碳水化合物尤其是糖代谢变化,造成幼果生理脱落,幼果生理脱落一般持续40 d(盛花后第7~47 d)[15]。【本研究切入点】目前扁桃的蔗糖合成酶特性鲜见报道,该酶在扁桃果实生长发育过程中的作用及其与幼果脱落的关系也尚不明确。研究扁桃蔗糖合成酶对幼果生理脱落的响应研究。【拟解决的关键问题】研究以新疆主栽扁桃品种‘纸皮’为试材,选取幼果生理脱落期的7个时期采样(正常果和即将脱落果),以qRT-PCR分析扁桃幼果脱落期SuSy基因在正常果和即将脱落果中的表达模式,高效液相色谱测定幼果生理脱落期正常果和即将脱落果糖组分含量,分析蔗糖合成酶活性变化规律,以及表达量与相关糖酶活性及糖组分间的关系,阐明蔗糖合成酶在扁桃幼果发育期糖积累过程中的作用。
1 材料与方法
1.1 材 料
试验果园位于新疆喀什莎车县托木斯塘乡11村,供试品种为纸皮扁桃(AmygdaluscommunisL.cv.ZhiPi) ,2001年定植,株行距(6×7) m,中等树势,正常管理,随机标记长势一致的30株采样株用于研究田间采样。于春季纸皮扁桃开花前,在每株树冠外围东南西北四个方向选择挂果量较一致的结果枝进行标记、挂牌、编号,每株挂牌30个结果枝,用于取不同时期果实样品进行酸性转化酶的表达模式、糖组分和酶活测定分析。在幼果生理脱落期(盛花后12~42 d)内动态采样,自4月10日起每隔5 d取正常果实和即将脱落果1次,共计7次(“即将脱落果”辨别特征:在结果枝上缓慢生长暂未脱落,手指轻触果实即可脱落,果个明显比同期生长的正常果实小、果柄细,但明显比前一个采样点也即5 d前的即将脱落果实大,挂果若干天后逐渐萎缩并脱落)。于11:00从标记的30株取样株上选取发育正常的果实30~50 个,即将脱落果实30~50个,置于冰壶中立即带回实验室。样品用去离子水清洗干净液氮速冻后于超低温冰箱保存备用。
植物总RNA提取试剂盒TransZol UP、First-Strand cDNA Synthesis SuperMix、DNA Marker、Tip Green qPCR SuperMix由宝生物工程有限公司提供;引物和基因测序服务由上海生工生物科技有限公司提供;糖组分测定标准品及酶活性测定等其它常规生化试剂均为进口或国产分析纯。
1.2 方 法
1.2.1SuSy基因的表达
以纸皮扁桃幼果生理脱落期的正常果和即将脱落果为试验材料,采用TransZol UP试剂盒提取果实总RNA,1%琼脂糖凝胶电泳及NanoDrop 2000C分光光度计检测RNA纯度及浓度,检测RNA浓度和质量后,采用反转录试剂盒合成第一链cDNA,用于目标基因表达模式分析。
根据前期克隆得到的纸皮扁桃SuSy基因全长序列设计qRT-PCR 引物,分别以盛花后12、17、22、27、32、37和42 d的纸皮扁桃正常果和即将脱落果的cDNA为模板,以Prunus persica ubiquitin为内参,按照TransStart Tip Green qPCR SuperMix试剂盒中的方法,利用罗氏LightCycler96荧光定量PCR仪,检测SuSy基因在正常果和即将脱落果在幼果脱落期的表达模式。
20 μL实时荧光定量PCR反应体系包括:2×TransStart Tip Green qPCR SuperMix 10 μL、cDNA模板2 μL、10 μmol/L上下游引物各1 μL、ddH2O 6 μL。反应程序为: 95℃ 15 min预变性,55个循环(变性95℃ 10 s,58℃ 20 s,72℃ 20 s),从40℃升温到99℃的熔解过程。每个样品进行3个生物学重复和3个技术重复,取3次重复试验的平均值,运用CT法(2-ΔΔCt)分析SuSy基因相对于内参基因的表达变化趋势。表1
表1 引物序列
Table 1 Sequences of primers

引物名称Primername引物序列 Primer sequence(5’→3’)正向 Forword反向 ReverseReal-SUSY-S & Real-SUSY-ASAGTTCCTTTTAGATCGGAGATAAGCCAACAAAGATGCAACUbiquitin -s & Ubiquitin -asTGCGTCTGAGGGGTGGTAATAGTCGGCCAGAGTCCTTC
1.2.2 糖组分及酶活性测定
纸皮扁桃幼果生理落果期果实中蔗糖、葡萄糖、果糖积累水平的动态变化测定采用高效液相色谱法,参照张丽丽等[16]方法,浓度的单位为mg/g FW;酶液制备参考KELLER F[17](1993)的方法;蔗糖合成酶(SuSy)活性测定参照MIRON[18]的方法,酶的活性单位为mg/(h·g) FW。
1.3 数据处理
试验结果统计分析采用DPS 9.50 和Excel 2010 统计分析软件完成。
2 结果与分析
2.1 SuSy基因在幼果生理脱落期的表达
研究表明,SuSy基因在幼果生理脱落期中各时期均有表达,但在正常果与即将脱落果中表达不尽一致。SuSy基因的表达量在正常果中呈现前期缓慢降低,中期大幅升高而后期又下降的趋势;而在即将脱落果中呈现前期降低,中期升高而后降低至最低值,后期陡然又升高的趋势。
正常果与即将脱落果在花后12 d至花后17 d均呈现降低趋势,而不同的是,正常果的降低趋势一直持续到花后第27 d,即将脱落果则在花后17 d至花后27 d呈缓慢上升状态;花后27 d后,正常果SuSy基因的表达量快速增加,至第37 d达到峰值,然后降低趋于平缓,即将脱落果的SuSy基因的表达量则在第27 d开始减少,至第37 d达到最低值,而后陡升趋于平缓。
纵观整个幼果生理脱落期(花后第7~47 d),除第22~27 d的即将脱落果SuSy基因的表达量高于正常果,其他时期正常果实的SuSy基因表达量均高于即将脱落果。正常果的SuSy基因总表达量在幼果生理脱落前期(花后第7~27 d)较幼果生理脱落后期(花后第27~47 d)低,而即将脱落果的SuSy基因总表达量在幼果生理脱落前期(花后第7~27 d)较幼果生理脱落后期(花后第27~47 d)高。
在扁桃幼果生理脱落的7个时期,正常果和即将脱落果中SuSy的表达存在着差异性,SuSy基因表达量的变化规律也从侧面反应出正常果和落果的果实内部糖代谢差异现象,与落果规律[10]基本吻合,可推测SuSy基因参与调节植物抗逆并感知糖信号进而调节糖组分含量来响应落果。图1
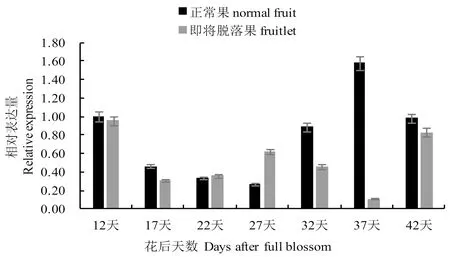
图1 纸皮扁桃果实SuSy基因生理落果期表达模式
Fig.1 SuSy gene expression of ‘zhipi’Almond in physiological furit drop period
2.2 生理落果期果实糖组分含量的动态变化
研究表明,正常果和即将脱落果中蔗糖的浓度均表现为逐步缓慢升高的趋势;即将脱落果中的蔗糖浓度始终大于正常果,其中盛花后12、32 d正常果和即将脱落果间差异达显著水平;即将脱落果中蔗糖浓度的低值出现在落果高峰期(盛花后第22 d);正常果和即将脱落果中葡萄糖的浓度总体呈现为逐步升高的趋势,但正常果中葡萄糖积累的速度明显大于即将脱落果(正常果中平均含量为26.44 mg/g FW,即将脱落果中为12.55 mg/g FW);果实中果糖的变化趋势与葡萄糖相似,正常果中果糖的浓度呈明显的上升趋势,而即将脱落果中果糖积累速度十分缓慢(正常果中平均含量为6.65 mg/g FW,即将脱落果中为2.20 mg/g FW)。
在扁桃果实膨大的过程中,扁桃果实中蔗糖、葡萄糖和果糖是不断积累的过程,且葡萄糖﹥果糖﹥蔗糖,说明幼果发育期葡萄糖起主要作用;即将脱落果中的蔗糖浓度始终大于正常果,而即将脱落果中的葡萄糖和果糖则显著低于正常果实,说明即将脱落果中的蔗糖还未来得及转化为葡萄糖、果糖等就已发生脱落。图2

图2 纸皮扁桃果实生理落果期糖组分含量
Fig.2 Content of sugar of zhipi Almond in physiological furit drop period
2.3 生理落果期果实SuSy酶活性的动态变化
2.3.1 生理落果期果实SuSy分解方向酶活的动态变化
研究表明,在整个扁桃生理落果期,正常果和即将脱落果的SuSy分解方向酶活性总体均呈现一致的反复波动趋势,且在整个扁桃生理落果期正常果实的SuSy分解方向酶活性始终高于即将脱落果;在生理落果初期(盛花后7~17 d),正常果与即将脱落果中SuSy分解方向酶活性均呈现上升的趋势且盛花后17 d分别达到其峰值(正常果为50.83 mg/(h·g) FW,即将脱落果为46.89 mg/(h·g) FW),而后至27 d则呈现缓慢下降的趋势,再在盛花后第27~32 d经历小幅度上升后,至第37 d又下降,最后缓慢升高至生理落果期结束;在即将达到生理落果高峰期(盛花后第17~22 d)时,二者SuSy分解方向酶活性均呈总体下降趋势;快速脱落期(盛花后7~22 d)正常果和即将脱落果的SuSy分解方向酶活性明显高于缓慢脱落期(盛花后第 22~47 d)。
SuSy分解方向酶活性在果实发育初期及幼果脱落前期活性较高,说明该时期该分解方向酶具有分解蔗糖供给组织生长提供碳源的作用,有抵抗幼果脱落的抗逆行为。而随着生长发育以及幼果生理脱落期的推移,扁桃果实膨大,SuSy分解方向酶活性逐渐降低趋于平缓,使蔗糖得以积累。在快速脱落期,正常果和即将脱落果中SuSy分解方向酶活性变化幅度较大,而在缓慢脱落期该酶活性则变化较小且趋于平缓;该分解方向酶活性在落果前期(盛花后第17 d)正常果和即将脱落果中均达峰值,而随着落果高峰期(盛花后第22 d)的到来活性下降,说明生理落果前期果实内部该分解方向酶积极响应蔗糖分解提供能量,参与果实脱落抗逆活动,变化趋势与落果规律趋于吻合,证实SuSy分解方向酶活性与扁桃果实脱落有着密切关系。图3
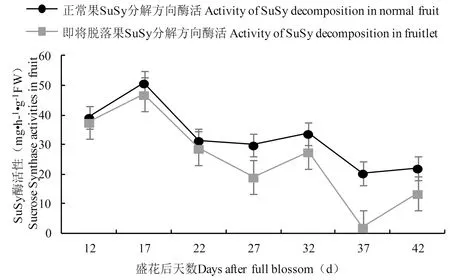
图3 生理落果期果实中SuSy分解方向酶活性的动态变化
Fig.3 The dynamic changes ofSuSy’sdecomposition activities in fruit
2.3.2 生理落果期果实SuSy合成方向酶活的动态变化
研究表明,在整个扁桃生理落果期,正常果和即将脱落果的SuSy合成方向酶活性波动趋势不尽相同。除盛花后12~17 d即将脱落果SuSy合成方向酶活性有明显的升高外,后续时期正常果与即将脱落果SuSy合成方向酶活性变化趋势较为一致;正常果和即将脱落果的SuSy合成方向酶活性极显著差异产生在盛花后第17 d(即将到达落果高峰第22 d);在生理落果的快速脱落期间(盛花后7~22 d),正常果的SuSy合成方向酶活性始终持下降趋势,而即将脱落果的SuSy合成方向酶活性在12~17 d有小幅上升后,自17 d后变化与正常果一致,均呈现下降的趋势且持续到盛花后第27 d;缓慢脱落期(盛花后23~47 d)较快速脱落期(盛花后7~22 d),正常果和即将脱落果的SuSy合成方向酶活性较低,均有小幅波动,最后稳定至生理落果期结束。
在扁桃幼果生理脱落前期,正常果实的SuSy合成方向酶活性是下降的,而即将脱落果实的SuSy合成方向酶活性则是上升的,说明该时期正常果实SuSy合成方向是受抑制的,SuSy在这一阶段主要行使分解蔗糖的功能,响应糖组分的代谢以此来供给组织生长的需要,这有利于组织成熟从而抵抗幼果的脱落。随着果实生长发育日益成熟,光合作用加强,SuSy合成方向酶活性有回升并趋于平缓,使蔗糖合成增加。可以发现,在幼果生理脱落前期果实内是抑制SuSy合成方向酶活性的,可推测果实通过糖代谢机制调控SuSy活性来积极预防幼果脱落,分析正常果和即将脱落果的SuSy合成方向酶活性变化趋势与落果规律基本吻合,说明SuSy合成方向酶活性与扁桃果实脱落之间存在内部联系。图4

图4 生理落果期果实中SuSy合成方向酶活性的动态变化
Fig.4 The dynamic changes ofSuSy’ssynthesis activities in fruit
3 讨 论
蔗糖合成酶是促使蔗糖进入各种代谢途径的关键酶之一,在果树糖代谢途径中占有很重要的地位。研究表明,SuSy不但影响植物的产量、蔗糖成分和淀粉含量、植物品质,还参与植物非生物胁迫等过程,一般认为SuSy主要起分解蔗糖的作用,为多糖、细胞壁和淀粉合成提供前体和底物,虽然有关植物蔗糖代谢的生化过程已基本清楚,但其内在分子机理仍在探索中[19]。研究通过对扁桃SuSy基因qRT-PCR分析发现不论是在正常果还是即将脱落果中,SuSy基因在各时期都有表达,而且表达量随着幼果脱落规律发生着相应变化,这一点与学者在蜜柑[20]、脐橙[21]、桃[22]等果树上的研究结果一致。
在研究中,幼果快速脱落期(盛花后7~22 d),正常果SuSy表达量自盛花后第12 d始随着果实发育持续走低,至盛花后第27 d表达量达最低值,而即将脱落果的SuSy表达量自花后22 d开始回升,结合观察糖组分的变化趋势,发现在这一时期所有样品中,葡萄糖浓度﹥果糖浓度﹥蔗糖浓度,且正常果的葡萄糖和果糖浓度均大于即将脱落果的葡萄糖和果糖浓度,正常果的蔗糖浓度小于即将脱落果的蔗糖浓度,说明由于扁桃是先开花,而后果叶同期迅速生长,需要消耗大量养分,在幼叶成长为功能叶之前,果叶存在营养竞争关系,二者都是扮演“库”的角色,需要大量还原糖(即葡萄糖和果糖)供能,树体为抵制竞争引发的幼果脱落而会抑制蔗糖的合成,SuSy受营养胁迫表达量降低,与此同时即将脱落果的持续降低的SuSy合成方向酶活性也恰达最低值,而SuSy分解方向酶活开始回升,因此,推测在幼果快速脱落期也即营养竞争较为激烈的时期SuSy能识别糖信号并主要行使分解蔗糖功能,这也与赵智中[20]、张春华[22]、Elling[23]等研究一致。随着时间推移营养竞争愈加明显,至盛花后第27 d达到最激烈的节点,此节点营养胁迫导致了正常果中SuSy基因的最低表达。在幼果缓慢脱落期(盛花后23~47 d),正常果中的SuSy基因量表达开始回升,至花后第32 d达峰值,后下降平缓至落果期结束,而即将脱落果中的SuSy基因表达量小幅回升,至花后第32 d达谷值,后回升平缓至落果期结束;同时在所有样品中SuSy酶活性较幼果快速脱落期是降低的且呈波动下降趋势;结合观察这一时期糖组分变化发现葡萄糖、果糖浓度仍远大于蔗糖浓度,且正常果葡萄糖、果糖浓度仍远大于即将脱落果的葡萄糖、果糖浓度。但是蔗糖浓度自花后22 d开始回升,即将脱落果中蔗糖浓度大于正常果中蔗糖浓度。可以看出,扁桃在渡过其幼果生理快速脱落期后,幼嫩叶片逐渐成长为功能叶,叶片会实现从“库”至“源”的角色转变,幼果和新叶之间的营养竞争逐渐减轻,SuSy基因表达量得以回升,分解方向的酶活降低,合成方向酶活回升,使得蔗糖的分解程度减轻,果实开始积累蔗糖,这也与前人研究较为吻合[5,6,8]。此外,即将脱落果中的葡萄糖和果糖浓度显著低于正常果,而蔗糖浓度却高于正常果也说明即将脱落果中的蔗糖还未来得及转化为葡萄糖、果糖等就已发生脱落。
4 结 论
扁桃蔗糖合成酶是贯穿整个扁桃幼果生理脱落过程中的关键酶,具有参与调节果实糖组分以及响应脱落作用,在扁桃幼果生理脱落期间SuSy酶主要在分解方向上起作用,但即将脱落果的蔗糖分解代谢相对于正常果出现了异常造成部分果实糖代谢紊乱导致脱落。
参考文献(References)
[1] 李疆,胡芳名,李文胜, 等. 扁桃的栽培及研究概况[J].果树学报,2002,(5):346-350.
LI Jiang, HU Fang-ming, LI Wen-sheng, et al. (2002). Advances of Almond Growing and Research [J].JournalofScience, (5):346-350. (in Chinese)
[2]刘玉冰, 张腾国, 李新荣,等. 红砂(Reaumuria soongorica)忍耐极度干旱的保护机制:叶片脱落和茎中蔗糖累积[J]. 中国科学, 2006, 36(4):328-333.
LIU Yu-bing, ZHANG Teng-guo, LI Xin-rong, et al. (2006). Protective mechanism of desiccation tolerance in Reaumuria soongorica: Leaf abscission and sucrose accumulation in the stem [J].ScienceChina, 36(4):328-333.
[3]吕忠恕,王邦锡,盧崇恩, 等. 苹果和梨幼果脱落期中的代谢变化[J].园艺学报,1963, (3):261-270.
LÜ Zong-su, WANG Bang-xi, LU Chong-en, et al. (1963). Metabolic changes in apple and pear young fruit during shedding [J].ActaHorticulturaeSinica, (3):261-270. (in Chinese)
[4]Aurelio Gómez-Cadenas, Mehouachi, J. , Tadeo, F. R. , Primo-Millo, E. , & Talon, M. . (2000). Hormonal regulation of fruitlet abscission induced by carbohydrate shortage in citrus.Planta, 210(4): 636-643.
[5]付崇毅. 日光温室柑橘诱导成花及落果机理研究[D].呼和浩特:内蒙古农业大学博士学论文,2013.
FU Chong-yi. (2013).StudyonMechanismofFlowerInductionandFruitletAbscissionofCitrusunderSolarGreenhouse[D]. PhD Dissertation. Inner Mongolia Agricultural University, Hohhot. (in Chinese)
[6]杨子琴,李茂,章笑赟, 等. 饥饿胁迫对龙眼果实脱落及糖代谢的影响[J].果树学报,2011,28(3):428-432.
YANG Zi-qin, LI Mao, ZHANG Xiao-yun, et al. (2011). Effects of starvation stress on fruit abscission and sugar metabolism in longan [J].JournalofFruitScience, 28(3):428-432. (in Chinese)
[7]Finazzo, S. F., Davenport, T. L., & Schaffer, B. (1994). Partitioning of photoassimilates in avocado (Persea americana Mill.) during flowering and fruit set.TreePhysiology, 14(2): 153-164.
[8]黄永敬,马培恰,吴文, 等 . 砂糖橘夏梢生长对果实糖代谢及脱落的影响[J].园艺学报,2013,40(10):1 869-1 876.
HUANG Yong-jing, MA Pei-qia, WU Wen, et al. (2013). Effects of Summer Shoot Growth on Sugar Metabolism and Abscission of Fruitlet in'Shatangju' Mandarin [J].ActaHorticulturaeSinica, 40(10):1,869-1,876. (in Chinese)
[9]曾庆钱,蔡岳文,严振, 等. 化橘红生理落果与若干生理生化指标的关系[J].亚热带植物科学,2008,(3):19-21.
ZENG Qing-qian, CAI Yue-wen, YAN Zhen, et al. (2008). Relationship between Physiological Drop and Some Physiological and Biochemical Indexes of Citrus grandis 'Tomentosa' [J].SubtropicalPlantScience, (3):19-21. (in Chinese)
[10]Echeverria, E. (1990). Developmental transition from enzymatic to acid hydrolysis of sucrose in acid limes (Citrus aurantifolia).PlantPhysiology, 92(1): 168-171.
[11] Zhou L, Paull R E. (2001).Sucrose Metabolism During Papaya (Carica papaya) Fruit Growth and Ripening.AmSocHorticSci, 126(3): 351-357.
[12] Chengappa, S., Guilleroux, M., Phillips, W., & Shields, R. (1999). Transgenic tomato plants with decreased sucrose synthase are unaltered in starch and sugar accumulation in the fruit.PlantMolecularBiology, 40(2): 213-221.
[13]卢合全,沈法富,刘凌霄, 等. 植物蔗糖合成酶功能与分子生物学研究进展[J].中国农学通报,2005 (7):34-37, 57.
LU He-quan, SHEN Fa-fu, LIU Ling-xiao, et al. (2005). Recent Advances in Study on Plant Sucrose Synthase[J].ChineseAgriculturalScienceBulletin, (7):34-37, 57. (in Chinese)
[14] Marc-André D'Aoust, Yelle, S., & Binh Nguyen-Quoc. (1999). Antisense inhibition of tomato fruit sucrose synthase decreases fruit setting and the sucrose unloading capacity of young fruit.PlantCell, 11(12): 2,407-2,418.
[14]张丽丽,刘威生,刘有春, 等.高效液相色谱法测定5个杏品种的糖和酸[J].果树学报,2010,27(1):119-123.
ZHANG Li-li, LIU Wei-sheng, LIU You-chun, et al. (2010). Determination of Sugar and Acid in Five Apricot Varieties by High Performance Liquid Chromatography [J].TheFruitTreeJournal27(1): 119-123. (In Chinese)
[15]Keller, F., & Ludlow, M. M. (1993). Carbohydrate metabolism in drought-stressed leaves of pigeonpea (cajanus cajan).JournalofExperimentalBotany, 44(265):1,351-1,359.
[16]杨波,车玉红,郭春苗. 扁桃生理落果期不同组织激素浓度的动态变化及其对落果的影响[J].西北植物学报,2015,35(1):118-124.
YANG Bo, CHE Yu-hong, GUO Chun-miao. (2015). ynamic changes of hormones in the different tissue of Almond during the physiological fruit drop and its effect on fruit drop [J].ActaBotanicaBoreali-OccidentaliaSinica, 35(1):118-124. (in Chinese)
[17]Miron, D., & Schaffer, A. A. (1991). Sucrose phosphate synthase, sucrose synthase, and invertase activities in developing fruit of lycopersicon esculentum mill. and the sucrose accumulating Lycopersicon hirsutum humb. and bonpl.PlantPhysiology, 95(2): 623-627.
[18]秦翠鲜,桂意云,陈忠良,等.植物蔗糖合成酶基因研究进展[J].分子植物育种,2018,16(12):3 907-3 914.
QIN Cui-xiang, GUI Yi-yun, CHEN Zhong-liang, et al. (2018). The Progress of Studies on Sucrose Synthase Genes in Plants [J].MolecularPlantBreeding, 16(12):3,907-3,914. (in Chinese)
[19]赵智中,张上隆,徐昌杰,等.蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J].园艺学报,2001,(2):112-118.
ZHAO Zhi-zhong, ZHANG Shang-long, XU Chang-jie, et al. (2001). The Role of Sucrose Metabolism Related Enzymes in Sugar Accumulation in Citrus Fruits of Wenzhou [J].ActaHorticulturaeSinica, (2):112-118. (in Chinese)
[20]龚荣高, 张光伦, 吕秀兰,等. 脐橙果实糖积累与蔗糖代谢相关酶关系的研究[J]. 四川农业大学学报, 2004, 22(1):34-36.
GONG Rong-gao, ZHANG Guang-lun, LÜ Xiu-lang, et al. (2004). Study on the Relationship between the Sugar Accumulation and Its Metabolizing Enzymes in Navel Orange Fruit [J].JournalofSichuanAgriculturalUniversity, 22(1):34-36. (in Chinese)
[21]张春华, 俞明亮, 马瑞娟,等. 桃不同发育时期主要糖类含量和蔗糖合成酶基因表达水平的动态变化[J].江苏农业学报, 2014,(6):1 456-1 463.
ZHANG Chun-hua, YU Ming-liang, MA Rui-juan, et al. (2014). Dynamic changes of carbohydrate content and expression level of sucrose synthase genes in peach (Prunus persica) at different developmental stages [J].JiangsuJournalofAgriculturalSciences, (6):1,456-1,463. (in Chinese)
[22]Elling, & Lothar. (1995). Effect of metal ions on sucrose synthase from rice grains-a study on enzyme inhibition and enzyme topography.Glycobiology, 5(2): 201-206.
