人工寒潮促发糖尿病大鼠脑卒中发病前脑组织中细胞粘附因子的变化
2018-02-22席秋江韩莉楼小亮
席秋江,韩莉,楼小亮
(南昌大学第四附属医院神经内科,南昌 330003)
流行病学调查和临床观察表明,在寒冷季节脑血管病的发病率明显增高[1-3],对多项气象因素的进一步研究发现气温骤降是脑血管病最重要的预测因子[4]。关于低温诱发脑血管病发病的机制还不十分清楚,大多数学者目前认为可能的发生机制有[5,6]:血压、血脂浓度、纤维蛋白浓度和血小板黏附。血管内皮细胞当受刺激后表达大量的细胞粘附分子,不但可与血小板附着,同时可导致循环中单核细胞进入血管壁,趋化巨噬细胞和T淋巴细胞,进而释放大量炎性介质,最终导致动脉粥样斑块的形成。因此,细胞粘附分子在脑血管病的发生过程中有极其重要的作用。糖尿病(diabetes mellitus,DM)是脑血管疾病的主要危险因素之一,与动脉粥样硬化及血栓形成有关[7]。但细胞粘附分子在寒潮诱发有DM基础的脑卒中过程中所起的作用尚未明确。本研究利用寒潮作为诱因研究大鼠脑卒中的发病情况,探讨脑卒中的发病机制,为针对性预防冬季脑卒中发病提供理论依据。
1 材料与方法
1.1 动物与分组 选用健康雄性老年Sprague-Dawley(SD)大白鼠38只。在饲养和寒潮过程中出现脑卒中症状和体征的均被剔除。进行分组:分为正常对照寒潮组7只、正常对照非寒潮组7只、DM寒潮组12只和DM非寒潮组12只等4个亚组。
1.2 人工模拟寒潮 按照国家气象局规定的标准,寒潮是指日平均气温在24h内急剧降温8℃或以上(或48h内降温10℃或以上),而且整个过程最低气温≤5℃。按照Li C[8]模拟人工寒潮,寒潮组置于人工气候箱(宁波江南仪器厂)中,保持相对湿度65%不变,寒潮温度设置以22℃ 12h,4℃ 12h为1d一个周期,共3个周期。非寒潮组置于相对湿度65%,温度22℃的人工气候箱共3个周期。
1.3 DM模型鼠的制备 参照文献[9]制作DM模型。
1.4 观测项目 注射STZ 4周后测量大鼠的体重、空腹血糖和空腹胰岛素激素水平,并计算胰岛素敏感指数 ISI=[1/(空腹血糖值×空腹胰岛素值)]。寒潮处理前后定期测量体重、空腹血糖和空腹胰岛素水平,每天多次观察大鼠的一般活动情况。
1.5 标本的取材和制备 以寒潮3d、出现偏瘫症状或意识障碍、死亡为研究终点,在研究终点处死大鼠。大鼠以10%水合氯醛腹腔注射麻醉后,开胸,经主动脉灌流37℃生理盐水200ml,继以400ml 4%多聚甲醛固定液灌流固定,取脑入上述固定液中后固定约6h(4℃)后转入30%蔗糖4℃过夜。第2d行恒冷箱冰冻切片(30μm)。视交叉层面每8张取1张切片作免疫组化;视交叉层面的其余切片及其余脑片连续切片后作HE染色,发生脑卒中者被剔出卒中前状态的分析。每亚组随机抽取6只大鼠标本作免疫组化染色。
1.6 免疫组织化学ABC染色 按下列步骤对切片进行免疫组织化学反应(ABC法):⑴含1%Triton X-100和0.03%H2O2的0.01mol/L PBS室温30min;⑵含 3%牛血清白蛋白(BSA,Pierce)和 1%正常羊血清 (NGS,Vector)的0.01mol/L PBS室温30min;⑶兔抗 ICAM-1(1:50,美国 Sigma 公司)、VCAM(1:50,美国 Sigma 公司)、P-选择素(1:50,美国Sigma公司),室温孵育过夜。抗体用含3%BSA和1%NGS的0.01mol/L PBS稀释;⑷0.01mol/L PBS漂洗3次,每次10min;⑸生物素化羊抗兔IgG(1:200,Vector) 室温 2h; ⑹0.01mol/L PBS 漂洗 3次,每次 10min;⑺ABC(1:100,Vector)室温 2h;⑻0.01mol/L PBS漂洗3次,每次10min;⑼含0.03%DAB和0.006%H2O2的Tris盐酸缓冲液室温10-15min。⑽常规脱水、透明、树脂封片;⑾普通光学显微镜观察,拍照,所得图片用Image-pro plus 6.0图像分析软件分析。
1.7 统计学分析 数据采用SPSS 16.0统计软件进行统计分析。计量资料数据用均数±标准差(x±s)表示,两组间均数比较采用One-Way ANOVA检验,多组间均数比较用S-N-K法。P<0.05认为差异有统计学意义。
2 结果
2.1 注射STZ 4周后动物模型评估 DM组注射STZ 4周后共有18只大鼠造模成功。DM组的体重与正常对照组的比较,两者差异有统计学意义(P<0.05),但DM组的空腹血糖和胰岛素水平较正常对照组的明显增高,差异具有统计学意义 (P<0.01),DM组的胰岛素敏感性较正常对照组减低,差异具有统计学意义(P<0.05)。见表1。寒潮前DM组大鼠观察可见三多一少症状,毛发和垫料潮湿,而放入寒潮后在开始降温时大鼠处于一种 “易激惹”状态,当环境温度低于10℃时,大鼠逐渐趋于平静,出现被毛竖立、寒颤,饮水和进食均减少,但排尿增多。在实验过程中,正常对照组和DM非寒潮组均无卒中症状或体征出现,而DM组在寒潮后有1只大鼠Longa评分3分,另2只大鼠死亡。

表1 注射STZ后4周大鼠体重、空腹血糖、胰岛素和胰岛素敏感性的变化
2.2 免疫组化结果
2.2.1 脑组织中ICAM-1水平表达的变化 各组大鼠脑皮质中均见ICAM-1阳性表达的神经元细胞。正常对照寒潮组与正常对照非寒潮组比较,大脑皮质中的ICAM-1的光密度值无明显差异 (P>0.05)。DM组与正常对照组比较,DM组的脑皮质中的ICAM-1阳性神经元表达的光密度值明显升高,差异具有统计学意义(P<0.05,)。DM寒潮组与DM非寒潮组比较,DM寒潮组的大鼠脑皮质中的ICAM-1阳性神经元表达的光密度值明显升高,差异具有统计学意义(P<0.05)。 (见图 1、图 3)。

图1 各组大鼠脑皮质中ICAM-1的表达变化

图3 各组大鼠脑皮质中ICAM-1光密度值比较
2.2.2 脑组织中VCAM-1水平表达的变化 各组大鼠脑皮质中均可见VCAM-1阳性表达的神经元细胞。正常对照寒潮组与正常对照非寒潮组比较,大脑皮质中的VCAM-1阳性神经元表达的光密度值无明显差异 (P>0.05)。DM组与正常对照组比较,DM组大鼠的脑皮质中VCAM-1阳性神经元表达的光密度值明显升高,差异具有统计学意义(P<0.05)。DM寒潮组与DM非寒潮组比较,DM寒潮组的大鼠脑皮质中VCAM-1阳性神经元表达的光密度值明显升高,差异具有统计学意义(P<0.05)。(见图 2、图 4)。

图2 各组大鼠脑皮质中VCAM-1的表达变化

图4 各组大鼠脑皮质中VCAM-1光密度值比较
2.2.3 脑组织中P一选择素水平表达的变化 各组大鼠脑皮质、海马、丘脑中均可见P-选择素阳性表达的神经元细胞,尤以脑皮质表达显著。正常对照寒潮组与正常对照非寒潮组比较,大脑皮质中的P-选择素阳性神经元表达的光密度值无明显差异 (P>0.05)。DM组与正常对照组比较,DM组大鼠的脑皮质中P-选择素阳性神经元表达的光密度值明显升高,差异具有统计学意义 (P<0.05)。DM寒潮组与DM非寒潮组比较,DM寒潮组的大鼠脑皮质中P-选择素阳性神经元表达的光密度值明显升高,差异具有统计学意义(P<0.05)。(见图 5、图 6)。

图5 各组大鼠脑皮质中P-Selectin的表达变化
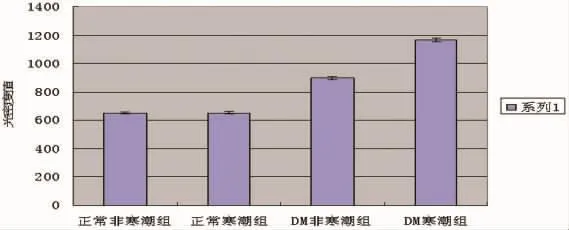
图6 各组大鼠脑皮质中P-选择素光密度值比较
3 讨论
研究表明寒冷是脑血管病发生的重要外部诱发因素。在严重的脑血管病变基础上,寒潮作用后更易于促发脑卒中。本研究选取寒潮作为诱因,探讨脑卒中的发病机制。
细胞粘附分子是一类调节细胞与细胞间、细胞与细胞外基质间相互结合,起粘附作用的膜表面糖蛋白。具有代表性的ICAM-1、VCAM-1、P-选择素均高表达于脑血管内皮细胞,当内皮细胞受刺激后表达大量的细胞粘附分子,即使无内皮下组织暴露也可以与血小板附着。阻断细胞粘附分子的异常表达可能抑制或消除脑卒中的发生和发展,因而细胞粘附分子在脑卒中的发生过程中具有极其重要的作用。因此本实验以建立糖尿病大鼠模型,通过寒潮进行诱发脑卒中,探讨极端气候对脑血管病发病的影响及其机制,预期为脑血管病防治提供理论依据。
许多动物实验研究表明:脑梗塞后ICAM-1、VCAM-1或P-选择素均有明显表达上调[10-14],临床上也有研究进一步表明:脑梗塞后脑组织中ICAM-1和血液中可溶性ICAM-1表达水平的增高[15-17],与神经系统功能损伤密切相关。林健雯等[18]在人工寒潮促发脑卒中发病的机制研究中发现SD大鼠<220mmHg高血压组中,寒潮亚组的脑血管内皮 ICAM-1、VCAM-1、P-选择素的 mRNA表达与蛋白表达比非寒潮亚组均有升高趋势。
本研究发现,DM组大鼠脑组织内ICAM-1、VCAM-1、P-选择素等水平明显高于正常对照组,这提示DM对大鼠脑血管内皮功能具有损伤作用,从而导致ICAM-1、VCAM-1、P-选择素的表达上调。这可能与糖代谢紊乱引起糖化血红蛋白升高、蛋白质的非酶糖化、血小板功能异常、微循环障碍、组织缺血、缺氧等导致血管内皮细胞损伤后使ICAM-1、VCAM-1、P-选择素等分泌增加有关。对照组大鼠在寒潮后ICAM-1、VCAM-1、P-选择素的表达与寒潮前相比也略有增高,但无明显统计学差异。而DM组大鼠经历3d人工寒潮后,脑组织内ICAM-1、VCAM-1、P-选择素的表达均明显高于DM非寒潮组。这提示寒潮对正常大鼠脑血管内皮影响并不明显,而对长期患有基础疾病 (糖尿病)的大鼠影响非常大,极易导致心脑血管病的发生,甚至死亡的危险。这与国内外许多文献报道寒冷对脑卒中具有促进作用的观点相一致。
细胞粘附分子参与寒冷促进脑卒中发生的病理过程,其作用机制可能有以下几点:⑴促凝作用;⑵促炎作用;⑶促进兴奋性氨基酸(EAA)、自由基、髓过氧化物酶(MPO)和蛋白水解酶等神经毒性物质的释放。
本实验研究的均是卒中前的大鼠,我们认为细胞粘附分子表达增高可能参与寒冷促使脑卒中发生的发病机制。目前也有许多在动物试验中使用敲除细胞粘附分子[19,20]和抗细胞粘附分子抗体[21-23]对脑卒中模型进行干预,取得了一定的效果,但临床应用尚待开拓,故还需进一步研究来证实细胞粘附分子在脑血管疾病临床和治疗方面的作用机制,为脑卒中的预防和治疗提供新的思路。
