NEFA BHBA对体外培养牛肝细胞的HP和SAA mRNA表达的影响
2018-02-18于啸洋于孔森李明皓张国庆郝景锋
宰 翔,于啸洋,于孔森,李明皓,张国庆,王 佟,郝景锋
(吉林农业科技学院,吉林 吉林 132101)
奶牛酮病发生过程中由于机体处于能量负平衡状态,脂肪动员加剧,在此过程中产生大量的非酯化脂肪酸(NEFA),而这些物质的生成速度远远超过了肝脏通过氧化代谢排出的速度,以生成甘油三酯的形式在肝脏内蓄积[1],会对肝脏产生较大刺激,由于这种应激性因素的作用,会对由肝脏合成的急性期反应蛋白HP和SAA产生较大影响,但具体会产生哪些变化目前还不清楚,NEFA以及BHBA作为机体中间代谢产物,在酮病发生时,它们的浓度会发生显著的变化,肝脏作为脂类物质的主要代谢器官,起着重要的作用,而NEFA和BHBA可能是脂类代谢关键的调节因素。众多的研究者采用了荧光定量PCR法检测了在长途运输以及炎症产物的刺激下对各种动物的急性期反应蛋白的表达的影响,取得了令人满意的效果。
本研究采用的是利用贴壁法[2]培养新生犊牛原代肝细胞,于培养72 h通过添加(0、0.6、1.2、2.4 mmol/L)NEFA 以及(0、0.6、1.2、2.4 mmol/L)BHBA,培养24 h后收样,无菌提取肝细胞总RNA,反转录为cDNA,通过荧光定量PCR法测定NEFA、BHBA对体外培养牛肝细胞的HP和SAA mRNA表达的影响,通过体外试验进一步验证NEFA、BHBA等代谢产物对急性期反应蛋白HP、SAA表达的影响,为进一步揭示奶牛酮病发病机理、奶牛酮病时机体免疫状态以及合理有效治疗与预防奶牛酮病奠定一定的理论依据和试验基础。
1 材料与方法
1.1 试验材料 载体及宿主菌pMD-18T Vector,购自TaKaRa公司;E.coli DH5α宿主菌为吉林大学动物营养代谢与中毒病实验室自制。
1.2 试剂 肝细胞6孔培养板,购自Gibco公司;低糖DMED培养基,HEPES,新生牛血清,以及Ⅳ型胶原酶等,均购自Gibco公司;TRIZol RNA提取试剂盒,购自Invitrogen公司;Tris和X-gal为Promega产品;焦磷酸二乙酯(DEPC),购自Sigma公司;多聚赖氨酸、胰岛素均系Sigma公司产品;标准分子量DNA Marker DL-2 000(分子量为100~2 000 bp)、DNA凝胶回收试剂盒、dNTPs(2.5 mmol/L each)、反转录酶AMV、ExTaq DNA聚合酶、Oligo dT、RNase Inhibitor、限制性内切酶,购自TaKaRa公司。
1.3 肝细胞的分离与培养 肝细胞分离与培养采用贴壁法[2]。
1.4 试验分组 试验分为8组包括BHBA(0、0.6、1.2、2.4 mmol/L)[5]和 NEFA(0、0.6、1.2、2.4 mmol/L)组。
1.5 引物的设计和合成 从GenBank中查阅出奶牛的HP、SAA基因序列,利用Primer Express 5.0设计软件进行引物设计,由长春华大中天生物技术有限公司合成。目的基因引物的设计见表1。

表1 PCR引物
1.6 肝脏组织中RNA提取 小牛肝脏组织50~100 mg,加入适量液氮研磨,收集至1.5 mL离心管中,分别加入TRIZol和氯仿,取上清液加入等量的异丙醇,加入75%乙醇沉淀后DEPC处理[3],样品放入-80℃保存。
1.7 样品RNA反转录 具体方法根据反转录试剂盒说明书进行(TaKaRa)。
1.8 PCR扩增基因以上反应得cDNA为模板,进行PCR扩增,体系见表2。

表2 PCR反应体系
PCR反应条件见表3。

表3 PCR反应条件
1.9 PCR产物回收 PCR产物回收选用的是AxyPrep DNA胶回收试剂盒,按试剂盒操作说明书进行操作。
1.10 目的基因克隆 首先将目的基因与载体连接。构建成重组克隆质粒 pMD-SAA、pMD-HP、pMD-β-actin连接反应体系见表4。

表4 连接反应体系
1.11 重组质粒转化 取上述4管感受态细胞,分别加入5 μL 连接产物(空载体、pMD-HP、pMD-SAA和pMD-β-actin),静止30 min后42℃水浴加热1 min[4],放置冰上(4℃)后加入LB液体培养基置于37℃摇床中培养。
1.12 重组质粒的PCR鉴定 PCR鉴定以上提取的质粒,对照选取阴性质粒。反应物用琼脂糖凝胶电泳法进行鉴定。
1.13 SAA、HP、β-actin基因序列测定 将鉴定正确的阳性质粒送到生工生物工程(上海)股份有限公司进行核苷酸序列测定。对测序结果进行BLAST比对确定引物是否设计符合要求。
1.14 样品中HP、SAA mRNA水平的定量检测HP、SAA以及β-actin基因的荧光定量PCR反应条件体系见表5,反应条件见表6。

表5 RT-qPCR反应体系

表6 RT-qPCR反应条件
1.15 数据分析 数据用X-±SD表示,用SPSS 13.0软件进行分析,组间差异显著性用ANOVA(方差分析)。
2 试验结果
2.1 肝细胞总RNA的提取 如图1所示,自肝细胞中提取的总RNA通过1%琼脂糖凝胶电泳进行鉴定,出现完整的3条带,分别是5 S、18 S以及28 S,条带清晰可见,没有出现明显的降解,符合反转录的基本要求,并且A260/A280值均为1.9,符合试验对于纯度的需求,可以满足荧光定量PCR的要求。

图1 肝细胞总RNA电泳图谱图
2.2 目的基因的PCR结果 通过PCR对目的基因进行确定,结果如图2、3、4所示。β-actin PCR扩增结果在101 bp,HP基因PCR扩增结果在165 bp,SAA基因PCR扩增结果在127 bp。
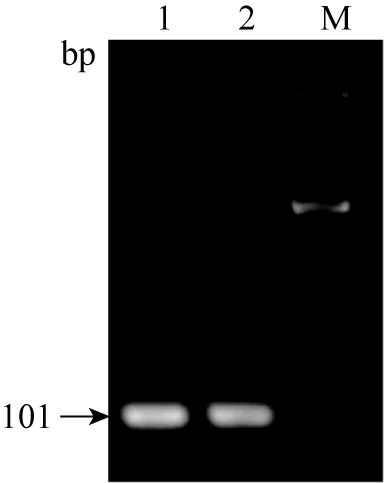
图2 内参β-actin PCR扩增结果
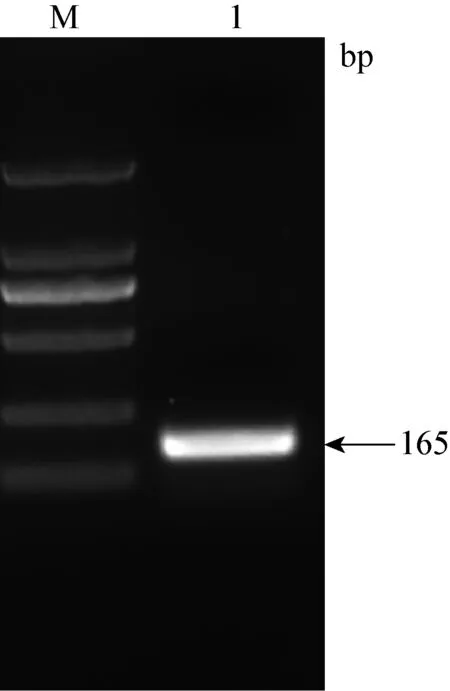
图3 HP基因PCR扩增结果
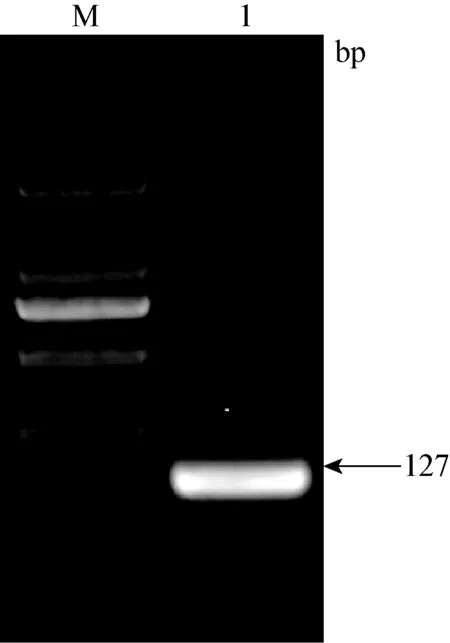
图4 SAA基因PCR扩增结果
2.3 犊牛肝细胞不同时间的形态学 见中插彩版图5~8。
2.4 不同浓度梯度的NEFA对体外培养牛肝细胞中HP、SAA mRNA表达影响 由图9、图10以及表7统计分析可见:在刺激因子NEFA作用下,HP基因的相对表达倍数明显增高,其中中等浓度处理组与对照组差异极显著(P<0.01),中高浓度处理组与对照组差异显著(P<0.05),高浓度处理组与对照组差异不显著(P>0.05)。试验结果表明,中等浓度NEFA能促进肝细胞中HP的表达;在刺激因子NEFA作用下,中等浓度处理组可以促进进肝细胞中SAA基因的表达,其中0.6 mmol/L处理组与对照组差异显著(P<0.05),而1.2 mmol/L处理组与对照组差异极显著(P<0.01),说明中等程度的NEFA能促进犊牛肝细胞中SAA表达,高浓度刺激物对肝细胞中SAA的表达无明显的影响。

表7 NEFA对体外培养原代肝细胞HP、SAA mRNA相对表达量的影响
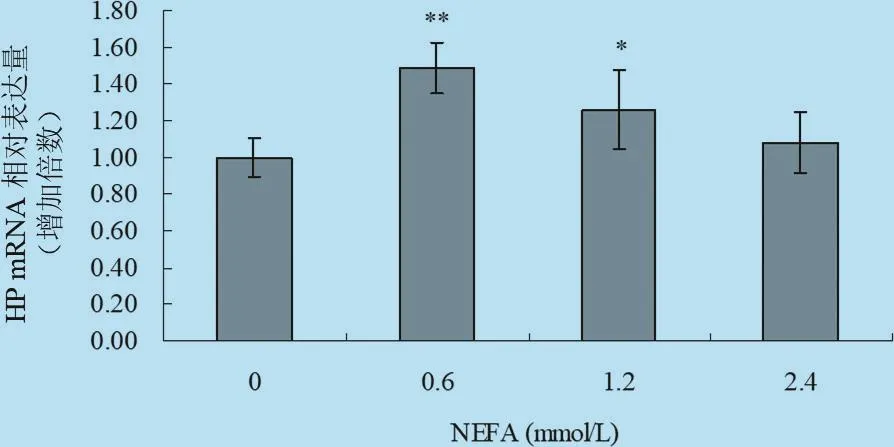
图9 NEFA对体外培养原代肝细胞HP mRNA转录水平的影响
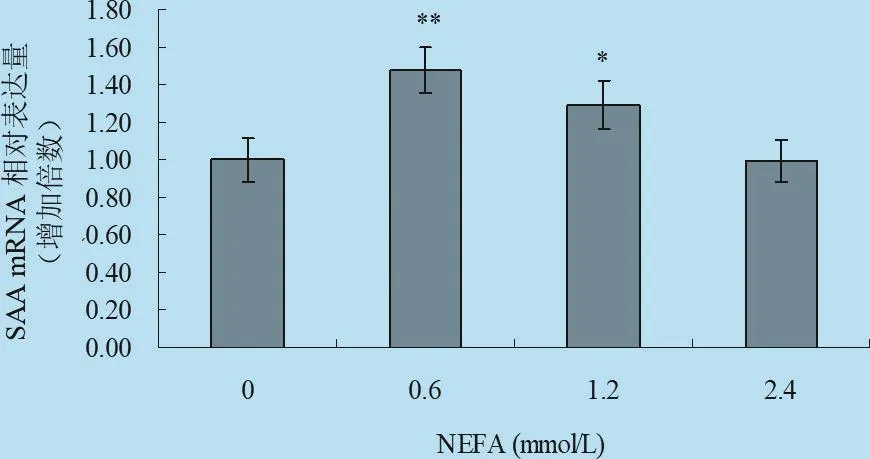
图10 NEFA对体外培养原代肝细胞SAA mRNA转录水平的影响
2.5 不同浓度梯度的BHBA对体外培养牛肝细胞中HP、SAA mRNA表达影响 由以图11、图12以及表8所示:在刺激因子BHBA作用下,HP基因表达出现了一定程度的减少,其中中等浓度处理组表现出抑制作用,且中等程度处理组与对照组均表现差异显著(P<0.05),而2.4 mmol/L的BHBA处理组与对照组比较无明显差异(P>0.05),说明中等浓度的BHBA对HP基因的表达具有抑制作用,高浓度的BHBA对HP基因的表达影响较小;BHBA作为刺激因子对SAA基因的表达影响较小,只是在0.6 mmol/L的BHBA处理组与对照组差异显著(P<0.05),但总体趋势为抑制作用。
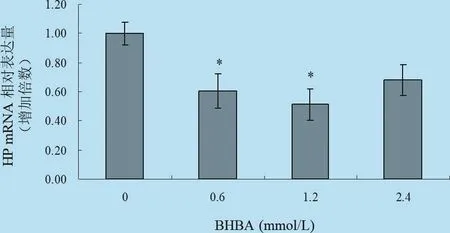
图11 BHBA对体外培养肝细胞HP mRNA转录水平的影

图12 BHBA对体外培养肝细胞SAA mRNA转录水平的影响

表8 BHBA对体外培养原代肝细胞HP、SAA mRNA相对表达量的影响
3 讨论与分析
NEFA是调控机体脂肪、蛋白质、糖类等物质代谢过程的重要影响因素,也是奶牛能量负平衡(NEB)的主要标志[5],生理状态下,奶牛在生产时NEFA浓度一般可以达到1 mmol/L[6],酮病发生时,由于NEB引起脂肪动员,NEFA水平升高,过多的NEFA在肝脏内代谢对机体较大的刺激,但对于急性期蛋白HP、SAA在肝脏中表达是否会产生影响未见报道。
HP、SAA是奶牛在炎症、应激以及感染过程中产生的急性期反应蛋白,HP主要由肝脏合成,后期研究发现,在脑、脾、食道、肠、肾等器官中也有所表达[7],而且不同部位表达量有所不同,在炎症刺激下,HP mRNA表达量在大鼠肺、肝、肾以及脾内均有不同程度增加,然而在相同炎症刺激下,HP mRNA表达量在大鼠睾丸内却下降了4倍[8],研究发现,HP在奶牛乳房炎发生时表达增加明显,可以作为奶牛乳房炎的判定指标和预后判断依据[9];SAA既可以在脂肪组织中合成,也可以在肝脏中合成,在肝脏中合成更具优势[10],对于SAA这种急性期反应蛋白目前研究较多的是关于它对奶牛乳房炎的研究以及其对肥胖以及糖尿病的研究。
在本次试验中,经刺激因子NEFA在0.6 mmol/L以及1.2 mmol/L时对体外培养犊牛肝细胞HP基因的表达具有促进作用,其中中低浓度处理组与对照组差异极显著,促进作用更为明显,而高浓度处理组对HP基因几乎不产生影响,可能是高浓度对HP具有一定的抑制作用,需进一步验证;对于SAA基因的作用与HP基因的作用相当,中等程度对SAA基因的表达具有促进作用,其中中低浓度0.6 mmol/L处理组促进作用更为突出,说明在NEFA添加物的作用下,急性期反应蛋白HP、SAA的表达具有上升趋势。
