猪流行性腹泻传染性胃肠炎双重RT-PCR检测方法的建立及优化
2018-02-18赵光伟涂少宇赖靖尧谭阳春郭道兵牛晨霞杨晓伟
赵光伟,涂少宇,汪 洋,贺 然,赖靖尧,谭阳春,郭道兵,牛晨霞,杨晓伟
(西南大学动物科学学院,重庆 荣昌 402460)
猪传染性胃肠炎(TGE)与猪流行性腹泻(PED)都是一种由冠状病毒引起的一种急性胃肠道传染病,临床上以突然发病、传播迅速、呕吐、水样腹泻、脱水和2周龄以内仔猪高病死率为特征[1]。本病可发生于各种年龄段的猪,但对仔猪的影响最为严重。10日龄以内的仔猪病死率高达100%,5周龄以上的猪感染后病死率较低,成年猪感染后几乎没有死亡,但严重影响增重和降低饲料报酬,由此造成了药物和人力增加等重大损失,是危害猪场最严重的疾病之一[2-3]。二者均为高度接触性肠道疾病,分别由猪传染性胃肠炎病毒和猪流行性腹泻病毒引起。由于TGEV和PEDV有相似的临床表现及传染途径,其鉴别诊断通常需借助实验室诊断技术,如病毒分离、免疫荧光试验、PCR技术等[4]。传统的诊断技术如病毒分离、免疫荧光试验等费时费力,不适于临床快速诊断,也不适于大规模的流行病学调查;而PCR技术具有特异性强、敏感度高、可进行活体诊断等特点,在实验室诊断中具有较突出的优势[5]。因此本研究通过对猪流行性腹泻和传染性胃肠炎的双重RT-PCR检测的建立和优化为这两种病毒的检测提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 毒株 猪流行性腹泻病毒、传染性胃肠炎病毒、猪瘟病毒、猪圆环病毒2型、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒,均于西南大学荣昌校区动物疾病快速诊断中心保存。
1.1.2 主要试剂 Total RNA提取试剂、RT-PCR试剂盒、Permix TaqDNA聚合酶、DL-2 000 DNA Marker,均购自宝生物工程(大连)有限公司。
1.1.3 引物 根据猪流行性腹泻和传染性胃肠炎的基因序列,应用Primer5.0分别设计了2对引物,序列见表1,引物由上海生工生物工程技术服务有限公司合成。

表1 引物序列
1.2 方法
1.2.1 病毒RNA提取 分别从实验室保存的流行性腹泻、传染性腹泻毒株样本中提取RNA,具体操作参见RNA试剂盒(TaKaRa)说明书方法。
1.2.2 双重RT-PCR方法的建立
1.2.2.1 RT反应 取PEDV和TGEV样本各3 μL,反转录酶混合液(PrimeScript RT Master Mix)2 μL,无RNA酶的超纯水(RNase Free dH2O)补足至10 μL。混匀后以37℃ 15 min,85℃ 5 s,4℃保存为反应程序进行反转录,得到病毒 cDNA,置于-20℃保存备用。
1.2.2.2 双重RT-PCR反应最佳退火温度 取PEDV、TGEVcDNA 各 3 μL 为模版,Permix Taq TaqDNA 聚合酶 25 μL,上、下游引物各 1 μL,最后用ddH2O补足至50 μL。退火温度在51.8℃ ~57.8 ℃ 区间设置 51.8、52.2、52.9、54.1、55.5、56.6、57.3、57.8℃八个温度梯度进行反应。
1.2.2.3 双重RT-PCR反应引物浓度稀释 将设计的PEDV和TGEV引物用紫外分光光度计进行OD260nm/OD280nm值测定,将引物作10倍稀释,并分别测定稀释后的浓度,各取1 μl加入到多重PCR最佳退火温度反应体系进行反应。
1.2.2.4 双重RT-PCR反应灵敏性检测 将提取的PEDV和TGEV的反转录产物用紫外分光光度计进行OD260nm/OD280nm值测定,将模版作10倍系列稀释,并分别测定稀释后的含量,并各取1 μL加入到最佳反应程序,进行灵敏性检测。
1.2.2.5 双重RT-PCR反应特异性检测 分别取CSFV、PCV2、PRRSV和 PRV的 DNA或 RNA按照相同条件代替PDEV和TGEV的cDNA模板进行RT-PCR扩增,以检测其特异性。
2 结果与分析
2.1 双重RT-PCR反应退火温度优化 以PEDV和TGEV基因组cDNA为模板进行PCR扩增,通过电泳、测序分别得到462 bp和590 bp的cDNA序列,见图1。
通过优化确定最佳反应体系(50 μL)为:25 μL 5X PeimeScript RT Master Mix酶,上、下游引物各1 μL,cDNA 模版 6 μL,ddH2O 补足至 50 μL。 对RT-PCR反应温度、时间和循环次数等进行优化,最后确定PEDV和TGEV的最佳反应条件:94℃预变性5 min、94 ℃变性50 s、52.9 ℃退火 1 min、72 ℃延伸1 min、循环 35次、72℃终末 10 min、15℃保存。
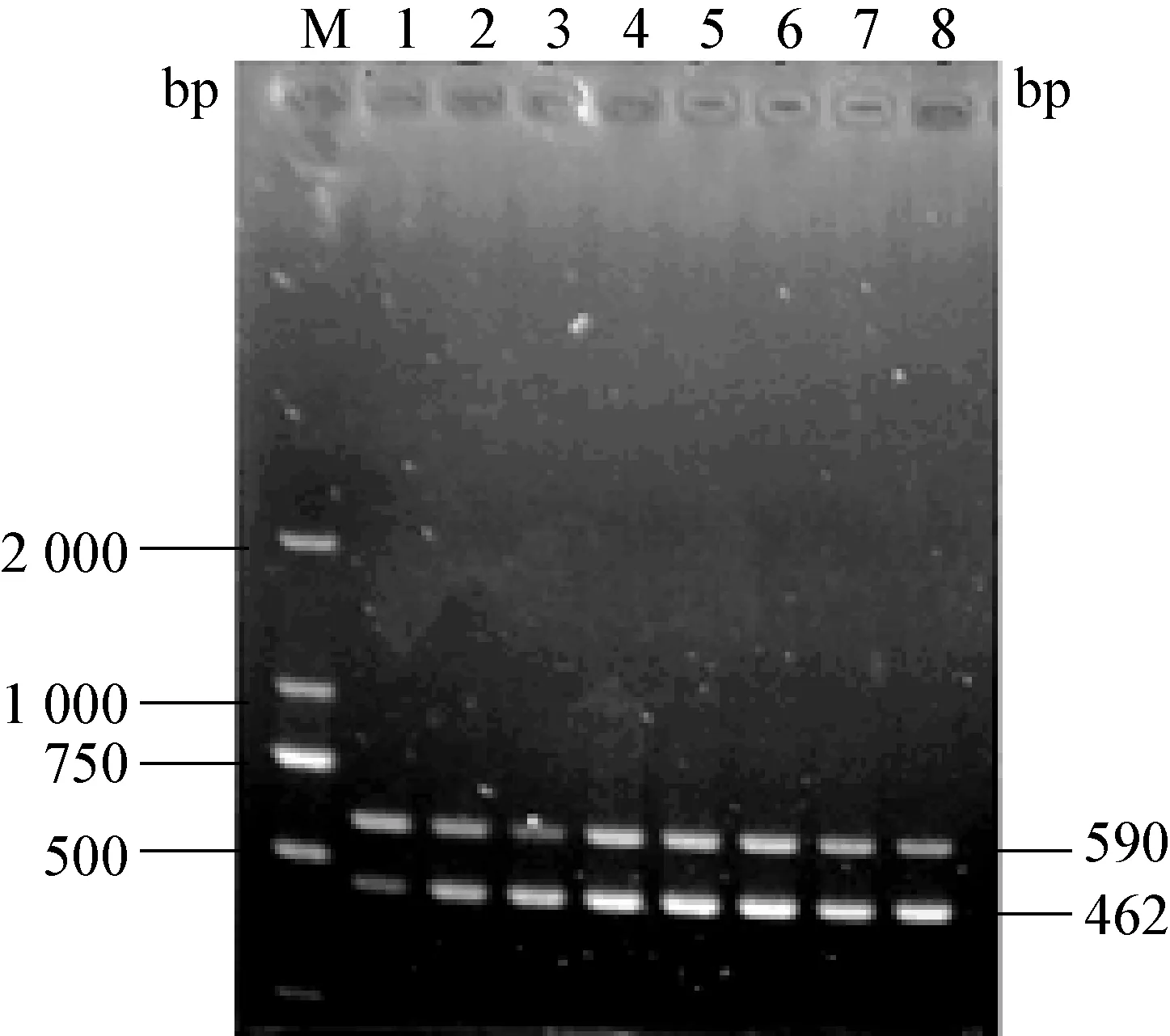
图1 PEDV和TGEV双重RT-PCR反应退火温度优化
2.2 双重RT-PCR引物浓度稀释 将PEDV和TGEV引物由原浓度10 μmol/L稀释为1 μmol/L,5×10-1μmol/L,2.5 ×10-1μmol/L,1.25 ×10-1μmol/L,1×10-1μmol/L,1×10-2μmol/L,用双重PCR最佳反应条件进行 PCR扩增,电泳,结果见图2。
通过图像对比可看出,引物浓度为5×10-1μmol/L时,条带最亮,其为最适引物浓度。

图2 PEDV和TGEV双重RT-PCR引物浓度稀释
2.3 双重RT-PCR灵敏性检测 将cDNA浓度由原浓度93.3×101ng/μL以10倍梯度稀释为93.3×100ng/μL,93.3 × 10-1ng/μL,93.3 × 10-2ng/μL,93.3×10-3ng/μL。用双重PCR最佳反应条件进行PCR扩增,跑电泳,结果见图3。
通过图像对比可以看出,cDNA浓度为93.3×101ng/μL时,条带最亮,故其为最适cDNA浓度。
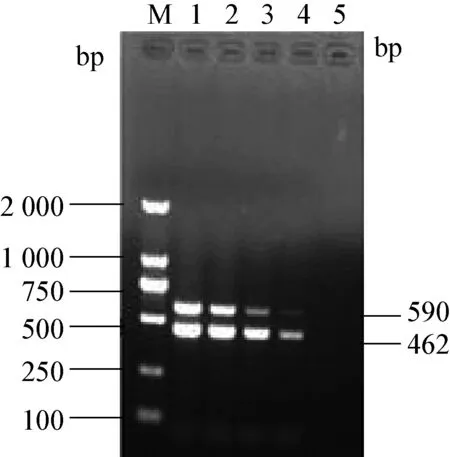
图3 PDEV和TGEV双重RT-PCR的敏感性
2.4 双重RT-PCR的特异性 用建立的双重RTPCR方法检测猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)均未出现条带,显示阴性,可见其特异性好。结果见图4.
3 讨论

图4 双重RT-PCR特异性检测
2010年以来,中国大陆大部分地区的猪场出现了仔猪腹泻的疫情,与此同时韩国、日本、越南等亚洲国家及区域也发生腹泻疫情,导致大量出生仔猪死亡。2013年4月以后,美国、加拿大、墨西哥等美洲国家,甚至有欧洲国家均有猪腹泻疫情的报道,猪腹泻病给养猪业造成巨大经济损失,其发病范围的扩大,再度引起了科研工作者们对引发腹泻病相关病毒的研究热情[6]。TGEV和PDEV这两种病毒性腹泻病是仔猪的常见疾病,发病率高,目前均无有效的药物去预防和治疗,且两者在临床症状、病理变化和流行病学上无明显差异[7].传统的检测方法,如细胞培养、免疫学和动物试验等虽能对两者鉴别诊断,但它们最大的缺点是检测灵敏度低、周期长[8]。RT-PCR技术是目前鉴别诊断TGEV和PEDV两种病毒的特异性更强、敏感度更高的方法[9]。相对于传统PCR检测单一病原体,双重RTPCR能同时进行多种病原微生物的鉴定,且具有灵敏、快捷等优点,适于大规模检测,在动物疫病的流行病学调查和预防中,具有不可替代的作用。近年来,随着分子生物学技术的发展,某些新的检测方法,如多重RT-PCR、实时荧光定量RT-PCR、恒温隔热RTPCR等也逐渐应用于动物病原的检测[10],在临床应用中,也越来越多的运用多重PCR技术解决疾病的诊断问题,用以提高检测的效率。多重PCR技术能在同一个体系中实现对多个目的基因的特异性扩增,相比普通单重PCR检测效率更高、且节约试剂和人工成本,而较之荧光定量PCR、恒温隔热RT-PCR技术,其灵敏度略低,但对仪器设备的要求、各项试剂耗材等成本也较低[11]。因此,双重RT-PCR方法的建立对PEDV和TGEV的快速诊断有重要意义。
本试验根据实验室保存的PEDV和TGEV毒株设计特异性引物,建立了PEDV和TGEV双重RT-PCR快速检测方法。双重RT-PCR检测灵敏性显示,该方法最低,cDNA模板检出浓度为93.3×10-1ng/μL,表明本试验建立的双重RT-PCR检测方法准确性高,具有较高的检测灵敏性。同时,该双重RT-PCR特异性结果显示,该方法仅能检测到PEDV和TGEV,不能检测到PRRSV、CSFV和PRV等,对PEDV和TGEV的快速诊断和疫病防控具有重要意义。
