重组 P128蛋白的表达 纯化及其对抗牛源葡萄球菌活性研究
2018-02-18肖真真汤明元张鑫宇夏晓莉孙怀昌
肖真真,汤明元,张鑫宇,夏晓莉,孙怀昌
(扬州大学兽医学院 江苏省重要动物疫病与人兽共患病协同创新中心,江苏 扬州 225009)
葡萄球菌是奶牛乳房炎重要病原菌,其中金黄色葡萄球菌也是人兽共患病原菌。凝固酶阴性葡萄球菌多达20多种,已取代金黄色葡萄球菌成为奶牛隐性乳房炎主要病原菌[1]。葡萄球菌几乎能对所有抗生素产生耐药性,特别是耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)广泛流行引起了广泛关注[2],迫切需要研制防治葡萄球菌新药。
P128蛋白是由蛋白葡萄球菌噬菌体K细胞壁降解酶活性区与溶葡萄球菌素细胞壁结合区组成的嵌合蛋白,对MRSA等葡萄球菌具有很强溶(杀)活性[3]。国外用大肠杆菌成功表达了重组P128蛋白,但需两步硫酸铵沉淀和离子交换层析纯化[4]。本课题组曾以类弹性蛋白多肽(Elastin-like polypeptide,ELP)为纯化标签,用脑膜炎奈瑟氏菌FrpC蛋白自加工元件(Self-processing module,SPM)切割ELP标签,获得了重组P128[5]蛋白,但切割效率较低,临床应用受到限制。
烟草蚀纹病毒蛋白酶(Tobacco etch virus protease,TEVp)具有识别序列特异性强、切割活性高、影响因素少等优点,广泛用于重组蛋白标签切除[6]。本课题组将TEVp与自聚肽ELK16进行融合表达,表达的活性包涵体可用离心法纯化,并可用离心法与酶切产物分离[7]。本研究以ELP为纯化标签,用TEVp活性包涵体切割ELP标签,用获得的重组P128蛋白对牛源葡萄球菌进行溶(杀)菌试验,旨在为P128蛋白临床应用提供科学依据。
1 材料与方法
1.1 主要试剂 原核表达载体pP128-SPMELP[6]、pP16P-TEVp[8]和pELP-Fh8由本室构建;质粒DNA小量提取试剂盒、PCR产物纯化试剂盒及DNA凝胶回收试剂盒,购自AXYGEN公司;限制性内切酶、PrimeSTAR Max DNA Polymerase、pMD19-T Simple载体和T4 DNA连接酶,购自TaKaRa(大连)公司;DH5α和BLR(DE3)大肠埃希菌从美国Invitrogen公司引进;ELK16自聚肽融合TEVp活性包涵体由本室制备[7];奶牛乳房炎相关葡萄球菌本室保存。
1.2 PCR扩增 根据P128蛋白编码序列[4]设计1对PCR引物,正向引物引入SalI酶切位点和TEVp识别位点,序 列 为 5′-GCGTCGACA GAAAACCTGTACTTCCAGGGTGGTGCTCAGGACGGTGGT-3 ′;反向引物引入XhoI酶切位点,序列为5′-GCCTCGAGTTATTTGATGGTACCCCAC-3′。PCR扩增按照PrimeStar Max说明书进行,模板DNA为100 ng的pP128-SPM-ELP质粒,正、反向引物各20 pmol/L,总体积50 μL。反应条件为:94℃/5 min;94℃/30 s,58℃/40 s,72℃/40 s,35次循环。将PCR产物克隆入pMD19-T Simple载体,用测序法进行鉴定。
1.3 表达载体构建 用限制酶 SalI和XhoI将P128蛋白编码序列从pMD19-T Simple载体切下,与同酶线性化pELP-Fh8载体连接,转化感受态DH5α大肠埃希菌,在卡那霉素(50 μg/mL)琼脂平板培养过夜。挑取单菌落接种卡那霉素LB,培养后提取质粒DNA,用SalI和XhoI双酶切鉴定,重组载体命名为pELP-Fh8-P128。
1.4 融合蛋白表达 将pELP-Fh8-P128载体转化BLR(DE3)大肠埃希菌,挑取单菌落接种卡那霉素LB培养基,37℃培养过夜;按1∶100接种卡那霉素2×YT培养基,37℃培养至OD600nm值=0.8,加入终浓度为0.1 mmol/LIPTG,37℃诱导表达6 h;4 000 r/min(4℃)离心10 min,沉淀菌体用PBS重悬,用超声波破碎(25 W,裂解10 s,间歇20 s,共3 min);12 000 r/min(4℃)离心10 min,分别收集离心上清和沉淀,用12%SDS-PAGE分析融合蛋白表达及其可溶性。必要时对IPTG浓度和诱导时间进行优化。
1.5 融合蛋白纯化 先用PBS将菌体裂解液蛋白浓度稀释至10 mg/mL,各取200 μL,分别加入0.5、1.0、1.5、2.0、2.5 mol/L 和3.0 mol/L 氯化钠,26 ℃孵育10 min;室温、12 000 r/min离心5 min,沉淀蛋白用预冷PBS(pH值7.4)重悬,各取10 μL进行12%SDS-PAGE分析。然后取稀释菌体裂解液各200 μL,加入优化浓度氯化钠,分别在18℃、20℃、22℃、24℃、26℃孵育10 min;室温、12 000 r/min离心5 min,沉淀蛋白用PBS重悬,各取10 μL进行SDS-PAGE分析。最后用优化相变循环条件进行ELP-Fh8-P128融合蛋白纯化。
1.6 标签切除与P128蛋白回收 按照文献[8]用ELK16-TEVp活性包涵体切割ELP-Fh8-P128融合蛋白,ELK16-TEVp浓度为60 μg/mL,ELP-Fh8-P128融合蛋白浓度为200 μg/mL,反应体系为100 μL,30℃孵育过夜;反应结束后,12 000 r/min(4℃)离心10 min,去除 ELK16-TEVp活性包涵体,收集离心上清,用优化相变循环条件去除ELPFh8标签。
1.7 蛋白分析 在融合蛋白纯化、标签切除和P128蛋白回收各步骤,各取10 μL蛋白样品进行12%SDS-PAGE分离,考马斯蓝染色后,用 Gel-DocXR+凝胶成像分析系统(美国BIO-RAD公司)进行蛋白条带灰度扫描,以已知浓度蛋白Marker为参考,计算目的蛋白浓度、纯度和产量。
1.8 最小抑(杀)菌浓度测定 参考文献[5]分别测定P128蛋白对42株致奶牛乳房炎葡萄球菌最小抑菌浓度(MIC)和最小杀菌浓度(MBC),其中金黄色葡萄球菌10株(头孢西丁耐药3株),7种凝固酶阴性葡萄球菌32株(头孢西丁耐药4株)。
2 结果
2.1 P128蛋白编码序列扩增 以pP128-SPMELP载体为模板,经过35次循环PCR扩增后进行琼脂糖凝胶电泳分析,结果显示,扩增产物为预期的770 bp。将PCR产物克隆入pMD19-Simple载体,序列测定结果显示与原序列相比无突变。
2.2 表达载体构建 用限制酶SalI和XhoI将P128蛋白编码序列从pMD19-Simple载体上切下,插入pELP-Fh8载体,获得重组载体pELP-Fh8-P128,酶切鉴定结果显示能切出770 bp插入片段。
2.3 融合蛋白表达 先将pELP-Fh8-P128重组菌在37℃、0.2 mmol/L IPTG诱导表达6 h,SDSPAGE分析结果显示,IPTG诱导重组菌出现预期的79 kDa额外蛋白条带,表达产物存在于裂解菌体离心上清(图 1)。 分别用 0.05、0.1、0.2、0.4、06、1.0 mmol/L IPTG诱导重组菌表达,SDS-PAGE分析结果显示,0.1 mmol/L IPTG足以诱导ELPFh8-P128融合蛋白表达。最后将pELP-Fh8-P128重组菌在37℃、0.1 mmol/L IPTG诱导表达2、4、6、8、10 h,SDS-PAGE 分析结果显示诱导 6 h融合蛋白表达量最高。

图1 ELP-Fh8-P128融合蛋白表达的SDS-PAGE分析
2.4 融合蛋白纯化 沉淀ELP-Fh8-P128融合蛋白的最佳氯化钠浓度为2.0 mol/L,最佳温度为24℃。在优化条件下进行融合蛋白纯化,SDSPAGE分析结果显示。初次相变循环纯化融合蛋白纯度为78%,再次相变循环纯化融合蛋白纯度为90%,产量为400 mg/L细菌培养(图2)。
2.5 标签切除与P128蛋白回收 在优化条件下用ELK16-TEVp活性包涵体切割ELP-Fh8-P128融合蛋白,反应结束后离心去除ELK16-TEVp活性包涵体,再用相变循环沉淀 ELP-Fh8标签,SDS-PAGE分析结果显示,回收获得的重组P128蛋白纯度为98%(图3)。
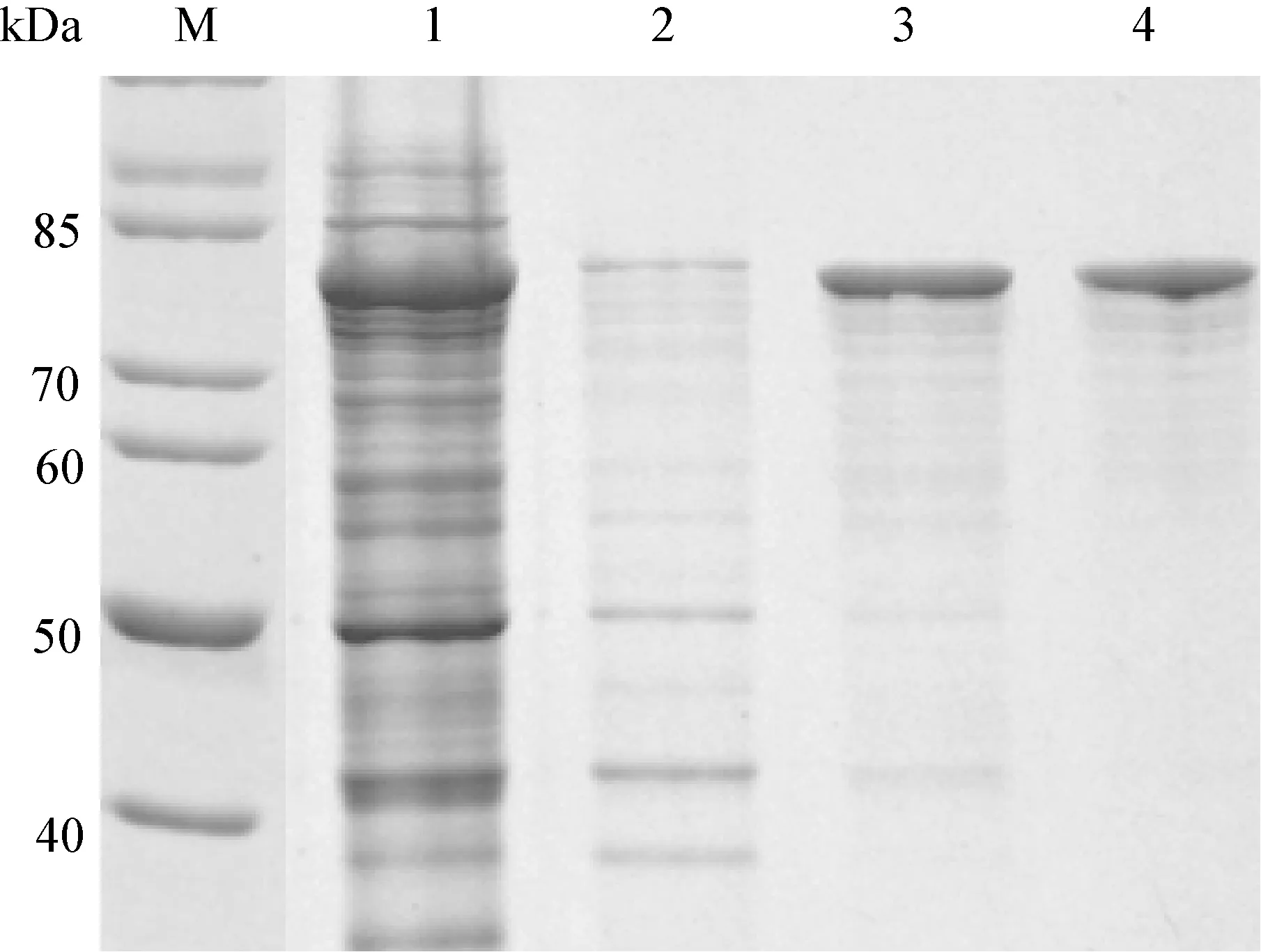
图2 ELP-Fh8-P128融合蛋白纯化的SDS-PAGE分析

图3 重组P128蛋白纯化的SDS-PAGE分析
2.6 重组P128蛋白抑菌活性特异性检测 取金黄色葡萄球菌和沙门菌各3株进行MIC测定,结果显示P128蛋白对金黄色葡萄球菌的MIC为0.47 μg/mL,对沙门菌无抑菌作用。
2.7 重组P128蛋白对金黄色葡萄球菌的MIC和MBC测定 选择3株头孢西丁耐药和8株头孢西丁敏感金黄色葡萄球菌进行MIC和MBC测定,结果显示,除对1株头孢西丁耐药金黄色葡萄球菌无抗菌活性外,重组P128蛋白对其余金黄色葡萄球菌MIC在 0.23~1.88 μg/mL之间,MBC在0.94~15 μg/mL之间,对头孢西丁耐药和敏感金黄葡萄球菌抗菌活性无明显差异(表1)。
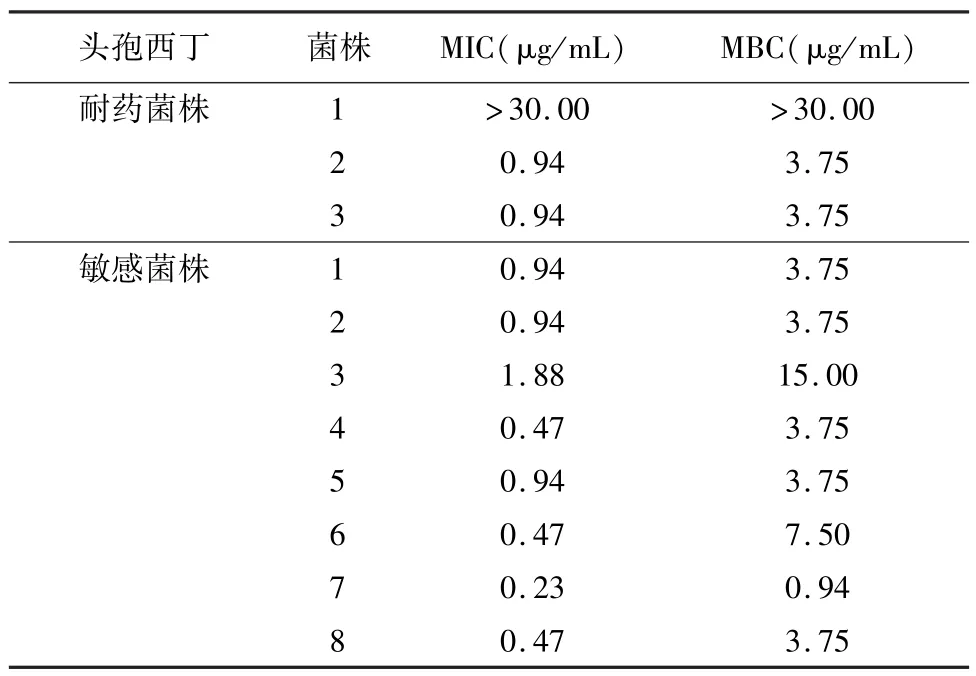
表1 重组P128蛋白对金黄色葡萄球菌的MIC和MBC测定
2.8 重组P128蛋白对凝固酶阴性葡萄球菌MIC和MBC测定 分别取7种25株凝固酶阴性葡萄球菌进行MIC和MBC测定,结果显示:重组P128蛋白除对1株头孢西丁耐药沃氏葡萄球菌无抗菌活性,对其余凝固酶阴性葡萄球菌的MIC在0.12~1.88 μg/mL之间,MBC在0.94~15 μg/mL之间(表2)。

表2 重组P128蛋白对凝固酶阴性葡萄球菌的MIC和MBC测定
3 讨论
本研究将P128蛋白与ELP、Fh8进行融合表达,其中ELP具有温度敏感的可逆相变特性,在低于相变温度溶液中呈可溶状态,在高于相变温度时呈凝聚状态,因此ELP融合蛋白可用温控离心法纯化[8]。肝片吸虫钙结合蛋白Fh8为促溶标签[9],用以增强ELP融合蛋白的可溶性,因为其纯化前提必须是可溶性蛋白。SDS-PAGE分析结果显示,37℃表达的ELP-Fh8-P128为可溶性蛋白,可能与P128蛋白自身可溶性以及Fh8促溶标签有关。在优化条件下进行两次相变循环,获得的ELP-Fh8-P128融合蛋白纯度高达98%,进一步证明ELP是非常有效的非亲和纯化标签。
本课题组曾用ELP/SPM表达与纯化系统获得了重组P128蛋白,但后继试验发现SPM自裂解重复性较差、重组P128蛋白回收率较低。TEVp不仅切割活性高、影响因素少,而且可与ELK16自聚肽融合以活性包涵体表达[6]。本研究利用TEVp活性包涵体切割ELP-Fh8-P128融合蛋白,结果显示,切割效率接近100%,进一步证明TEVp活性包涵体具有很强的酶切活性。
研究资料显示,重组P128蛋白对人源金黄色葡萄球菌具有很强的溶(杀)菌作用,包括耐甲氧西林金黄色葡萄球菌[3],但对动物源葡萄球菌的溶(杀)菌作用尚无研究报道。耐甲氧西林金黄色葡萄球菌是多重耐药葡萄球菌的代表[2],可用甲氧西林或头孢西丁测定。为了探索用P128蛋白治疗葡萄球菌性奶牛乳房炎可行性,本研究在测得葡萄球菌甲氧西林敏感性基础上,分别测试了重组P128蛋白对甲氧西林敏感或耐药葡萄球菌的MIC和MBC,结果显示,尽管个别甲氧西林耐药菌株对P128蛋白不敏感,但多数菌株对P128蛋白非常敏感,在甲氧西林耐药与敏感菌株之间以及金黄色葡萄球菌与凝固酶阴性葡萄球菌之间无明显差异。这些研究结果提示,重组P128蛋白不仅可用于各种葡萄球菌性奶牛乳房炎治疗,还可用于多重耐药葡萄球菌性奶牛乳房炎治疗,具有良好的应用前景。
