超声波-离子液体辅助麦谷蛋白酶解工艺的优化及产物抗氧化活性研究
2018-02-15张雪纷吴琼英贾俊强
张雪纷,吴琼英,2*,贾俊强,匡 聪
(1.江苏科技大学 生物技术学院, 镇江 212018) (2.中国农业科学院 蚕业研究所, 镇江 212018) (3.江苏科技大学 粮食学院,镇江 212004)
酶解法是提高蛋白功能特性的重要途径之一,也是获得生物活性肽的主要方式.研究表明,酶解前的预处理能改善蛋白酶解的效果[1-2],文献[3]通过微射流均质预处理大豆蛋白,发现大豆分离蛋白的酶解效率及酶解产物乳化性能均得到了提高.近年来,由于超声处理具有操作简单、成本低和安全高效等优点,已被用于酶解反应中,如文献[4]采用超声预处理玉米蛋白提高了酶解效率和酶解产物抑制血管紧张素转化酶(angiotensin converting enzyme,ACE)的活性.离子液体具有良好的溶解性、不挥发性、热稳定性和可重复利用性,对蛋白作用后,会使蛋白分子发生再生或伸展,可暴露出更多的蛋白活性基团[5].利用超声协同离子液体处理以促进大分子物质酶解的技术已被应用,如可促进稻草中纤维素的酶解[6]和虫草素酶解[7],而在蛋白质酶解中应用较少.课题组前期研究发现,超声-离子液体处理技术可提高蚕蛹蛋白酶解产物的ACE抑制活性,同时酶解产物中低分子量肽含量也明显增多[8].本研究以麦谷蛋白为原料,研究超声-离子液体处理对麦谷蛋白水解度及酶解产物抗氧化活性的影响,为超声-离子液体处理技术在蛋白酶解中的应用提供实验数据和理论基础.
1 试验
1.1 材料与试剂
小麦谷朊粉购于徐州奥凯小麦淀粉有限公司;[BMIM]PF6购于上海御略化工有限公司;碱性蛋白酶向诺维信(中国)生物技术有限公司提供;菲洛嗪购于Alfa Aesar公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)购于Sigma-Aldrich 公司;其余试剂均为化学分析纯.
1.2 仪器与设备
DF-101S集热式磁力加热搅拌器,金坛市白塔新宝仪器厂;CP153分析天平,奥豪斯仪器(常州)有限公司;FDU-2100冷冻干燥机,日本东京理化器械;H-1600RW微型高速台式冷冻离心机,上海利鑫坚离心机有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;UV-9600紫外可见分光光度计,北京瑞利分析仪器公司;HH·S21-6-S型电热恒温水浴锅,上海精其仪器有限公司;Q700智能型超声波破碎仪,美国Qsonica公司.
1.3 试验方法
1.3.1 麦谷蛋白的制备
将谷朊粉加入到去离子水中配成100 g/L悬浮液,搅拌均匀后用1 mol/L NaOH调节溶液pH至12.0,静置提取1 h,5 000 r/min离心20 min取上清液,上清液中加入无水乙醇使其体积分数达到65%,混匀后用1 mol/L HCl将pH调至7.0,静置沉淀24 h后,5 000 r/min离心,收集沉淀,冷冻干燥得到麦谷蛋白[9].
1.3.2 水解度(degree of hydrolysis,DH)的测定
采用pH-stat 法[10]测定水解度(DH),计算公式如下:
式中:c为NaOH浓度,mol/L;V为消耗NaOH的体积,mL;α为氨基的解离度;Mp为底物蛋白的质量,g;htot为底物蛋白的肽键总数8.38 mmol/g.
1.3.3 超声-离子液体辅助麦谷蛋白酶解的工艺优化
(1) 超声-离子液体预处理麦谷蛋白的方法
将麦谷蛋白用去离子水配制成悬浮液,然后加入适当体积的离子液体([BMIM]PF6),进行超声处理,在5 000 r/min下离心10 min,溶液体系分为3层(上层为水相,中间层为蛋白,下层为离子液体),除掉水相,回收下层离子液体,麦谷蛋白层用去离子水反复洗涤、离心,以除去残留离子液体,蛋白冷冻干燥后用于酶解试验.
(2) 麦谷蛋白的酶解
以未处理麦谷蛋白为对照,研究超声-离子液体预处理后麦谷蛋白水解度变化,酶解条件为:底物浓度20 g/L,酶解温度55 ℃,酶解pH 8.0,酶解时间30 min,蛋白酶为alcalase,加酶量3 000 U/g.
(3) 超声-离子液体预处理麦谷蛋白的单因素影响试验
对超声功率,超声时间,水/离子液体体积比,料液质量浓度进行单因素试验,考察各因素对预处理后麦谷蛋白水解度的影响。以水与离子液体混合液为超声能传播介质,在水/离子液体体积比1 ∶1、料液质量浓度20 g/L和超声时间6 min条件下,分别将超声功率设定为100、200、300、400和500 W;在水/离子液体体积比1 ∶1、料液质量浓度20 g/L和超声功率300 W条件下,分别将超声时间设定为3、6、9、12和15 min;在料液质量浓度20 g/L、超声功率300 W和超声时间6 min条件下,分别将水/离子液体体积比设定为0.5 ∶1、1.0 ∶1、1.5 ∶1、2.0 ∶1和2.5 ∶1;在超声功率300 W、超声时间6 min和水/离子液体体积比1 ∶1条件下,分别将料液质量浓度设定为10、20、30、40和50 g/L.
(4) 响应面优化试验设计
在单因素影响试验基础上,采用Design Expert 8.0.6统计软件进行试验设计.以水解度为响应值,采用4因素3水平响应面法优化预处理工艺,响应面因素水平设计如表1.

表1 响应面试验因素与水平
1.3.4 酶解产物抗氧化活性试验
按照响应面分析确定的最佳工艺条件预处理麦谷蛋白,然后利用alcalase进行酶解,酶解条件如上文所述.酶解产物经离心后冻干,进行抗氧化活性分析,并以未预处理的麦谷蛋白酶解产物作为对照,比较超声-离子液体预处理对麦谷蛋白酶解产物抗氧化活性的影响.
(1) 清除DPPH 自由基活性测定
将麦谷蛋白酶解产物配制成不同浓度(20、40、60、80、100 μg/mL),分别取2 mL麦谷蛋白酶解液和2 mL浓度为0.04 mg/mL的DPPH溶液混匀,在25℃静置30 min,在517 nm处测吸光值[11].按下式计算DPPH自由基清除率:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为DPPH和95%乙醇溶液混合后的吸光值,A1为DPPH和麦谷蛋白酶解液混合后的吸光值,A2为麦谷蛋白酶解液和95%乙醇溶液混合后的吸光值.
(2) Fe2+螯合能力测定
将麦谷蛋白酶解产物配制成不同浓度(10、20、30、40、50 μg/mL),分别取3 mL麦谷蛋白酶解液,依次加入0.05 mL 2 mmol/L FeCl2和0.1 mL 5 mmol/L菲洛嗪,混匀后在25℃反应10 min,在562 nm处测其吸光值[12].按下式计算Fe2+螯合率:
Fe2+螯合率(%)=[A0-(A1-A2)]/A0×100
式中:A0为空白组的吸光值,A1为样品组的吸光值,A2为去离子水代替FeCl2后的吸光值.
(3) 还原力测定
将麦谷蛋白酶解产物配制成不同浓度(20、40、60、80、100 μg/mL),分别取2 mL样品溶液,加入2 mL质量浓度为1%的铁氰化钾溶液,混匀后在50 ℃下反应20 min,加入2 mL质量浓度为10%三氯乙酸终止反应,5 000 r/min离心10 min后取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL质量浓度为0.1%三氯化铁溶液,混匀后静置10 min,在700 nm处测定吸光值,用吸光值大小表示还原力[13].
2 结果与分析
2.1 单因素影响试验结果与分析
(1) 超声功率对麦谷蛋白水解度的影响
麦谷蛋白水解度随超声功率的变化如图1.由图1可知,当超声波功率在100~300 W时,麦谷蛋白的水解度会随着超声功率的增加而显著增加,在超声功率300 W时达到最高值,之后逐渐降低.这可能是因为当超声功率在100~300 W时,随着超声功率的增加,麦谷蛋白的蛋白质分子发生了伸展,暴露出更多碱性蛋白酶的作用位点,从而促进了麦谷蛋白的水解[14],但当超声功率高于300 W时,超声波的瞬时高温高压、瞬态空化等作用[15]又使伸展的蛋白分子产生了卷曲和折叠,暴露的酶解位点变少,不利于碱性蛋白酶酶解.因此,本研究选择超声功率为300 W.
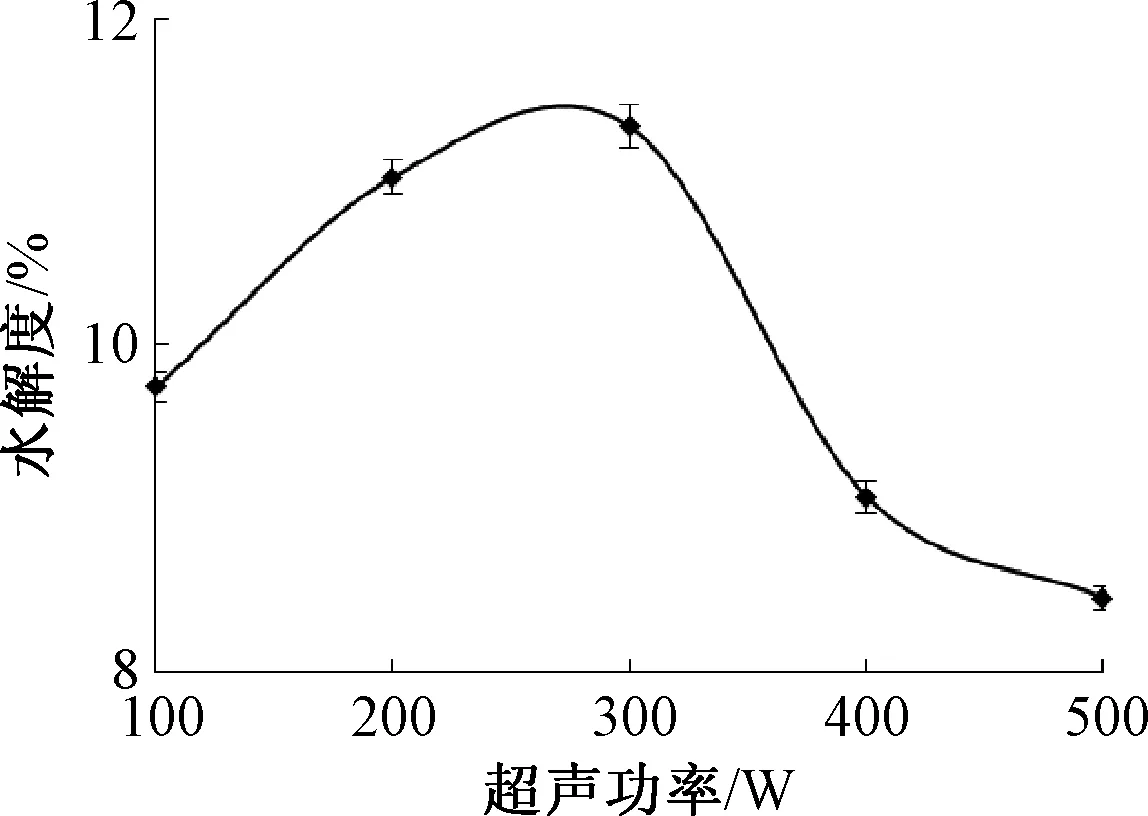
图1 超声功率对麦谷蛋白水解度的影响Fig.1 Effect of ultrasonic power on hydrolysis of glutenin
(2) 超声时间对麦谷蛋白水解度的影响
麦谷蛋白水解度随超声时间的变化如图2.由图2可以看出,当超声时间为6 min时,麦谷蛋白经碱性蛋白酶酶解的水解度最高,超声时间大于或小于6 min,麦谷蛋白的水解度会降低.这可能是因为在相同的条件下,超声处理时间过短,麦谷蛋白的蛋白质分子结构尚未完全伸展,而处理时间太长,又破坏了酶的作用位点.因此,合适的超声时间可促进蛋白质的水解.本研究选择超声时间为6 min.

图2 超声时间对麦谷蛋白水解度的影响Fig.2 Effect of ultrasonic time on hydrolysis of glutenin
(3) 水与离子液体的体积比值对麦谷蛋白水解度的影响
麦谷蛋白水解度随水与离子液体体积比值的变化如图3.蛋白质在离子液体中易产生再生现象,蛋白质分子发生伸展或卷曲,与超声有相似的处理效果[8].由图3可以看出,水/离子液体体积比在0.5 ∶1~1.0 ∶1时,随着水/离子液体比值的增加,麦谷蛋白水解度也相应提高,在水/离子液体比值为1.0 ∶1时,麦谷蛋白的水解度达到最大值;当水/离子液体比值进一步增大时,麦谷蛋白水解度却逐渐下降.这与离子液体具有较大的粘度有关,若其体积分数太大,会影响超声能量的传递,而低体积分数的离子液体又达不到改变蛋白质结构的目的.因此本研究选择水/离子液体比值为1.0 ∶1.
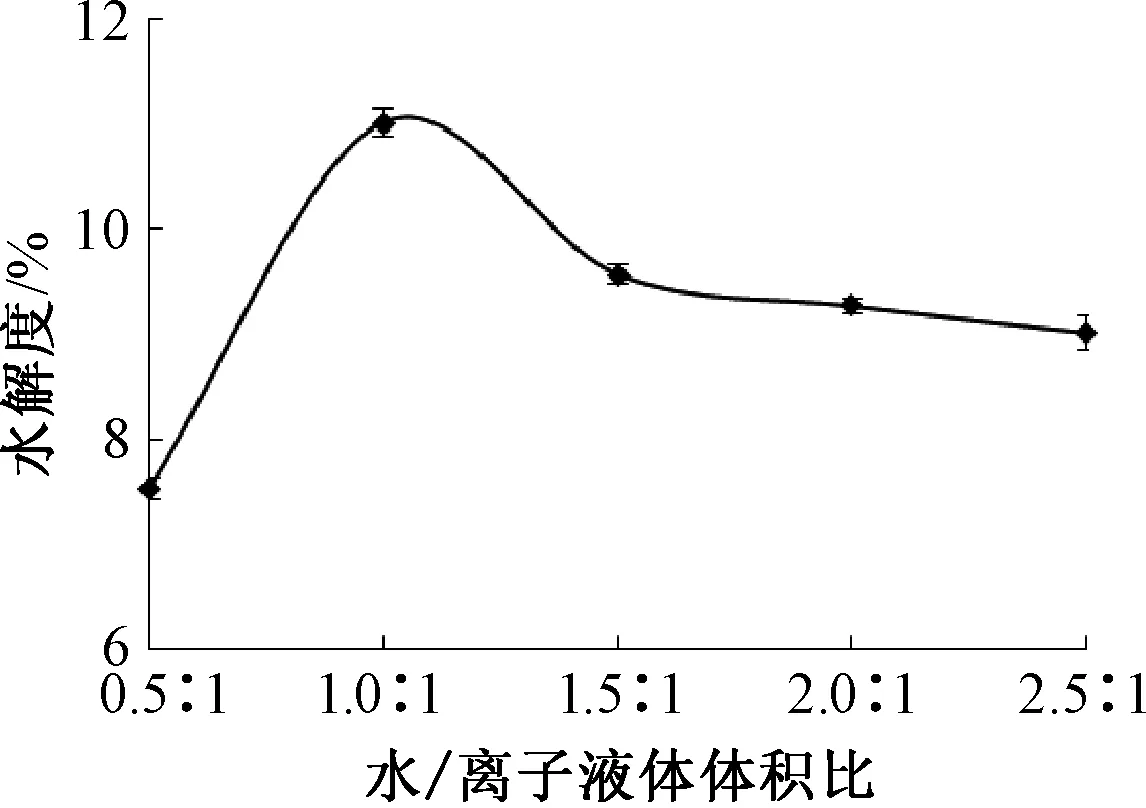
图3 水/离子液体体积比对麦谷蛋白水解度的影响Fig.3 Effect of ratio of water to ionic liquidon hydrolysis of glutenin
(4) 料液质量浓度对麦谷蛋白水解度的影响
麦谷蛋白水解度随料液质量浓度的变化如图4.由图4可知,麦谷蛋白水解度随着料液质量浓度的增大而增大,在料液质量浓度20 g/L时,麦谷蛋白水解度达到最大值;当料液质量浓度进一步增大时,麦谷蛋白水解度开始逐渐降低.在用超声处理料液时,低浓度的料液会导致超声产生太强的作用力,使蛋白分子经伸展后进一步折叠,不利于酶解,而当料液质量浓度太高时,则会因溶液体系粘度太大而不利于超声能量传递,弱化超声处理作用,因此,合适的料液质量浓度能够提高超声-离子液体的处理效果.本研究选择料液质量浓度为20 g/L.

图4 料液质量浓度对麦谷蛋白水解度的影响Fig.4 Effect of material mass concentrationon hydrolysis of glutenin
2.2 响应面优化试验
(1) 回归模型的建立与分析
用Design Expert 8.0.6统计软件设计试验,并采用Box-Behnken设计原理,以麦谷蛋白水解度为响应值(Y),选择超声功率(A)、超声时间(B)、水/离子液体体积比值(C)和料液质量浓度(D)进行4因素3水平的旋转正交试验设计.Box-Behnken设计方案共有29次试验,试验结果见表2.

表2 Box-Behnken试验设计及结果
采用Design Expert 8.0.6统计软件对表2试验数据进行回归拟合,建立麦谷蛋白水解度(Y)与超声功率(A)、超声时间(B)、水/离子液体比值(C)和料液质量浓度(D)之间的回归模型为:
Y=10.66-0.26A+0.055B-0.47C+0.082D+0.10AB+0.55AC-0.14AD-0.59BC+0.28BD+0.27CD-1.67A2-1.10B2-1.0C2-2.44D2
式中:A、B、C、D为各因素编码.
上述回归方程的方差分析结果见表3.由表3可知,A2、B2、D2对麦谷蛋白水解度的影响极显著(P<0.01),C2对麦谷蛋白水解度的影响较显著(P<0.05),其余的对麦谷蛋白水解度的影响均不显著(P>0.05).
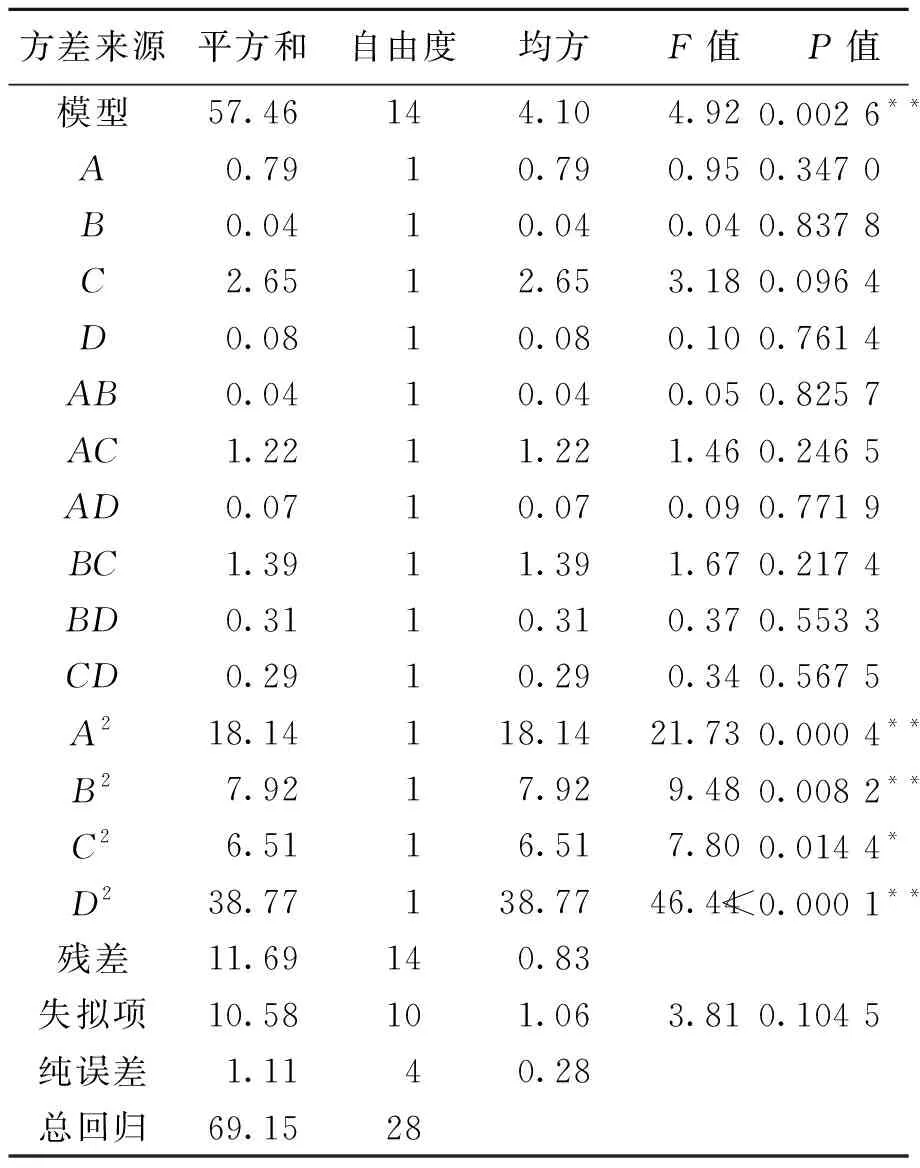
表3 回归模型的方差分析
注:“*”差异显著(P<0.05),“**”差异极显著(P<0.01)
另外,从表3也可看出,该响应面回归模型极显著(P<0.01),失拟项不显著(P>0.05),说明采用该模型分析和预测不同处理条件对麦谷蛋白水解度的影响是比较合适的[16].从各个因素的显著性水平差异可见,各因素对麦谷蛋白水解度的影响依次为C(水/离子液体比值)>A(超声功率)>D(料液质量浓度)>B(超声时间).
(2) 最优工艺条件确定及验证
根据麦谷蛋白水解度与各因子的回归模型可知,各因子的二次项系数均为负值,说明抛物线开口朝下,响应值Y存在极值,可由回归方程确定最优工艺条件.对二次回归的数学模型求一阶偏导可得到以下4个4元一次方程:
3.34A-0.10B-0.55C+0.14D+0.26=0
(1)
0.10A-2.2B-0.59C+0.28D+0.055=0
(2)
0.55A-0.59B-2.0C+0.27D-0.47=0
(3)
0.14A-0.28B-0.27C+4.88D-0.082=0
(4)
对方程(1)、(2)、(3)和(4)求解得A=-0.124 22,B=0.100 36,C=-0.297 46,D=0.009 67.从而确定最佳超声-离子液体辅助麦谷蛋白酶解的最优工艺条件为:超声功率287.7 W,超声时间6.3 min,水/离子液体体积比值0.85∶1,底物浓度20 g/L.在此条件下,麦谷蛋白水解度的预测值为10.74%.对上述最佳处理条件进行验证,经3 次平行性实验,得到麦谷蛋白水解度分别为10.62%、10.71%、10.68%,平均值为10.67%±0.046%.可见,实验值与理论预测值非常接近.表明模型可靠.而未经处理的麦谷蛋白在相同酶解条件下的水解度为7.13%±0.091%(3 次平行性实验分别为7.21%、7.03%、7.14%).本研究结果表明,超声-离子液体处理提高了麦谷蛋白的水解度,且比未处理组的水解度提高了49.65%.
(3) 超声-离子液体处理对麦谷蛋白酶解产物抗氧化活性的影响
超声-离子液体处理对麦谷蛋白酶解产物清除DPPH自由基能力的影响如图5.

图5 超声-离子液体处理对麦谷蛋白酶解产物清除DPPH自由基活性的影响Fig.5 Effect of ultrasound-ionic liquids treatment onscavenging DPPH radical activity of glutenin hydrolysates
从图5可以看出,麦谷蛋白酶解产物清除DPPH自由基活性比Vc的低;在麦谷蛋白酶解产物浓度为20~100 μg/mL时,麦谷蛋白酶解产物对DPPH自由基清除率会随着产物质量浓度的增加而增大.利用Excel软件分析处理数据,得到未处理和超声-离子液体处理的回归方程分别为:y=-0.002 5x2+0.713 9x+3.069(R2=0.996 3)和y=-0.002 5x2+0.71x+11.36(R2=0.997 3),回归方程的相关指数显著.由回归方程可计算得到麦谷蛋白酶解产物清除DPPH自由基的IC50值分别为102.58和73.40 μg/mL,超声-离子液体处理的酶解产物的DPPH自由基清除活性比未处理的提高了28.45%.
超声-离子液体处理对麦谷蛋白Fe2+螯合能力的影响如图6.从图6可以看出,EDTA-2Na的Fe2+螯合能力最大,超声-离子液体处理麦谷蛋白酶解产物对Fe2+螯合能力比未处理的强,在麦谷蛋白酶解产物浓度为10~50 μg/mL时,麦谷蛋白酶解产物对Fe2+螯合能力会随着质量浓度的增加而增加.利用Excel软件分析处理数据,得到未处理和超声-离子液体处理的回归方程分别为:y=-0.041 4x2+3.704 5x-13.676(R2=0.985 7)和y=-0.035 3x2+3.466 6x-4.888 9(R2=0.980 5).由回归方程可得未处理和超声-离子液体处理的麦谷蛋白酶解产物螯合Fe2+的IC50值分别为23.21和19.84 μg/mL.超声-离子液体处理的麦谷蛋白酶解产物的Fe2+螯合能力比未处理的提高了14.52%.
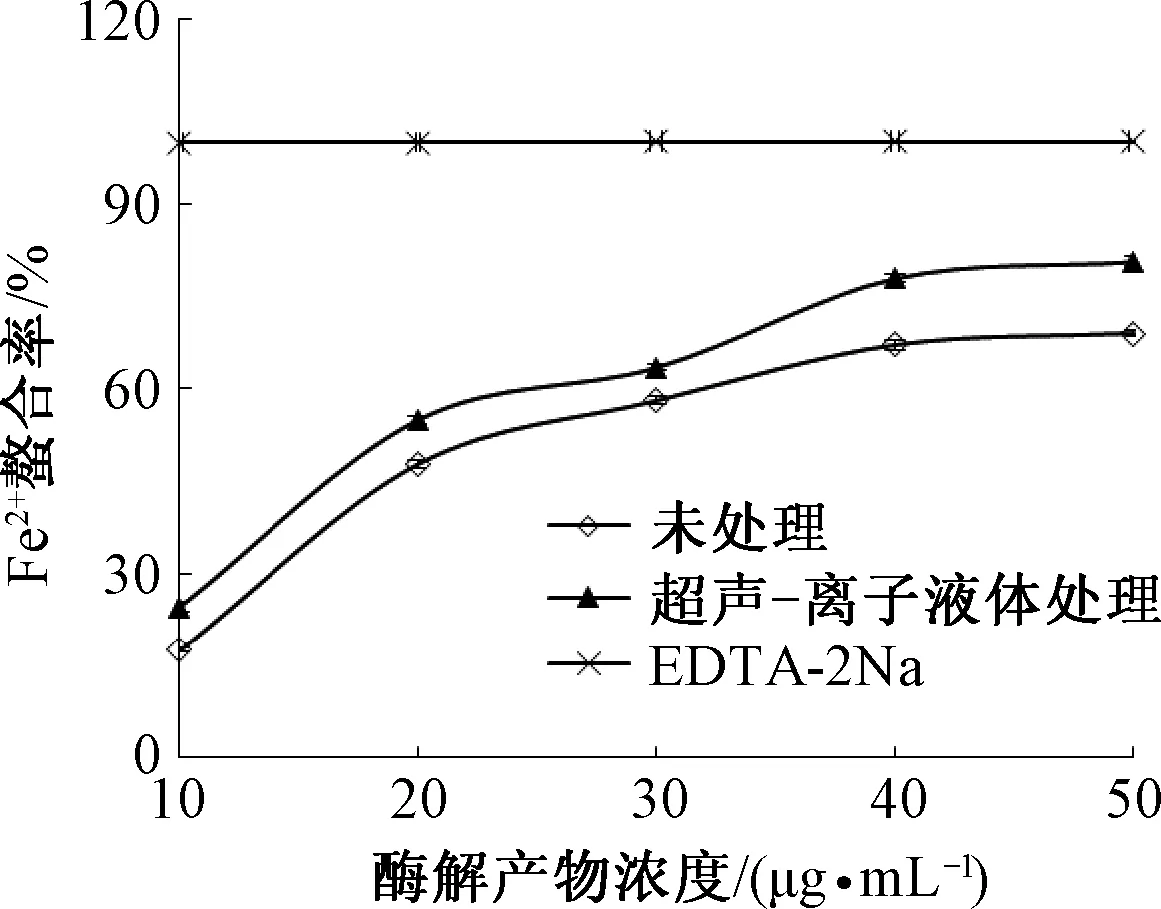
图6 超声-离子液体处理对麦谷蛋白酶解产物螯合Fe2+能力的影响Fig.6 Effect of ultrasound-ionic liquids treatment onFe2+chelating capacity of glutenin hydrolysates
超声-离子液体处理对麦谷蛋白还原力的影响如图7.从图7可以看出,随着麦谷蛋白酶解产物浓度的增大,未处理和超声-离子液体处理的麦谷蛋白酶解产物还原力均不断增强.相同酶解产物浓度下,超声-离子液体处理的麦谷蛋白酶解产物还原力比未处理的高.

图7 超声-离子液体处理对麦谷蛋白酶解产物还原力的影响Fig.7 Effect of ultrasound-ionic liquids treatment onreducing power of glutenin hydrolysates
研究结果表明,超声-离子液体处理的麦谷蛋白酶解产物的抗氧化活性比未处理的高,这主要是因为超声-离子液体耦合处理能够强化处理效果,使麦谷蛋白内部的碱性蛋白酶的作用位点充分暴露,更好地与酶结合,促进酶解,有利于酶解释放出活性更强的抗氧化肽,从而提高酶解产物的抗氧化活性[8,14].
3 结论
(1) 本研究采用响应面法对超声-离子液体处理麦谷蛋白的工艺条件进行优化,得到最佳工艺条件为:超声功率287.7 W、超声时间6.3 min、水/离子液体体积比值为0.85 ∶1、料液质量浓度20 g/L,在此优化条件下,麦谷蛋白的水解度可达到10.67%±0.046%.
(2) 经超声-离子液体处理后,酶解产物的DPPH自由基清除活性、Fe2+螯合力和还原力均比未处理时要高.麦谷蛋白通过超声-离子液体处理后,其酶解产物清除DPPH自由基活性和Fe2+螯合能力分别提高了28.45%和14.52%,且还原力也得到了改善.
