盐酸柯诺拉赞的胚胎-胎仔发育毒性
2018-02-15袁艳娟张玉堂乔红群
蔡 鸣,舒 斌*,邵 卿,袁艳娟,张玉堂,乔红群,刘 晶
(1江苏省药物研究所江苏省药物安全性评价中心,南京 210009;2南京工业大学药学院,南京 211816)
沃诺拉赞-(vonoprazan,商品名Takecab)是由日本武田制药公司研制的一种新型钾离子竞争性酸阻断剂,为可逆性质子泵抑制剂,2014年12月被批准在日本上市,用于治疗幽门螺杆菌感染、胃食管反流、消化性溃疡、十二指肠溃疡、食管炎、胃溃疡等胃酸相关性疾病[1-2]。沃诺拉赞-半衰期长,抑酸作用强而持久,不受CYP2C19基因多态性影响,治疗的个体差异小。沃诺拉赞-以富马酸盐形式成药,在临床治疗腐蚀性食管炎、幽门螺旋杆菌(Hp)根除中相比兰索拉唑表现出优效,为胃酸相关疾病的患者提供了新的治疗选择[3-6]。柯诺拉赞为沃诺拉赞-的结构类似物,作用机制与沃诺拉赞-相似,通过抑制K+和H+-K+-ATP酶(质子泵)结合达到抑制并提前终止胃酸分泌的目的。为评价盐酸柯诺拉赞的药物安全性,本研究采用大鼠进行胚胎-胎仔发育毒性试验及其伴随毒代动力学研究,为其后续研究和临床试验提供科学依据。
1 材 料
1.1 药品与试剂
富马酸沃诺拉赞-对照品(批号20140602,纯度:99.6%,分子式C21H20FN3O6S)与盐酸柯诺拉赞(KFP-H008,批号LF20160113,纯度:99.4%,分子式C22H25FN2O4S)均由江苏柯菲平医药股份有限公司提供。氯化钠注射液为市售制剂,试验用水为实验室自制去离子水(Milli-Q制备)。
1.2 动 物
SPF级SD大鼠,北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK京2012-0001,合格证号11400700184151。♂120只,♀240只,饲养于江苏省药物安全性评价中心动物房,实验动物使用许可证(苏)2016-0032。屏障环境温度21.0~24.9 ℃,相对湿度42.1%~50.5%。
2 方 法
2.1 胚胎-胎仔发育毒性研究[7]
SD大鼠按雄雌2∶1比例合笼,每天早上对雌鼠进行阴道涂片检查,显微镜下查见精子视为交配成功,当天定为妊娠第0天(GD 0)。交配成功者按体质量随机分为5组,每组24只,4只一笼饲养。参照盐酸柯诺拉赞的大鼠经口给药LD50和相关指导原则,设低、中、高剂量(20、60、200 mg/kg)组,另设溶剂和阳性对照组(环磷酰胺),分别连续经口给药10 d(GD 6~15)。于GD 0、GD 3、GD 6、GD 10、GD 13、GD 16、GD 19时称取体质量和加食量,次日称取剩食量,计算摄食量。于受孕GD 20处死孕鼠,记录黄体数、着床数、死胎数、活胎数以及活胎重量、性别、外观异常等。将约1/2胎仔固定于Bouin氏液中做内脏检查,另1/2固定于70%乙醇中制作骨骼标本后做骨骼畸形检查。
2.2 伴随毒代动力学研究
在对SD大鼠进行胚胎-胎仔发育研究时,以卫星组的形式进行伴随毒代动力学研究。盐酸柯诺拉赞低、中、高剂量组中每组15只卫星组孕鼠。用于血药浓度检测的卫星A、B组孕鼠分别用于动物首(单次)、末次(重复)给药时采集血样,时间点依次为给药前、给药后10 min、30 min、1 h、2 h、4 h、7 h、10 h、24 h。采得的血样在1 h内以3 000 r/min,8 ℃离心10 min,于-20 ℃保存备用。用于组织分布检测的卫星C组孕鼠连续给药至GD 19,并于GD 19给药后1 h,采集血样并快速放血处死动物,立即剖取孕鼠的心、肝、肺、肾、胎盘,以及胎仔的心、肝、肺、肾等,用生理盐水洗净后转移至聚丙烯管,保存于-20 ℃。溶剂对照组采集2只孕鼠的空白样本。盐酸柯诺拉赞的定量测定采用HPLC-MS/MS方法检测。
2.3 统计学方法
各项指标检查结果经SPSS 20.0软件包统计处理。P<0.05为有统计学差异。
3 结 果
3.1 胚胎-胎仔发育毒性
给药期间,盐酸柯诺拉赞未对动物的一般状况造成明显影响。与溶剂对照组相比,高剂量组在GD 10、GD 13、GD 16时耗食量减少明显(表1);同期,高、中剂量组动物体重也明显轻于对照(表2)。此外,高、中剂量组动物的总增重也较明显小于溶剂对照组(P<0.05)。
盐酸柯诺拉赞各剂量组的活胎数、死胎数、吸收胎数、着床数、黄体数、子宫总重、胎盘总重、性别比与溶剂对照组相比均无显著差异(P>0.05)。结果见表3。
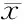
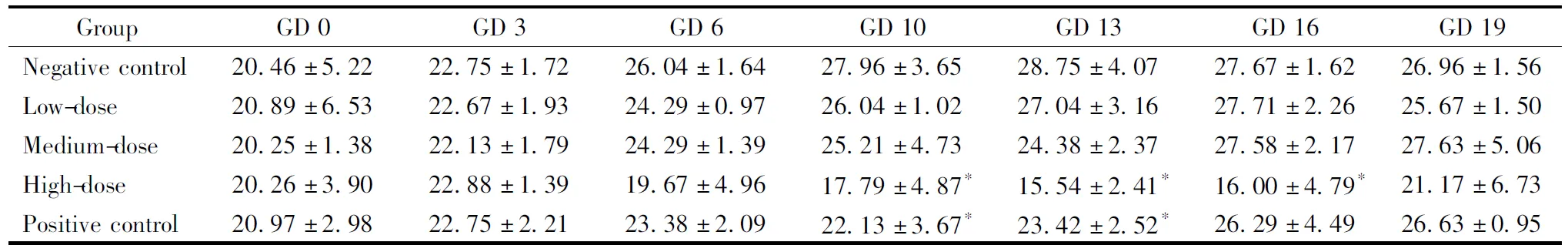
GroupGD 0GD 3GD 6GD 10GD 13GD 16GD 19Negative con-trol20.46±5.2222.75±1.7226.04±1.6427.96±3.6528.75±4.0727.67±1.6226.96±1.56Low-dose20.89±6.5322.67±1.9324.29±0.9726.04±1.0227.04±3.1627.71±2.2625.67±1.50Medium-dose20.25±1.3822.13±1.7924.29±1.3925.21±4.7324.38±2.3727.58±2.1727.63±5.06High-dose20.26±3.9022.88±1.3919.67±4.9617.79±4.87*15.54±2.41*16.00±4.79*21.17±6.73Positive control20.97±2.9822.75±2.2123.38±2.0922.13±3.67*23.42±2.52*26.29±4.4926.63±0.95
*P<0.05vsnegative control group
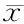
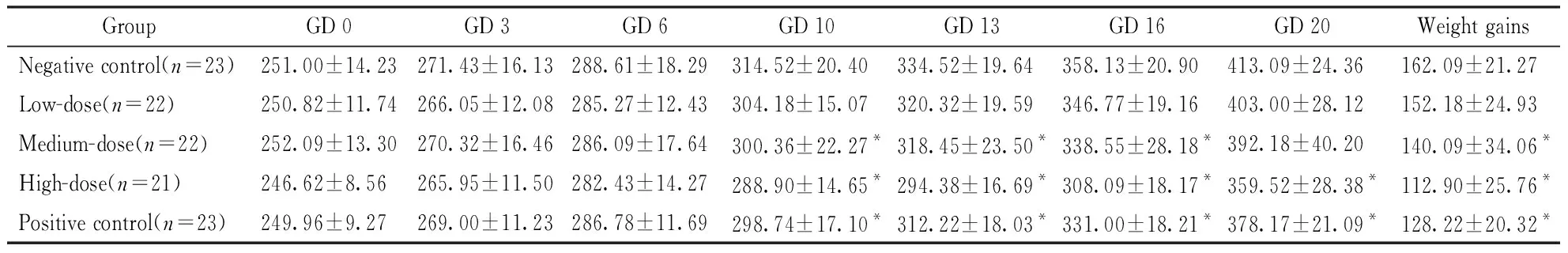
GroupGD 0GD 3GD 6GD 10GD 13GD 16GD 20Weight gainsNegative control(n=23)251.00±14.23271.43±16.13288.61±18.29314.52±20.40334.52±19.64358.13±20.90413.09±24.36162.09±21.27Low-dose(n=22)250.82±11.74266.05±12.08285.27±12.43304.18±15.07320.32±19.59346.77±19.16403.00±28.12152.18±24.93Medium-dose(n=22)252.09±13.30270.32±16.46286.09±17.64300.36±22.27*318.45±23.50*338.55±28.18*392.18±40.20140.09±34.06*High-dose(n=21)246.62±8.56265.95±11.50282.43±14.27288.90±14.65*294.38±16.69*308.09±18.17*359.52±28.38*112.90±25.76*Positive control(n=23)249.96±9.27269.00±11.23286.78±11.69298.74±17.10*312.22±18.03*331.00±18.21*378.17±21.09*128.22±20.32*
*P<0.05vsnegative control group
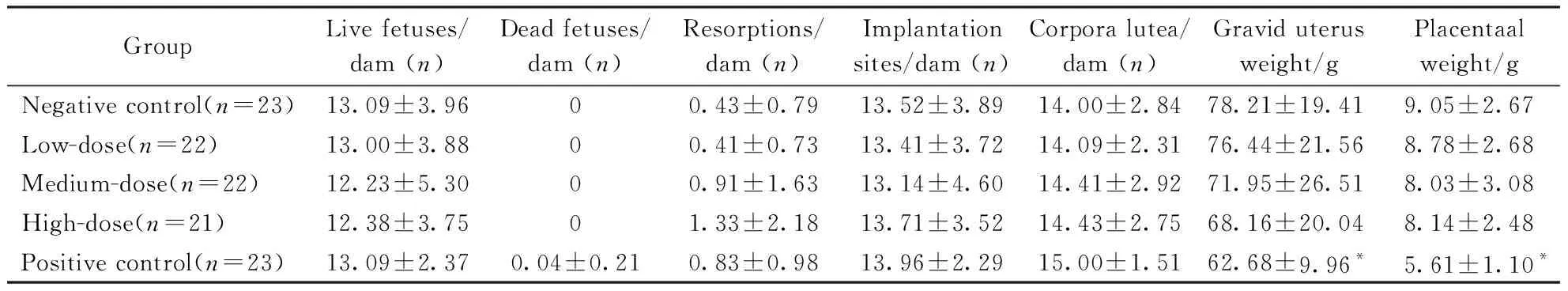
GroupLive fetuses/dam (n)Dead fetuses/dam (n)Resorptions/dam (n)Implantation sites/dam (n)Corpora lutea/dam (n)Gravid uterus weight/gPlacentaal weight/gNegative control(n=23)13.09±3.9600.43±0.7913.52±3.8914.00±2.8478.21±19.419.05±2.67Low-dose(n=22)13.00±3.8800.41±0.7313.41±3.7214.09±2.3176.44±21.568.78±2.68Medium-dose(n=22)12.23±5.3000.91±1.6313.14±4.6014.41±2.9271.95±26.518.03±3.08High-dose(n=21)12.38±3.7501.33±2.1813.71±3.5214.43±2.7568.16±20.048.14±2.48Positive control(n=23)13.09±2.370.04±0.210.83±0.9813.96±2.2915.00±1.5162.68±9.96*5.61±1.10*
*P<0.05vsnegative control group
由表4可看出,盐酸柯诺拉赞高剂量组动物的胎鼠顶臀长显著短于溶剂对照组(P<0.05)。
胎鼠内脏检查未见畸形发生。骨骼检查,盐酸柯诺拉赞高剂量组136个样本中出现枕骨骨化不全8例,胸骨骨化不全86例,肋骨变异或畸形5例,四肢骨骨化不全110例;中剂量组138个样本中出现枕骨骨化不全7例,肋骨变异或畸形4例,四肢骨骨化不全75例,经χ2检验发现,与溶剂对照组相比均有显著差异。中、低剂量组出现的胸骨骨化不全数量与溶剂对照组相比无统计学差异(表5),说明中、高剂量的盐酸柯诺拉赞可对胎仔的骨骼发育产生比较明显的影响。


GroupSex ratio (f/m)Ccrown rump length/cmFetal weight/gNegative control(n=23)0.96±0.573.65±0.244.03±0.59Low-dose(n=22)1.54±0.773.57±0.133.84±0.25Medium-dose(n=22)1.03±0.693.62±0.323.93±0.76High-dose(n=21)1.38±0.853.44±0.18*3.66±0.36Positive control(n=23)1.40±0.973.23±0.17*3.15±0.26*
*P<0.05vsnegative control group
Table5 Skeletal alterations on fetus from pregnant rats treated with carenoprazan hydrochloride during GD 6-15
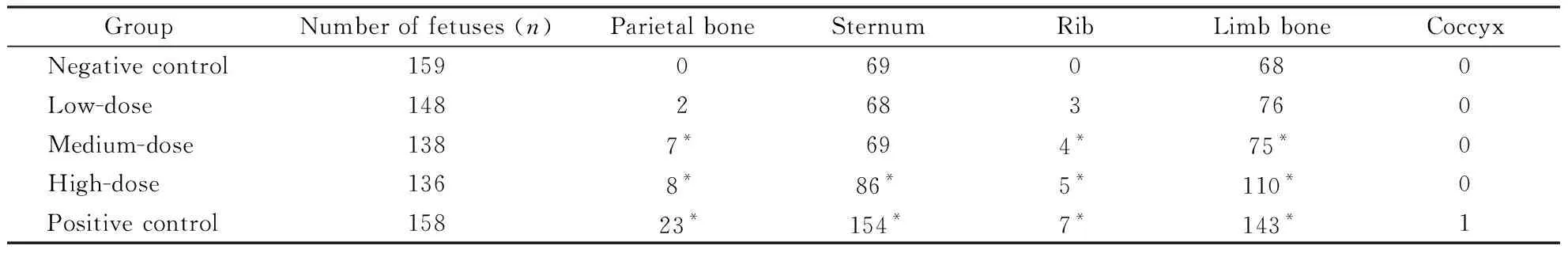
GroupNumber of fetuses (n)Parietal boneSternumRibLimb boneCoccyxNegative control1590690680Low-dose1482683760Medium-dose1387*694*75*0High-dose1368*86*5*110*0Positive control15823*154*7*143*1
*P<0.05vsnegative control group,by χ2test
3.2 伴随毒代动力学研究
盐酸柯诺拉赞低(20 mg/kg)、中(60 mg/kg)剂量组首(单次)、末(多次重复)次给予孕鼠口服后,测得盐酸柯诺拉赞及其代谢产物达峰时间约为0.5~1 h,而高剂量(200 mg/kg)组均有所延迟,约为2 h。
由表6可看出,多次重复给药后,中剂量组盐酸柯诺拉赞及其代谢产物的AUC0-t均较首次显著增高(P<0.05),存在蓄积倾向;但代谢产物的cmax较首次明显降低(P<0.05)。高剂量组盐酸柯诺拉赞及其代谢产物在动物体内的暴露(cmax、AUC0-t)较首次出现不同程度的降低。3个剂量组末次给药后测得盐酸柯诺拉赞的cmax分别为首次给药后的1.3、1.9、0.9倍,AUC0-t分别为首次的1.4、3.0、0.8倍。各剂量组末次代谢产物的cmax分别为首次的0.7、0.7、0.6倍,AUC0-t分别为首次的1.0、1.8、0.6倍。
在20~200 mg/kg剂量范围内,单次给予盐酸柯诺拉赞的孕鼠血浆原形药物cmax与剂量呈等比例增长,呈现线性动力学特征。但其代谢产物则未表现出线性特征(表6)。此外,多次给药后的孕鼠血浆中盐酸柯诺拉赞及其代谢产物的cmax均与剂量变化不成比例,呈现非线性动力学特征。单次及多次给药后的盐酸柯诺拉赞及其代谢产物的AUC0-t增长的比例均高于剂量的改变,呈现非线性动力学特征。
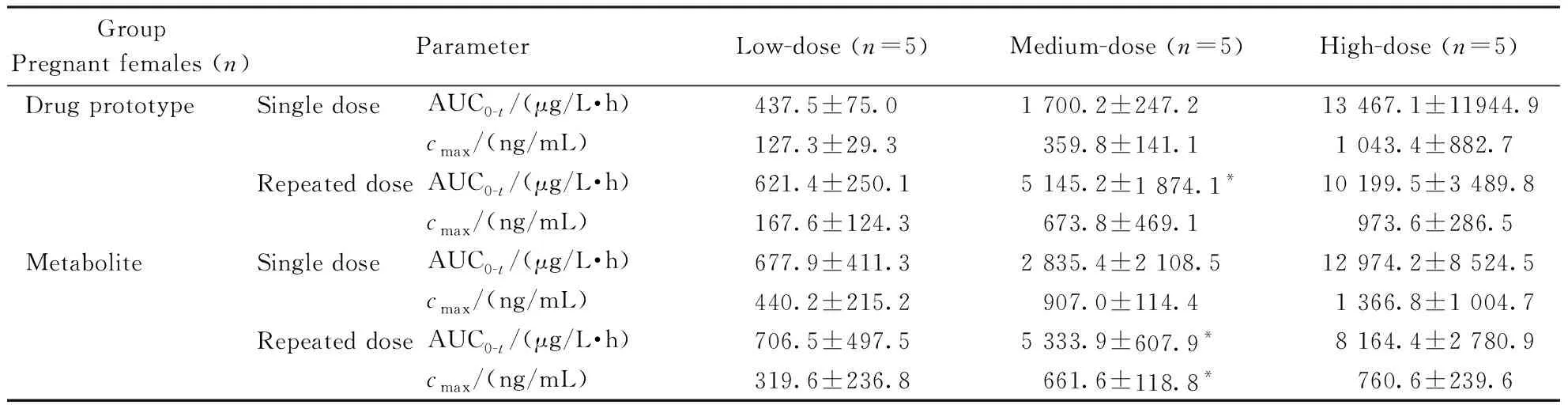
Group Pregnant females (n)ParameterLow-dose (n=5)Medium-dose (n=5)High-dose (n=5)Drug prototypeSingle doseAUC0-t/(μg/L·h)437.5±75.01 700.2±247.213 467.1±11944.9cmax/(ng/mL)127.3±29.3359.8±141.11 043.4±882.7Repeated doseAUC0-t/(μg/L·h)621.4±250.15 145.2±1 874.1*10 199.5±3 489.8cmax/(ng/mL)167.6±124.3673.8±469.1973.6±286.5MetaboliteSingle doseAUC0-t/(μg/L·h)677.9±411.32 835.4±2 108.512 974.2±8 524.5cmax/(ng/mL)440.2±215.2907.0±114.41 366.8±1 004.7Repeated doseAUC0-t/(μg/L·h)706.5±497.55 333.9±607.9*8 164.4±2 780.9cmax/(ng/mL)319.6±236.8661.6±118.8*760.6±239.6
*P<0.05vssingle dose group
孕鼠灌胃给予盐酸柯诺拉赞后,其在肝、肺中的含量较高,胎盘、心中含量较低,但均高于血浆。盐酸柯诺拉赞可透过胎盘屏障进入胎仔体内,所测得脏器分布趋势与母体相近,以肝含量最高、心含量最低,且均低于母体胎盘的含量(表7)。代谢产物的分布与原形有所不同,其在肝、肾中的含量较高;胎盘、肺、心中含量较低,且均低于血浆(表8)。各剂量组胎仔体内的代谢产物分布趋势与母体相近,肝含量最高、心含量最低,且均低于母体胎盘中的含量。
4 讨 论
沃诺拉赞-的上市为治疗胃酸相关性疾病提供了新的选择,但有关其用药安全性的报道相对较少。本研究首次报道了将较高剂量(20~200 mg/kg)的盐酸柯诺拉赞给予怀孕动物后的代谢情况及其对母鼠和胎鼠的影响。结果发现,在致畸敏感期灌胃给予孕鼠60和200 mg/kg的盐酸柯诺拉赞对母体和胎仔均产生了明显的毒性反应,而20 mg/kg剂量则未见明显影响。
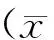
GroupLow-doseMedium-doseHigh-dosePregnant females (n)(n=4)(n=5)(n=5) MaternalPlasma (μg/mL)0.127±0.0320.264±0.1770.737±0.152Heart (μg/g)1.625±0.3313.564±1.4677.500±1.764Liver (μg/g)5.338±1.25310.860±4.44746.940±11.161Lung (μg/g)22.338±6.02637.940±9.02786.950±26.940Kidney (μg/g)3.740±1.7748.07±5.5921.12±8.58Placenta (μg/g)1.508±0.6292.97±0.8214.94±6.10 FetusHeart (μg/g)0.008±0.0150.034±0.0610.189±0.086Liver (μg/g)0.094±0.0810.285±0.2251.169±0.359Lung (μg/g)0.085±0.0500.284±0.1870.937±0.226Kidney (μg/g)0.018±0.0190.119±0.1230.307±0.253

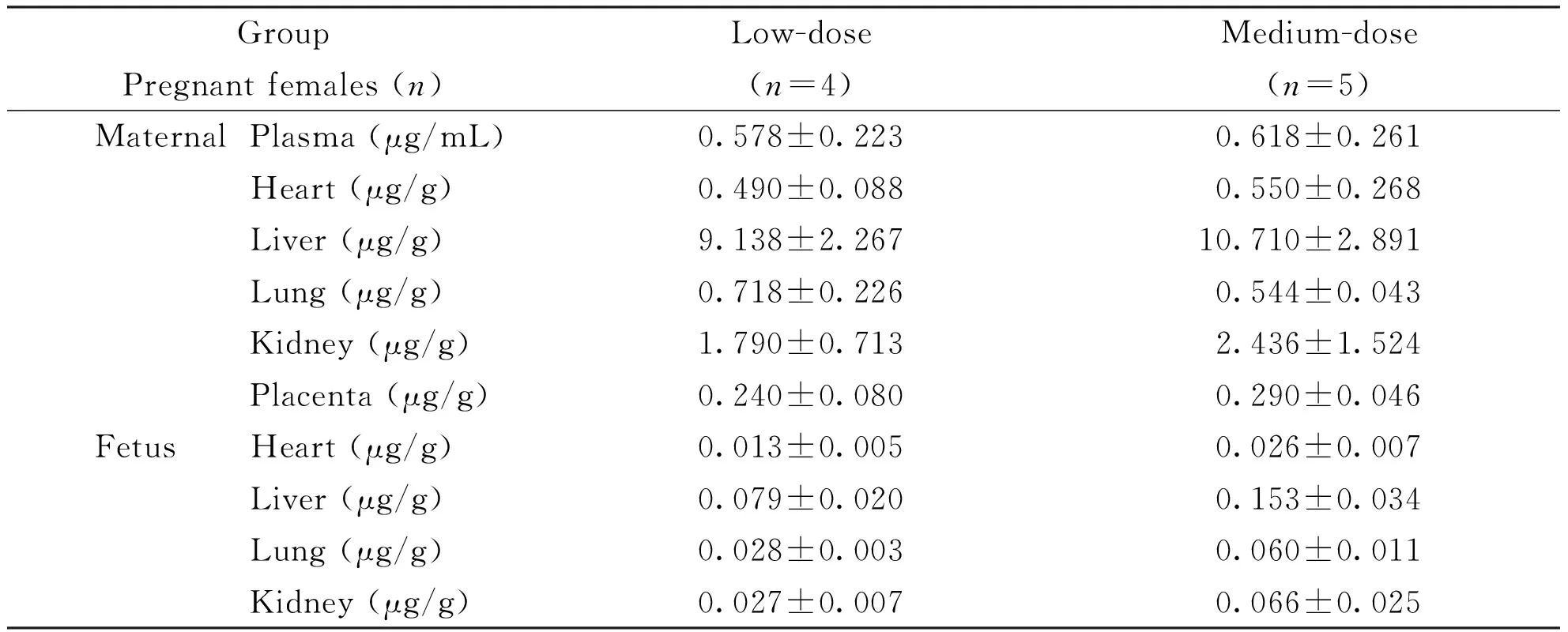
GroupLow-doseMedium-doseHigh-dosePregnant females (n)(n=4)(n=5)(n=5) MaternalPlasma (μg/mL)0.578±0.2230.618±0.2610.800±0.191Heart (μg/g)0.490±0.0880.550±0.2680.564±0.275Liver (μg/g)9.138±2.26710.710±2.89118.480±2.913Lung (μg/g)0.718±0.2260.544±0.0430.702±0.135Kidney (μg/g)1.790±0.7132.436±1.5242.242±0.848Placenta (μg/g)0.240±0.0800.290±0.0460.470±0.185 FetusHeart (μg/g)0.013±0.0050.026±0.0070.065±0.034Liver (μg/g)0.079±0.0200.153±0.0340.409±0.149Lung (μg/g)0.028±0.0030.060±0.0110.173±0.059Kidney (μg/g)0.027±0.0070.066±0.0250.158±0.064
在进行SD大鼠生殖毒性研究的同时,本研究以卫星组的形式进行伴随的毒代动力学研究,以观察盐酸柯诺拉赞在孕鼠及胎仔体内的暴露情况,考察受试药是否可以通过胎盘屏障,结合其毒性研究结果给予可能的解释。沃诺拉赞-口服后能吸收迅速,主要通过肝微粒体酶CYP3A4代谢,游离碱形式在血浆中迅速消失,而在胃组织中累积,给药24 h后在胃组织中仍然存在[8]。59%以代谢物的形式从尿液排出,仅有8%以游离碱原形从尿液排出[1]。已知的4个代谢产物均无药理活性[9]。在急性肝损伤模型大鼠体内,沃诺拉赞-暴露量AUC显著增加,消除半衰期延长,表明急性肝损伤状态下沃诺拉赞-在大鼠体内的吸收和消除均受到影响[10]。由于妊娠期动物存在生理方面的迅速变化,进而可能引起药物代谢动力学的改变。参考上述数据,本研究进行了孕鼠口服较高剂量的盐酸柯诺拉赞后的血药浓度检测,发现药物同样吸收迅速,达峰时间约为0.5~1 h。本研究发现,盐酸柯诺拉赞及其代谢产物可透过胎盘屏障进入胎仔体内,且脏器分布趋势与母体相近,均以肝中含量为最高。因此中、高剂量组出现的胎仔发育毒性应与盐酸柯诺拉赞透过胎盘屏障相关。此外,单次与多次给予盐酸柯诺拉赞后的血药浓度cmax变化情况有较大不同,其原因尚待进一步的研究。
