类受体激酶调控根生长发育的研究进展
2018-02-13孙孟园蒋亨珂万传银杨文钰杜俊波
黎 艳,孙孟园,蒋亨珂,万传银,孙 歆,杨文钰,杜俊波*
(1 四川农业大学 农学院,成都 611130;2 农业部 西南作物生理生态与耕作重点实验室,成都 611130)
生物在生长发育和适应环境的过程中,通过细胞表面的受体感知和传递胞外信号[1-2]。在动物细胞膜上,存在一类具有激酶活性的跨膜受体蛋白,即受体酪氨酸激酶(receptor tyrosine kinases, RTKs)[3]。RTKs的胞外结构域和配体结合后通过其胞内激酶结构域催化底物蛋白磷酸化,进而调控细胞的生理反应[4]。后来,在植物中也鉴定出了许多与动物酪氨酸激酶结构类似的基因产物,这些基因产物被称为植物类受体激酶(receptor-like kinases, RLKs)[5-6]。
1 类受体激酶的结构
植物中的大部分RLKs与动物Pelle/IRAK-4激酶相似,含有N端信号肽、可变的胞外结构域、单次跨膜结构域和胞内的近膜区与激酶结构域(图1)[17-19]。胞外结构域(extracellular domain, ECD) 是信号的结合中心,可通过与信号分子(配体)相互作用来感知胞外信号,配体结合后触发RLKs形成二聚体或多聚体,从而激活胞内激酶结构域[15]。跨膜结构域(transmembrane domain, TM)是一个由22~28 个氨基酸构成的疏水结构域,其作用是将类受体激酶固定在质膜上并将胞外信号传递到胞内,主要起信号的传递作用[20]。胞内的蛋白激酶结构域(kinase domain, KD)含有 11 个保守的氨基酸序列,是高度保守的结构域,具有磷酸化结合位点,是催化底物蛋白磷酸化的反应中心。除此之外,胞内还有一个将跨膜结构域和激酶结构域隔开的近膜区(juxtamembrane region)[4,21]。大部分植物 RLKs 胞外区还具有N端信号肽(signal peptide, SP)(表1),N端信号肽在蛋白质合成过程中负责蛋白的转运和利用蛋白质的信号肽识别胞外信号,是信号的识别中心[5]。
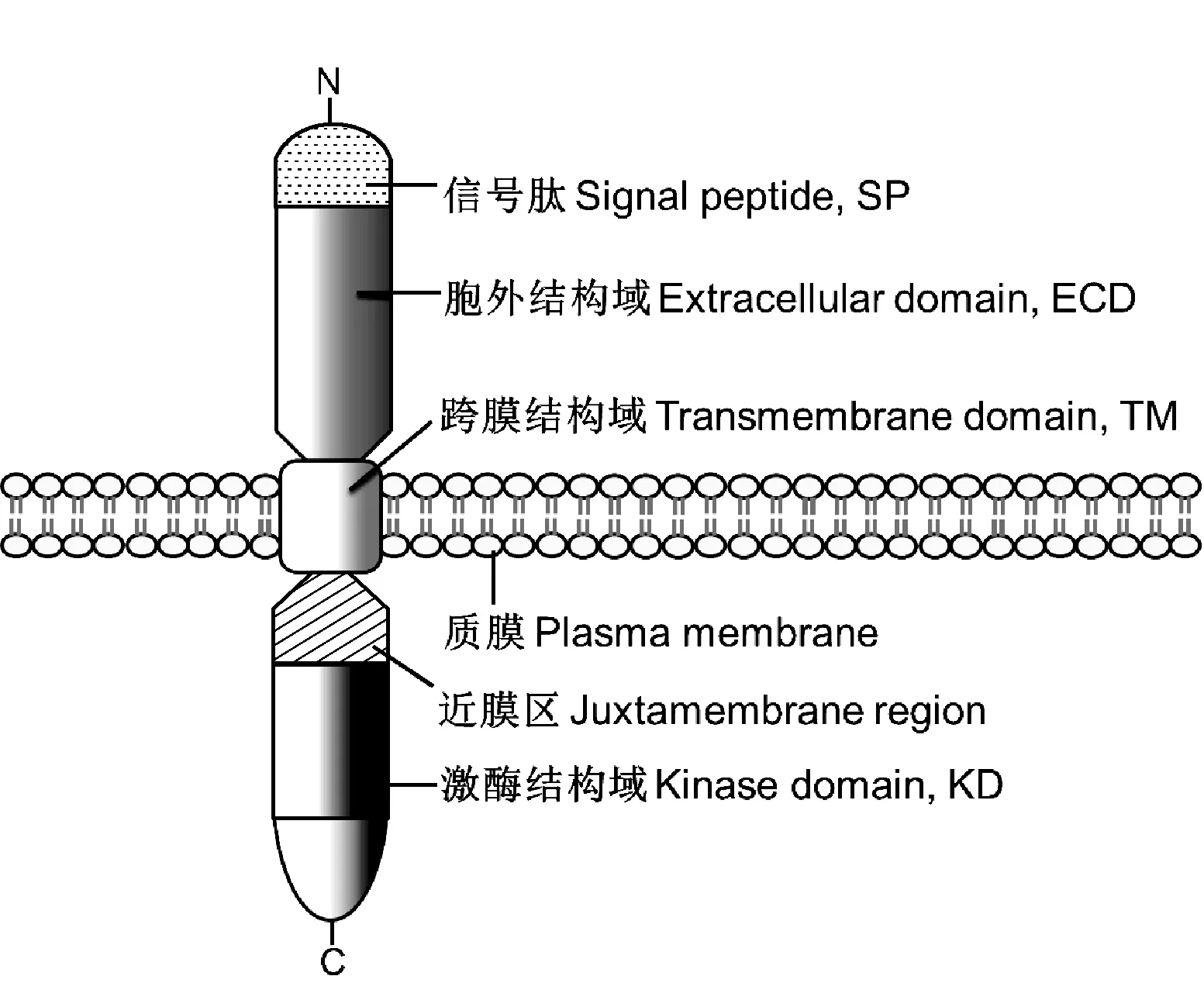
图1 一个典型的RLK结构模式Fig.1 A structural model of a typical plant RLK
2 类受体激酶的分类
RLKs家族的许多成员已得到鉴定,虽然RLKs 最初被定义为跨膜受体,但并不是所有的RLKs成员都具有胞外结构域(表1)。根据其是否具有胞外结构域的存在,RLKs家族可归类为有胞外结构域的类受体激酶(RLK)和无胞外结构域的类受体胞质激酶(receptor-like cytoplasmic kinase, RLCK)[15]。RLKs的激酶结构域具有高度的同源性,但它们的胞外结构域差异很大,根据其细胞外结构域的不同又将RLKs分为21个亚家族,包括富含亮氨酸重复序列LRR (leucine-rich repeat, LRR)的LRR-RLKs、含有S-结构域的S-RLKs、类受体胞质激酶RLCK等(表1)[7,15,22]。其中,LRR-RLKs是RLKs中最大的亚家族,其胞外结构域富含亮氨酸重复序列,拟南芥有200多个基因编码LRR-RLKs[15]。LRR-RLKs可以催化丝氨酸残基和苏氨酸残基的磷酸化,也可以催化酪氨酸残基的磷酸化[23-27]。
3 类受体激酶的作用机制
一个典型的植物 RLKs由胞外结构域、跨膜结构域和激酶结构域3部分组成[19]。因RLKs的结构与动物RTKs具有高度的相似性,人们普遍认为RLKs与动物RTKs具有相似的作用机制[17,28-29]。植物 RLKs可以独立完成对信号的接收和传递,当其胞外结构域与信号分子配体结合后,触发植物 RLKs二聚化或寡聚化,聚合后的受体复合物通过多处氨基酸残基的自磷酸化或相互磷酸化激活激酶结构域,完成跨膜传递信号的功能[7]。早期的研究证明,大多数拟南芥的类受体激酶催化底物蛋白的丝氨酸残基和苏氨酸残基磷酸化[30],但后来研究表明许多植物 RLKs也可以催化蛋白质的酪氨酸残基磷酸化,表明了一些植物 RLKs可能具有双重激酶活性[23,25,31-32]。在细胞内的信号转导过程中, RLCKs可与受体复合物相关联,RLCKs通过启动一系列信号转导级联反应以完成信号的胞内转导[33-34]。因此,RLKs及其共受体和RLCKs在信号转导中的动态关联也是细胞信号转导的新兴研究主题[34]。除RLCKs外,受体复合物的下游信号级联反应还包括丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)、钙依赖性蛋白激酶(calcium-dependent protein kinases, CPKs)或小GTP酶蛋白家族(small GTPase protein family, GTPases),它们通过磷酸化不同的下游底物来调节不同的细胞生理反应,即通过改变转录因子的活性来调控配体应答基因的表达(图2)[35]。在信号级联反应过程中,植物也可以通过一些调控机制来控制信号的强度和RLKs的活性。如与激酶结构域可逆缔合的抑制性蛋白和磷酸酶可以去除激酶结构域的活性[36-42]。一些翻译后修饰也可调节RLKs的活性,如糖基化、乙酰化、硫醇化和二硫醇二硫化物交换反应等[43-44]。另外,泛素化介导的降解途径也可通过调节受体的丰度来控制信号强度,以及受体复合物中假激酶的存在也可调节信号的强度[45-49]。

表1 植物类受体激酶的分类
注:SP. 信号肽;PM. 质膜;LRRs. 富含亮氨酸重复序列;EGF. 表皮生长因子;DUF. 功能未知的结构域; PAN. 纤溶酶原/苹果/线虫蛋白质结构域; TNFR. 肿瘤坏死因子型类受体激酶;ECD. 胞外结构域
Note: SP. signal peptide; PM.Plasma membrane; LRRs. Leucine-rich repeats; EGF. Epidermal growth factor; DUF. Domain of unknown function; PAN. Plasmino-gen/apple/nematode protein domain; TNFR. Tumor necrosis factor receptor; ECD. Extracellular domain

RLKs介导的信号转导模式:①胞外的信号分子(配体)与细胞 膜上的RLK结合并触发RLKs二聚化或寡聚化;②聚合后的 受体复合物通过多处氨基酸残基的自磷酸化或转磷酸化激活 胞内激酶结构域;③激活后的激酶结构域与下游的细胞质 激酶(RLCKs)、丝裂原活化蛋白激酶(MAPKs)、钙依赖 性蛋白激酶(CPKs)或小GTP酶蛋白家族(GTPases)相关 联将信号级联放大;④通过磷酸化底物蛋白改变应答基因的 表达进而调节植物的生长发育图2 RLKs介导的信号转导模式 A model of RLKs-mediated signal transduction: ① Extracellular signaling molecules (ligand) bind to the plasma membrane- located RLKs and trigger dimerization or oligomerization of RLKs; ② The polymerized receptor complex activates the intracellular kinase domain by autophosphorylation or transphosphorylation; ③ The activated kinase amplifies the signal cascades by interacting with and phosphorylating downstream cytoplasmic kinases (RLCKs), mitogen-activated protein kinases (MAPKs), calcium-dependent protein kinases (CPKs), or small GTPase protein family (GTPases); ④ It then alters the expression of target genes, thus finally regulates plant growth and developmentFig.2 A model of RLKs-mediated signal transduction pathway
4 类受体激酶参与根的生长发育调控
根作为植物的重要营养器官,执行着诸多生物学功能,包括机械支持、吸收和运输水分和养分、将无机养分合成为有机物质、产生激素等[50]。植物根系主要分为初生根和侧根。初生根是由种子的胚根形成的,并且向下延伸到土壤中,是植物生长发育所必需的;侧根是植物根系结构的主要决定因素,对水和营养物质的吸收也至关重要[50]。根的生长发育受到细胞内和细胞间信号转导的精确控制。RLKs作为细胞表面的信号监测者和传递者,在根的生长发育过程中发挥着重要作用。
4.1 参与初生根的发育调控
植物中存在大量的分泌小肽,RLKs可作为小肽的受体共同调节植物的生长发育[51-52]。CLE(CLAVATA3/ embryo surrounding region)肽家族参与广泛的发育过程。在拟南芥中,不同的CLE肽配体及其同源CLV(clavata)可与类受体激酶BAM(barely any meristem)相互作用,它们组成的信号转导途径共同调控根的发育[53]。在根的初生韧皮部中表达的CLE45(CLAVATA3/esr-related 45)可以抑制初生韧皮部的分化和根分生组织的生长,而这种抑制作用在bam3突变体中被明显减弱,研究表明BAM3作为CLE45的受体调控初生韧皮部的分化和根分生组织的生长[54]。在根尖细胞中,多肽CLE40通过与类受体激酶 ACR4(arabidopsis crinkly4)结合抑制WOX5(wuschel-related homeobox 5)的表达,从而调控根尖分生组织干细胞的增殖与分化[55-56]。拟南芥类受体激酶TOAD2(toadstool 2)/ RPK2(receptor-like protein kinase 2)和RPK1也参与调节根的生长,CLE17肽处理会抑制野生型植株根分生组织的生长,toad2 /rpk2突变体的根分生组织对CLE17肽处理不敏感[57]。此外,CLE处理后导致的RPK1蛋白表达严重降低且依赖于TOAD2 / RPK2。这些结果表明,这2种RLK在共同途径中介导CLE信号转导以调控根的生长[57]。
酪氨酸蛋白质磺基转移酶TPST(tyrosylprotein sulfotransferase)介导肽激素的翻译后修饰。拟南芥的TPST功能缺失突变体tpst-1表现出根分生组织减少和根严重缩短的表型[58]。而RGF1 (root meristem growth factor 1)肽可以恢复tpst-1突变体中的根分生组织活性,表明该肽对根系干细胞维持至关重要[58]。编码亮氨酸重复序列的类受体激酶RGFR (RGF1 receptor)又叫RGI(RGF1 insensitive),RGFR 与 BAK1(BRI1-associated receptor kinase)可作为RGF肽的受体通过PLT(plethora)转录因子调控根的初级分生组织活性[59-60]。
酪氨酸硫化肽PSK(phytosulfokine precursor)和PSY1(plant peptide containing sulfated tyrosine 1)可通过调节伸长区的细胞扩增促进初生根的生长[61]。2个编码亮氨酸重复序列的类受体激酶PSKR1(phytosulfokin receptor 1)和PSKR2是识别PSK肽的受体,它们的同源蛋白PSY1R(PSY1 receptor)是识别PSY1的受体[62]。研究表明,PSKR1与BAK1/SERK3(somatic embryogenesis receptor-like kinase 3)相互作用形成异源二聚体响应PSK信号肽进而调控初生根的生长[63-64]。
类受体激酶FER(feronia,以伊特鲁里亚人的生育女神Feronia命名)是CrRLK1L亚家族的成员之一,最初被鉴定为调节花粉管生长和雌雄配子互作的重要调节因子[65-66]。后来发现分泌肽RALF(rapid alkalinization factor)通过激活拟南芥中的细胞表面的FERONIA来抑制初生根的细胞伸长[67]。
BRI1(brassinosteroid insensitive 1)是一种典型的富含亮氨酸重复序列的类受体激酶,被鉴定为油菜素内酯(BR)的受体[68-70]。拟南芥SERK(somatic embryogenesis receptor-like kinase)家族成员作为BRI1的共同受体,在BR信号通路的早期激活步骤中发挥重要作用[71-72]。一项研究报道,SERKs也参与调控根的生长[73]。BR信号通路在serk1bak1bkk1三重突变体中完全被破坏,但三重突变体的根比BR缺陷突变体cpd和BR信号突变体bri1-701的根更短[73]。进一步研究发现,三重突变体中极性生长素转运、细胞周期、内胚层发育和根分生组织分化等相关基因的表达量大大降低,而这些基因在突变体cpd和bri1-701中的表达量却没有发生太大变化[73]。这些结果表明,SERKs通过BR非依赖性途径控制根的生长。
3.3.2.黄体功能不全黄体功能不全常源于卵泡的生长异常,因此可采用氯米芬或促性腺激素促排卵,hCG诱发排卵并进行黄体期支持,可使用黄体酮20mg每日肌内注射和(或)hCG 2000U,隔日肌内注射至孕10~12周左右[1 1]。
凯氏带环绕在内皮层径向壁和横向壁上,具栓质化和木质化带状增厚的壁结构,它控制着皮层和维管柱之间的物质运输[74]。CIF(casparian strip integrity factor)是凯氏带形成所必需的硫酸化肽[75]。研究发现,编码亮氨酸重复序列的类受体激酶SGN3/GSO1(schengen3/gassho1)及其同源蛋白GSO2可作为CIF肽的受体,GSO1 / SGN3功能丧失突变引起凯氏带支架蛋白CASP(casparian strip membrane domain protein)错误定位,最终导致形成中断的不连续凯氏带[75-76](图3)。
4.2 参与侧根的发育调控
根的中柱鞘分化出侧根原基,侧根从成熟区的中柱鞘部位生长出来,贯穿皮层,最终突破表皮向根外伸长[77]。 一些CLE肽在侧根生长中起作用以响应土壤中氮素的变化水平。CLE1、CLE3、CLE4和CLE7主要在中柱鞘中表达,低水平的氮素使它们表达上调,而过度表达这些CLE基因抑制侧根生长[78]。clv1-1突变体在低氮素条件下侧根伸长[78]。CLE3特异性抑制野生型的侧根形成,但不抑制clv1突变体的侧根形成[78]。这些结果表明,CLE-CLV1信号转导模块通过响应土壤中氮素水平的变化以调控侧根的生长。CEP1(C-terminally encoded peptide 1)肽在侧根原基中表达,并且CEP1的过表达抑制拟南芥中的侧根生长[79]。合成肽CEP1、CEP3和CEP9的应用也会抑制侧根的发育[79-80]。类受体激酶CEPR1(C-terminally encoded peptide receptor 1)和 CEPR2作为CEP家族几个成员的受体共同调控侧根的生长,突变体cepr1和cepr1cepr2表现出增强的侧根生长[81-82]。然而CEP5被证明是侧根形成的负调节子,因为CEP5过表达与cepr1突变体类似表现出侧根数量减少[82]。
最近的一项研究表明,TDIF-TDR/PXY(TDIF receptor/phloem intercalated with xylem)-BIN2(brassinosteroid insensitive 2)-ARF(auxin response factor)信号通路在侧根形成中起作用[83]。TDR是一种LRR-RLK,TDIF的应用会增加侧根密度,而tdr突变体对TDIF处理不敏感,研究发现TDR作为TDIF的受体与周围的BIN2相互作用并增强BIN2介导的ARF磷酸化以激活ARF,最终促进侧根形成[83]。
IDA(inflorescence deficientin abscission)肽在侧根的形成中发挥重要作用[84]。IDA被2个含亮氨酸重复序列的类受体激酶HAE(haesa)和HSL2(haesa-like2)感知[85],并通过诱导各种细胞壁重塑酶的表达促进细胞壁降解,最终促进侧根出现[84]。SERK1作为HAE的共受体促进IDA的识别[2]。遗传分析显示,所有4种SERK家族RLK在此过程中起着冗余作用[86]。IDA可诱导HAE / HSL2和SERK形成异源二聚体,使其相互磷酸化[86]。RGF1肽处理使拟南芥的侧根数量明显减少,且rgi1/2/3/4四重突变体对侧根形成中RGF1的敏感性低于野生型,表明RGF1及其受体也在侧根形成中发挥作用[87]。
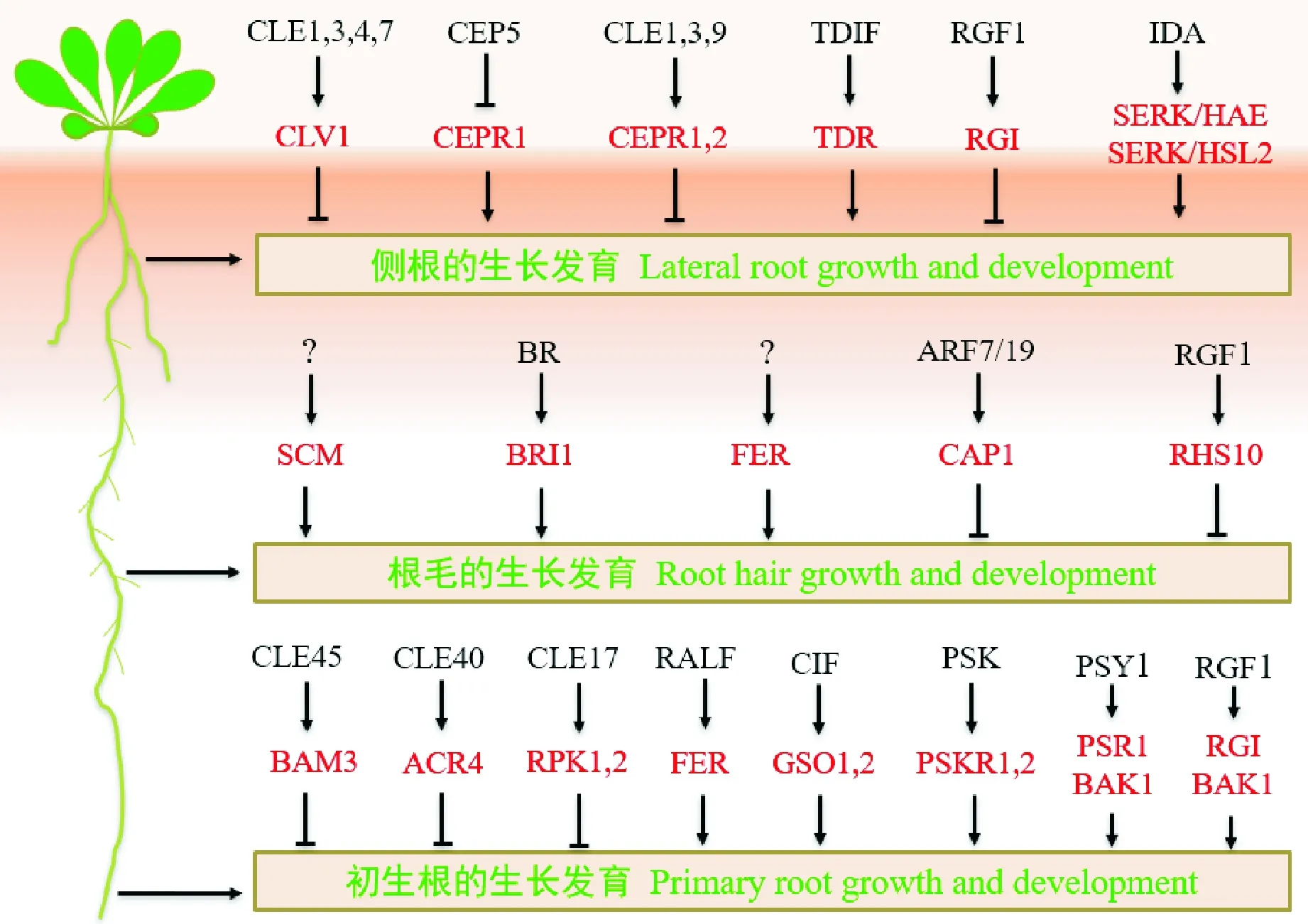
类受体激酶及其配体参与侧根、根毛和初生根的生长发育。图中类受体激酶以红色字体表示,其配体以黑色字体表示。 以类受体激酶及其配体对的形式描绘细胞信号传导途径以 及它们协调侧根、根毛和初生根发育的各个方面。 类受体激酶和配体名称的缩写在文中给出图3 RLKs调控根生长发育的多种功能 RLKs and their ligands involve in the growth and development of lateral roots, root hairs and primary roots. RLKs and their ligands are depicted in red and black, respectively. ThisFigure shows signaling pathways of the RLKs and their ligands pairs that coordinate the growth and development of lateral roots, root hairs and primary roots. Abbreviations of names RLKs and their ligands are given in the textFig.3 Multiple functions of RLKs in root growth and development
前面提到的类受体激酶PSKR1和PSKR2作为PSK肽的受体对于初生根生长非常重要。然而,外源性PSK处理也会促进侧根的形成和侧根伸长,此过程不依赖PSKR1,表明PSK可能与其他受体相互作用来调节侧根的生长[88](图3)。
4.3 参与根毛的发育调控
拟南芥根表皮细胞进入分化区后会发育成2种不同的细胞类型。 只有位于2个皮层细胞交界处上方的表皮细胞可以分化形成根毛,称作生毛细胞;而那些只与一个皮层细胞接触的表皮细胞通常不会发展成根毛,称为非生毛细胞[89]。 在非生毛细胞中,GL3(glabra3)、EGL3 (enhancer of glabra3)、WER (werewolf) 和TTG (transparent testa glabra)形成转录复合物WER-GL3/EGL3-TTG,该复合物正调控转录因子GL2 (glabra2)的表达[90-93]。GL2可通过磷脂信号途径负调控根毛的发育[94]。在生毛细胞中,GL2抑制RHD6(roh hair defective6)的表达,而RHD6是一种正调控根毛发育的转录因子[95-96]。CPC (caprice)与WER竞争性结合GL3/EGL3-TTG复合物,形成的CPC-GL3/EGL3-TTG转录复合物不能促进GL2的表达,消除了GL2对RHD6的抑制作用从而决定该细胞发育成生毛细胞[97-99]。根表皮中的凸起先缓慢生长,然后进入一个快速的尖端生长过程,最终产生根毛。Ca2+和ROS是维持极化细胞生长的2个主要因素[89,100-101]。ROS可激活Ca2+流入通道并瞬时升高细胞质Ca2+浓度,促进根毛中Ca2+梯度的建立[101]。升高的Ca2+水平反过来激活NADPH氧化酶RHD2(root hair defective 2)引发ROS的产生,这样的正反馈回路确保了正常根毛尖生长[102]。
类受体激酶SCM (scrambled)也称为SUB(strubbelig),其细胞外结构域中具有6个LRR,属于LRR-RLK V亚家族[103]。SCM是第一个被鉴定到与拟南芥根表皮细胞命运决定有关的RLK[103]。scm突变体根表皮中细胞型紊乱,其很多非生毛细胞可发育成根毛细胞,而生毛细胞却不能发展成根毛[103]。在scm突变体中,GL2、CPC、WER和EGL3都表现出一种紊乱的表达模式,这表明SCM可能通过某个未知信号调节这些基因的表达模式[103]。目前还不清楚到底是什么信号物质在此过程中起作用,进一步研究该类受体激酶可能有助于探析皮层细胞与表皮细胞之间的信号传递过程。
在BR相关突变体中大部分生毛细胞不能发育成根毛;相反,BRI1过表达或BR信号转导中的下游负调节因子BIN2的缺失突变增强BR信号后会形成许多根毛[104]。这些结果表明,BRI1通过介导BR信号转导调控根表皮细胞的命运。
类受体激酶基因FER的突变导致严重的根毛缺陷[105]。fer突变体中的活性RHO GTP酶(active rho gtpase proteins,RAC / ROPs)蛋白水平降低导致ROS水平较低,因为RAC / ROP蛋白可以在根毛伸长期间激活RHD2介导的ROS产生,如ROP2(RHO-related protein from plants 2)[105-106]且ROP2的过表达可以抵消fer突变体的根毛缺陷,这些结果表明FER作用于RAC / ROPs的上游,以控制根毛尖生长期间RHD2依赖性的ROS产生[105]。最近一项研究报道,FER还参与调控根细胞扩增速度和向地性响应[107]。MRI(maris)是一种RLCK[108], 其突变体mri根毛变短,表型类似于fer。 MRIR240C是MRI激酶活性增强的一种形式,MRIR240C的过表达可以部分拯救fer的根毛缺陷表型,表明MRI在根毛生长期间在FER信号转导的下游起作用[108]。
CAP1([Ca2+] cyt-associated protein kinase 1)是一种参与根毛尖生长的CrRLK1L家族蛋白,CAP1也被称为ERU(erulus,以FER的儿子Erulus命名)[67]。CAP1/ERU是一种生长素诱导的拟南芥类受体激酶,其表达直接受ARF7和ARF19转录因子调控,CAP1/ERU通过负调控果胶甲酯酶的活性来调节根毛生长期间细胞壁组成和果胶动力学[109]。与野生型相比,cap1/eru突变体根毛更少更短[110]。研究发现, CAP1/ERU可以感知细胞质NH4+水平并将它们分隔在液泡中,从而确保细胞质中正常的NH4+浓度。CAP1/ERU的突变引起细胞质中NH4+过量积累,从而影响Ca2+梯度,最终导致根毛生长缺陷[110]。
类受体激酶RHS10(root hair specific 10)是一个编码富含脯氨酸序列的PERK-like亚家族成员[111]。与野生型相比,RHS10的突变导致根毛尖端的生长过程延长,RHS10过表达抑制根毛中ROS水平,rhs10突变体根毛中ROS水平增加[111]。即RHS10抑制根中ROS的积累,而ROS是根毛生长所必需的。酵母双杂交筛选鉴定出RNA酶RNS2(ribonuclease2)是RHS10的下游靶标,即RHS10过表达通过RNA酶RNS2降低了根毛生长区的RNA水平[111]。这些研究结果表明,RHS10是通过调节RNA分解代谢和ROS积累以维持适当的根毛长度(图3)。
5 展 望
植物根在生长发育过程中受到大量的外部刺激和内源性发育信号的影响,植物必须整合这些信号并转化为细胞反应,才能适应不断变化的环境条件。RLKs作为细胞膜上的信息监测者,通过检测外源和内源信号调控根的生长发育。
除了根的生长发育,在其他发育过程、非生物胁迫、防御反应等生理过程中都有很多RLKs的参与。植物的信号调控网络非常复杂,一种RLK可能参与调控很多不同的生理过程,如前面提到的类受体激酶BAK1同时参与调控油菜素内酯信号转导、细胞死亡、糖信号响应和先天免疫等[72,112-114]。在根的生长发育过程中,BAK1 可与RGFR作为RGF肽的受体通过PLT转录因子调控根的初级分生组织活性[59-60],又可与PSKR1相互作用形成异源二聚体响应PSK肽进而调控初生根的生长[63-64],也可通过BR非依赖性途径控制根的生长[73]。这也为RLKs的研究增加了难度和挑战。除此之外,许多RLKs可以催化丝氨酸残基和苏氨酸残基的磷酸化,也可以催化酪氨酸残基的磷酸化[23,25,31-32],RLKs多个位点的磷酸化如何精细调控不同的信号转导过程也有待进一步研究。
近年来,虽然有越来越多的RLKs被分离鉴定参与调控根的生长发育。但在根的发育过程中,还有很多科学问题值得我们思考。如前面提到的CLE45
在根的初生韧皮部中表达,可以通过与类受体激酶BAM3的相互作用抑制初生韧皮部的分化[54]。但不能排除是否有其他CLE成员作为BAM3的配体参与韧皮部的发育过程?比如与CLE45十分相似的CLE25和CLE26。用各种合成CLE肽处理拟南芥的根,发现CLE26对根生长的抑制作用最强[115],生长素处理可以促进CLE26的表达且CLE26会降低生长素运转蛋白PIN1(pin-formed 1)的丰度而不影响其转录水平,表明CLE26与蛋白水平上的生长素信号途径相关[116]。值得思考的是,CLE26是如何传递信号到PIN1以及是否有类受体激酶作为CLE26的受体在生长素信号途径中发挥作用进而调控根的生长?前文提到CAP1/ERU通过改变细胞质中NH4+浓度影响Ca2+梯度进而影响根毛的生长[110]。另一篇研究报道,CAP1/ERU也会影响到根毛中ROS的正常水平和分布[117]。但其具体作用机制仍不清楚,猜想CAP1/ERU是否是通过NH4+的过量积累影响Ca2+梯度后,变化后的Ca2+梯度再通过激活RHD2改变ROS的水平和分布?除此之外,是否有其他更多的类受体激酶参与调控根的生长发育过程?这些都是有待进一步研究的科学问题。
要揭示一个RLK完整的信号转导网络,需结合遗传学、组学、生物化学和细胞学等手段以鉴定其胞外配体、共受体和底物蛋白。已有的大量T-DNA插入和转座子标记等拟南芥突变体材料有助于RLKs的功能研究。然而,在很多情况下,单个基因的突变并不能观察到明显的表型。可能原因之一是基因组中存在功能冗余的其他基因,另一个原因是有些受体只在特定的条件下才能感知信号或刺激。鉴于RLKs家族成员多以及亚家族成员之间具有相似性,有相当数量的RLKs具有重叠或冗余功能。因此,在研究过程中可能需要构建双重或多重缺失突变体或过表达植株才能观察到明显的表型。植物信号转导一直是一个非常令人兴奋的研究领域,研究RLKs的功能及其相互作用网络将有助于我们进一步认识植物的生长发育过程。
