分离植物甘油酯的薄层层析色谱法的优化
2018-02-13陈亚东薛金嫚
陈亚东, 薛金嫚, 徐 婷, 刘 华, 雷 洁, 甘 毅
(1.浙江农林大学农业与食品科学学院,浙江临安 311300;2.浙江农林大学林业与生物技术学院,浙江临安 311300;3.南京农业大学农学院,江苏南京 210095)
脂类(lipids)是生物细胞膜的主要组成成分,在植物光合作用、细胞信号传导、逆境胁迫等生命活动中扮演着极其重要的角色[1-5]。从极性上分,脂类可分为极性脂和中性脂,前者包括单半乳糖二酰甘油(mono galactosyl diacyl glycerol,简称MGDG)、双半乳糖二酰甘油(di galactosyl diacyl glycerol,简称DGDG)、硫脂-硫代异鼠李糖二酰甘油(sulfo quinovosyl diacyl glycerol,简称SQDG)、磷脂酰甘油(phosphatidyl glycerol,简称PG)、磷脂酰胆碱(phosphatidyl choline,简称PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,简称PE)、磷脂酰肌醇(phosphatidy linositol,简称PI)、磷脂酸(phosphatidic acid,简称PA)等,后者包括三酰基甘油(triacyl glycerol,简称TAG)、二酰基甘油(diacylglycerol,简称DAG)等。
长期以来,将各种甘油酯进行有效分离,是深入进行植物脂类代谢研究的前提条件。到目前为止,分离植物甘油酯的方法主要有薄层层析色谱分析(TLC)、柱层析色谱法、高效液相色谱(HPLC)等。TLC是一种快速、准确分离脂质的重要方法,它通过不同极性的脂类在固定相和展开相中的相对移动速率差异将脂质进行分离并显色,从而进行脂质含量和组分的测定。由于TLC方法具有快速、直观、操作简便和廉价的优点,所以在脂类代谢领域应用最为广泛,并且该种方法也广泛应用于检测酶的活性[6-8]。但是,TLC分离脂质的效果易受到外界环境条件的影响,如气温、湿度等。目前,常见的TLC分离分为单向和双向2类。单向分离溶剂系统常采用正己烷 ∶乙醚 ∶乙酸(体积比70 ∶30 ∶1)作为展开相,用于分离植物三酰基甘油(TAG)和极性脂[9]。也有一些研究采用丙酮 ∶甲苯 ∶水(体积比91 ∶30 ∶8)作为展开相,分离植物样本中的糖脂和磷脂[10]。由于单向TLC不能很好地分离出PC、PE、PI、PS等磷脂组分,所以双向TLC应运而生。双向TLC是将点样后的硅胶板先进行一个方向的层析展开,然后将层析板顺时针旋转90°,进行第2个方向的层析。结束后显色刮板,刮取不同的脂质组分斑块,进行后续的分析。在相关文献中,双向TLC常采取三氯甲烷 ∶甲醇 ∶水(体积比65 ∶25 ∶4)进行第一相展开,然后再使用三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5)进行第二相分离展开[11]。上述溶剂系统在脂类研究中非常常见,适用于大多数植物种子样本的脂质分离。但是,笔者在使用上述溶剂系统分离拟南芥幼苗、烟草叶片等甘油酯含量很低的样本时却发现,该方法在单向和双向TLC试验中,均无法得到良好的脂类分离效果,各种脂质斑块聚集在一起,不能很好进行区分。为了解决上述问题,笔者尝试用新的溶剂系统来优化双向TLC,开发了以三氯甲烷 ∶甲醇 ∶氨水(体积比 65 ∶35 ∶5)和三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5)作为第一和第二展开相的双向TLC分离方法。该方法可以有效地分离油脂含量较低的植物样本中的糖脂和磷脂,为研究植物膜脂代谢提供了一种简便有效的工具。
1 材料与方法
1.1 仪器与试剂
Agilent 7080B型气相色谱仪,美国,配置FID检测器;DB-23色谱柱,TLC Silica G 60型硅胶板,1.05721.0001,默克集团,德国;37种脂肪酸甲酯标准品,FAMQ005,AccuStandard,美国;磷脂酰甘油(PG)标准品,841188P,Avanti,美国;磷脂酰乙醇胺(PE)标准品,P8193,Sigma,美国;磷脂酰胆碱(PC)标准品,P7443,Sigma,美国;磷脂酰丝氨酸(PS)标准品,P0474,Sigma,美国;磷脂酸(PA)标准品,830856p,Avanti,美国;磷脂酰肌醇(PI)标准品,P0639,Sigma,美国;心磷脂(cardiolipin,CL),C0563,Sigma,美国;振荡仪(VORTEX-GENIE 2);大型低温离心机,eppendorf 5810R;冰箱,三洋化学试剂有限公司;氮吹仪,米欧仪器;数显恒温金属浴,米欧仪器;正己烷,百灵威;甲醇,百灵威;三氯甲烷,西陇科学;丙酮,高晶化工;甲酸,生工生物工程(上海)股份有限公司;28%氨水,国药集团;浓硫酸,西陇化工股份有限公司;冰乙酸,上海凌峰化学试剂有限公司;2,6-二叔丁基-4-甲基苯酚,BHT。
1.2 样本总脂的提取
2017年5月,在浙江农林大学平山温室,以播种后15 d的拟南芥植株(哥伦比亚生态型)幼苗和完全成熟的烟草(K326品系)叶片为材料,称取0.5 g样品鲜质量,在液氮中磨成粉末,加入6 mL提取液(三氯甲烷 ∶甲醇 ∶甲酸,体积比10 ∶10 ∶1),振荡混匀,置于-20 ℃过夜。以3000g转速离心10 min,吸取上清液,转移到12 mL玻璃管中。在沉淀中,加入三氯甲烷 ∶甲醇 ∶水(体积比5 ∶5 ∶1),振荡混匀,3 000g离心10 min,吸取上清,合并到第1步的上清中。在合并的上清中,加入3 mL H3PO4(0.2 mol/L)和KCl(1 mol/L)混合液,振荡混匀,3 000g离心10 min,吸取下层三氯甲烷相,氮吹浓缩至500 mL体积。将三氯甲烷转移到2mL安捷伦进样瓶中,-20 ℃保存备用,此样本为总脂提取物,可以用于分离中性脂和极性脂。
1.3 单向薄层层析分析
1.3.1 中性脂的分离 配制溶剂相正己烷 ∶乙醚 ∶乙酸(体积比70 ∶30 ∶1),置于层析缸中,使缸中蒸气压达到充分饱和。在120 ℃烘烤处理2 h的层析硅胶板上,用铅笔在距离底边2 cm处轻划横线,每2 cm做1个标记,用于点样。然后,待硅胶板降至室温,用毛细玻璃管吸取50 mg样品进行点样,同时加入4 μg的橄榄油作为参照,进行层析展开。当展开相液面距离玻璃板上沿1 cm时,结束层析,采用碘蒸汽或者樱草黄对硅胶板上的脂类斑块进行染色。
1.3.2 分离糖脂和磷脂 用0.15 mol/L硫酸铵浸泡硅胶板30 s,在空气中放置2 d之后,120 ℃活化2 h。配制展开相溶剂系统(丙酮 ∶甲苯 ∶水,体积比91 ∶30 ∶8),在层析缸中充分饱和1 h。在硫酸铵处理的硅胶板上,距离底边2 cm处,分别添加150、125、100、75、50、25 mg的样品,各样品间距2 cm,在另一块相同的硅胶板上分别加入10 μg的各种磷脂标准品。将加样后的硅胶板轻轻放置到层析缸中,盖紧上盖,进行层析,待溶剂线到达距离硅胶板顶端1 cm处,取出硅胶板,在通风橱中自然风干,均匀喷施0.5 mg/mL樱草黄溶液,在紫外灯下观察各个脂类成分形成的斑块。
1.4 双向薄层层析分析
在经过活化的硅胶板上,用铅笔标记点样位置,在距离底边和左侧边2 cm处,用玻璃毛细管分别吸取75 mg样品,均匀轻柔地点在3块相同处理的硅胶板上,进行双向TLC分离。首先将硅胶板垂直插入第一向层析缸中,展开溶剂为三氯甲烷 ∶甲醇 ∶氨水(体积比65 ∶35 ∶5)或者三氯甲烷 ∶甲醇 ∶水(体积比65 ∶25 ∶4),当溶剂线到达顶部,取出硅胶板,在通风橱中,将残留的溶剂充分挥发。然后将硅胶板顺时针旋转90°,迅速插入第二向层析缸中,第二向溶剂系统为三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5)。当溶剂线到达顶部时,取出硅胶板,在通风橱中,将残留的溶剂充分挥发。最后,在晾干的硅胶板上喷施樱草黄溶液,在紫外灯下进行观察、拍照。
1.5 脂类的甲酯化和气相色谱分析
在硅胶板上,用铅笔标记分离后的各个脂质组分,用刀片刮下,倒入12 mL玻璃瓶中。加入2 mL甲醇(含有1%硫酸和0.01% BHT)和7.5μg C17:0TAG内标,80 ℃加热反应2 h,在冰上冷却1 min,加入2 mL的0.9%NaCl溶液和2 mL正己烷,振荡萃取,3 000g离心10 min,吸取上层正己烷上清液,转移到玻璃管中(注意不要吸入下层水相)。将正己烷浓缩至20 μL,置于安捷伦2 mL进样瓶中,在7890B型气相色谱(DB23色谱柱、FID检测器)上进行GC分析,具体分析参数设置如下:载气为氦气,进样口温度260 ℃,分流比为20 ∶1,柱温箱起始温度为160 ℃,以20 ℃/min的速度升温至 240 ℃,保持5 min,FID检测器的氢空比设置为1 ∶10。
2 结果与分析
2.1 经典溶剂系统对低油组织样本中的极性脂分离效果
以往的脂类研究常以正己烷 ∶乙醚 ∶乙酸(体积比 70 ∶30 ∶1,溶剂系统A)作为单向TLC的展开相,此溶剂系统具有稳定、重复性好等优点,不仅广泛应用于动物以及微生物,而且也应用于植物样本的中性脂和极性脂分离。本研究使用了该溶剂系统对烟草叶片等油脂含量极低的营养组织样本进行了层析分离。从图1可以看出,通过碘蒸汽染色或喷施樱草黄,紫外线照射成像,使用正己烷 ∶乙醚 ∶乙酸(体积比70 ∶30 ∶1)作为展开相,很好地分离开了样本中的中性脂和极性脂,从硅胶板上沿到点样原点,依次为固醇脂(sterol ester)、三酰基甘油(TAG)、二酰基甘油(DAG)等中性脂,而极性脂(MGDG、DGDG、PC、PG、PE、PI、PA、PS等)则聚集在点样原点周围,此外,一些含量相对较少的物质,如游离脂肪酸等,也被分离出来。由于烟草叶片中的中性脂(主要是TAG)含量极低,样本叶龄对分离效果影响很大,生长后期,衰老的叶片样本(如4~6周龄的成年拟南芥)脂质组分可以被上述方法分开,而幼嫩叶片中中性脂含量极低,上述系统不能很好区分。
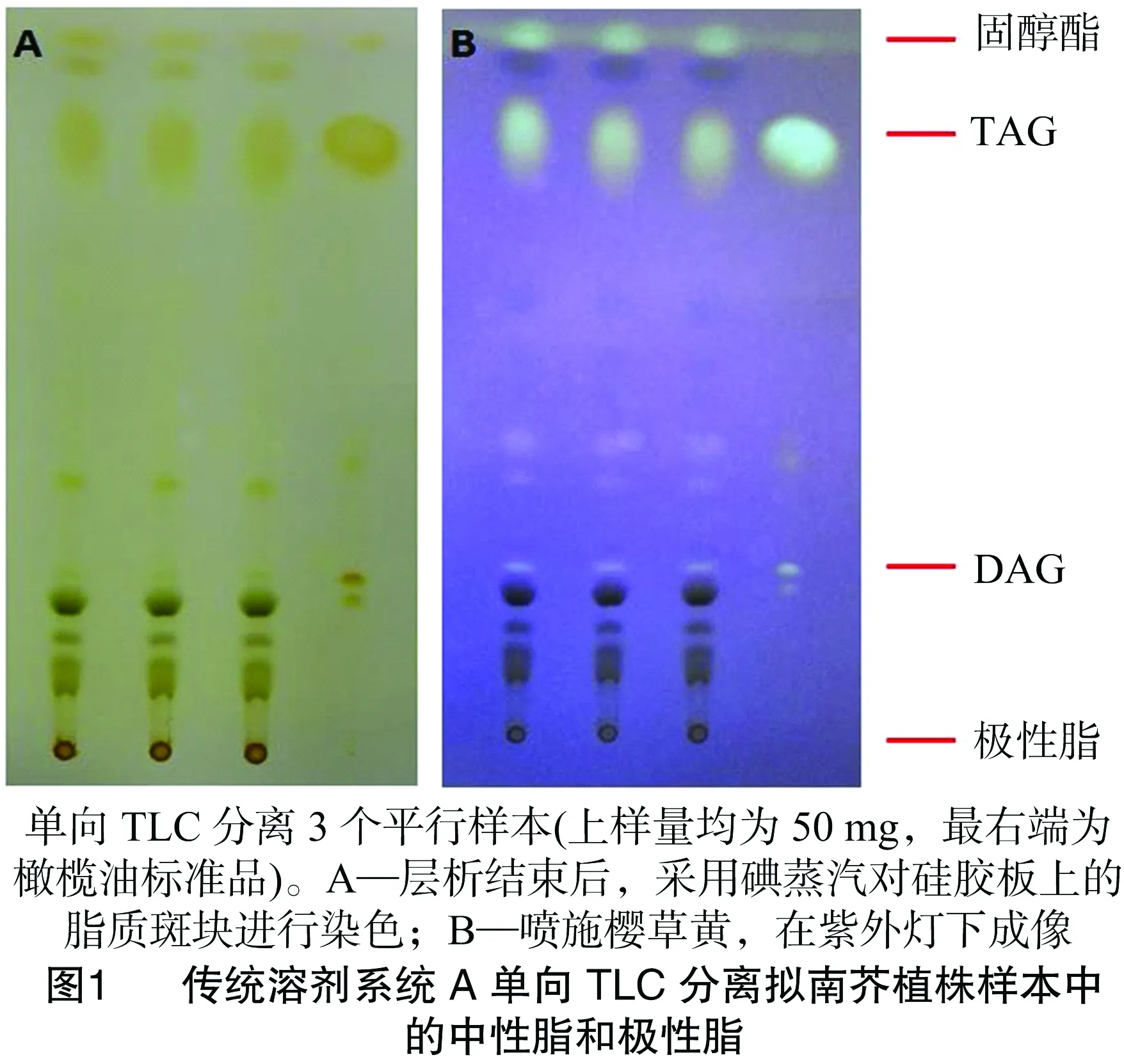
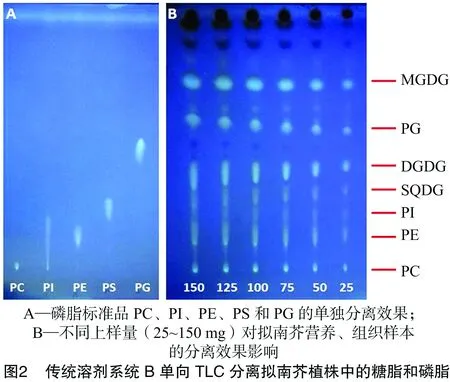
在叶片等植物营养组织中含有大量的半乳糖脂,如MGDG、DGDG等,为了将磷脂、中性甘油酯与糖脂进行分离,又采用了另1种已报道的溶剂系统[10],即丙酮 ∶甲苯 ∶水(体积比91 ∶30 ∶8,溶剂系统B),对标准品和样品进行了单向TLC分离。如图2所示,该系统对糖脂的分离效果较好,能够清晰地区分各种糖脂的条带,但是由于磷脂PI和PE的极性较为接近,二者分离效果不好。同时,发现该溶剂系统易受上样量的影响,当上样量超过75 mg时,各个组分之间容易产生交叉污染。后续的气相色谱分析也表明,该系统对MGDG的分离效果较好,但是对其他甘油酯的分离效果并不理想。
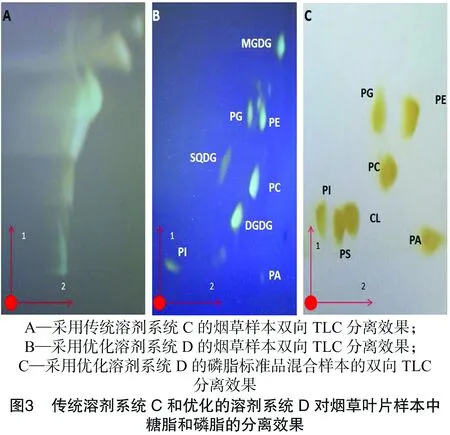
尽管单向TLC具有简便、省时的优点,但其不易分离极性脂,因此,一般研究者会使用双向TLC对植物样本进行分离。本研究也按Benning等的方法[11-12],用双向TLC[第一向展开溶剂为三氯甲烷 ∶甲醇 ∶水(体积比 65 ∶25 ∶4),第二向展开溶剂为三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5,溶剂系统C]对组织样本中的糖脂和磷脂进行分离,从图3-A可以看出,TLC分离存在着比较严重的拖带现象,因此该溶剂系统在现有条件下无法得到良好的分离效果。
原因可能是市面上常见的G60硅胶板,由于G硅胶呈弱酸性,所以适用于酸性和中性物质的分离,但是碱性物质能与酸性硅胶作用,展开时易出现成点不清晰或者拖尾现象[13-14]。在层析过程中,样本的碱性物质在溶剂系统中部分解离,带有负电荷的物质会与酸性硅胶氢离子发生结合,才造成了拖尾或重叠的现象,笔者发现这种现象在样本油脂含量较低时会比较明显。
2.2 优化后的溶剂系统可以有效分离低油组织样本中的糖脂和磷脂
为了解决低油样本TLC分离中的拖带现象,笔者对双向TLC溶剂系统进行了优化,采用了第一向三氯甲烷 ∶甲醇 ∶氨水(体积比65 ∶35 ∶5)和第二向三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5)溶剂系统D进行分离。首先,为了确定各个磷脂组分在双向TLC分离后的相对位置,笔者使用了7个脂类标准品(PC、PE、PI、PS、PG、PA、CL)的混合样本来测试优化后的溶剂系统。从图3-C可以看出,除了PS、CL,该溶剂系统有效地分离出了PG、PE、PC、PI和PA,各种脂类标准品在硅胶板上都形成了轮廓清晰的斑块。由于植物叶片中PS和CL含量十分稀少,所以该方法可用于分离植物叶片样本中的甘油酯。由于一些磷脂组分在层析时会发生电离,如PG、PI等磷脂呈酸性,而PC、PE带有—NH3+和—N—,呈碱性,所以在优化方案中,笔者在第一向溶剂系统中加入了一定比例的氨水,是为了用铵根离子去中和硅胶板上的氢离子,减少由于电荷吸引而造成的拖尾,使得斑块清晰[15-17]。用该方法对拟南芥样本的脂类分离(图3-B)显示,各个甘油酯成分轮廓清晰锐利,不存在交叉污染,虽然在PE周围存在几种其他的脂类,在分辨时存在干扰,但是因为植物叶片中PE的含量高,该点大且亮,所以仍然可以对PE进行区分。
在植物中除了甘油磷脂,还存在较多的半乳糖脂,半乳糖脂中不饱和脂肪酸的含量明显高于磷脂,同时含有特定的脂肪酸组分,如在MGDG中存在较高含量的C16:3,PG中含有反式棕榈烯酸,DGDG与其他甘油酯脂肪酸组分相比亚麻酸的含量最高,SQDG组分中棕榈酸所占百分比最高,所以根据这些特点,也可以对各个糖脂以及磷脂进行区分。本研究用气相色谱分析了经过分离后的拟南芥叶片中的各种极性脂类的脂肪酸组成,并与已报道的拟南芥糖脂和磷脂脂肪酸组分进行了对比[12]。从表1可以看出,各个成分的脂肪酸组分基本与其一致,但是在DGDG中C18:3含量低于已报道的文献,这可能是因为拟南芥所在的环境条件影响到了膜脂脂肪酸的组成。
3 讨论与结论
本研究还发现一些其他因素也会对脂质分离效果产生较大的影响:(1)环境温度。当试验环境温度在25~30 ℃,该系统会达到良好的分离效果。这是因为环境温度可能会影响到层析缸内的饱和蒸汽压状况,进而影响到脂类分离的效果。(2)层析缸质量。值得说明的是,从少量植物样本中提取的糖脂以及磷脂含量比较少,如果试验过程中混入其他脂溶性杂质或脂质,就会引起较大的误差。目前,市场上的层析缸多

表1 经过优化方法分离的样本的脂类成分气相色谱分析
采用多块玻璃粘制而成,不能排除一些黏合剂成分,可能会溶解于有机溶剂中,对硅胶板产生污染。因此,使用一体成型款式的层析缸,可以避免上述可能的污染。(3)硅胶板质量。硅胶颗粒的大小和涂板的均匀程度,会影响到微量样本的层析分离,本试验采用默克G-60硅胶板进行微量脂类成分的分离,其硅胶粉末直径较小,涂板较为均匀,适用于微量样本的层析分离。(4)上样量的选择。在上样量方面,50~100 mg样本即可达到较好的分离效果,超过这个范围会存在不同程度的拖带现象,而过少则会使GC检测出的峰值过小,引起较大误差。而上样时点样的形状也会影响分离效果,本研究使用玻璃毛细管进行点样,点样形状接近圆形,控制其直径小于5 mm,否则易造成拖带现象。(5)样本的抗氧化处理。在糖脂中存在大量不饱和脂肪酸,在进行甲酯化过程中,易被氧化,造成不饱和脂肪酸含量低的表象,所以甲酯化过程须要添加抗氧化剂,如BHT等。
综上所述,本研究提供了1种用于分离植物脂质的双向TLC方法,分别采用三氯甲烷 ∶甲醇 ∶氨水(体积比65 ∶35 ∶5)和三氯甲烷 ∶丙酮 ∶甲醇 ∶乙酸 ∶水(体积比50 ∶20 ∶10 ∶10 ∶5)作为层析展开相,该方法可以有效分离微量组织样本中的磷脂和糖脂,为广大研究植物脂质代谢的研究人员提供一种简便有效的工具。
