骆驼天然单域重链抗体库的构建与鉴定
2018-02-10周景明翟圆君祁艳华刘红亮王爱萍
周景明,翟圆君,耿 玥,祁艳华,刘红亮,王爱萍
(郑州大学生命科学学院,河南郑州 450001)
1993年,Hamers-Casterman C等发现骆驼免疫系统内存在一种仅由重链单一的折叠单元组成的抗体,将其称为单域重链抗体(variable domain of heavy-chain of heavy-chain antibody,VHH)或纳米抗体(nanobody,Nbs)[1]。纳米抗体仅由重链抗体的可变区组成,较普通抗体具有一些独特性能[2],如分子量小、稳定性高、亲和力高[3]、免疫原性弱、良好而广泛的抗原结合能力[4]以及水溶性好等特点[5],使其在病原的检测、食品安全分析[6]等领域被广泛应用。
本研究采用未经免疫的骆驼淋巴细胞为起始试验材料,扩增全套单域抗体基因,构建骆驼非免疫噬菌体抗体库,鉴定抗体库的库容量及多样性。莱克多巴胺(ractopamine,RAC)是“瘦肉精”的一种,在猪等动物体内残留的莱克多巴胺,累积超过一定量时,对动物本身产生毒副反应,也可通过食物链进入人体,因此对其检测具有重要意义[7]。利用莱克多巴胺人工抗原,对骆驼天然单域抗体噬菌体展示文库进行筛选,结果显示文库多样性良好,为淘选获得针对特定抗原的单域重链抗体奠定了基础。
1 材料与方法
1.1 材料
1.1.1 试剂 淋巴细胞分离液,天津灏洋有限公司产品;RNA提取试剂Trizol、RT-PCR试剂盒、EX-TaqDNA聚合酶、DNA试剂盒,TaKaRa公司产品;限制性内切酶、T4连接酶,New England Biolab公司产品;PCR产物纯化试剂盒,Tiangen公司产品;Anti Phage M13 MAb(HRP),Solarbio公司产品;其他化学试剂均为国产分析纯。
1.1.2 菌株及噬菌粒 大肠埃希菌TG1,郑州大学分子免疫实验室保存;辅助噬菌体M13KO7,购自New England Biolab公司;噬菌粒载体pCANTAB5E,购自Bio Vector质粒载体菌种细胞基因保藏中心。
1.1.3 引物 文库构建及鉴定所用的引物参照文献[8-9]设计(表1)。VHH-SfiⅠ位于可变区的框架区1 (framework region 1,FR1),并在其5′ 端引入了SfiⅠ酶切位点及保护碱基,VHH1-NotⅠ和VHH2-NotⅠ分别位于两种重链抗体的铰链区(hinge region),在5′端引入了NotⅠ酶切位点及保护碱基(下划线表示限制性内切酶识别序列)。
1.2 方法
1.2.1 莱克多巴胺人工抗原的制备与鉴定 采用1,4-丁二醚法(Linker 法)制备RAC-OVA人工抗原,利用混合酸酐法制备 RAC人工抗原RAC-BSA,采用紫外光谱扫描和SDS-PAGE凝胶电泳鉴定人工抗原是否偶联成功。

表1 文库构建及鉴定所用的引物
1.2.2 外周血淋巴细胞的分离和总RNA的提取 取骆驼外周血,以109 mmol/L柠檬酸钠抗凝。采用密度梯度离心法分离外周血单个核细胞,计数细胞,按每107细胞溶于1 mL的Trizol试剂中,参照Trizol试剂使用说明抽提总RNA。提取后的总RNA用去离子水溶解,测定浓度,并于-80℃保存备用。
1.2.3 骆驼重链抗体可变区的扩增 以总RNA为模版,Oligo(dT)18为引物,按照反转录试剂盒说明书,合成第一链cDNA。参照表1合成PCR引物,以cDNA为模版,PCR扩增重链抗体的可变区片段VHH。反应程序为:95℃预变性5 min;95℃ 35 s, 63℃ 35 s, 72℃ 35 s,共32个循环;72℃延伸7 min。反应产物经10 g/L的琼脂糖凝胶电泳验证后,经DNA片段回收试剂盒回收定量,置-20℃保存备用。
1.2.4 噬菌体单域抗体库的构建 将噬菌粒载体pCANTAB5E和PCR扩增产物VHH分别用NotⅠ和SfiⅠ进行酶切反应。用DNA回收试剂盒回收酶切片段,与酶切后的pCANTAB5E载体在T4DNA连接酶的作用下进行连接。连接产物电转化入新鲜制备的感受态大肠埃希菌TG1,转化后的菌液于LB液体培养基中在37℃、220 r/min培养1 h。将转化菌液浓缩后,涂若干块平板培养基(含20 g/L葡萄糖和Amp的2×YT培养板),同时取10 μL倍比稀释计算库容,37℃培养过夜。次日,计算菌落形成单位(CFU),即为噬菌体抗体库的滴度,并从平板上随机挑选20个单菌落,进行PCR鉴定,以确定抗体库的重组率。挑取8个单克隆,送生物技术服务公司测序。剩余菌液加入适量的2×YT/Amp液体培养基和M13K07,37℃过夜培养。次日,用200 mL/L的PEG8000/NaCl从菌液上清中分离噬菌体,并悬浮于PBS中。
1.2.5 RAC特异性重组噬菌体的淘选 富集筛选重组噬菌体的方法具体如下:用NaHCO3缓冲液稀释RAC-BSA,使其终浓度为100 μg/mL,100 μL/孔包被于酶标板中,4℃过夜。次日,弃掉板中包被液,用TBST洗涤4次,加入封阻缓冲液,200 μL/孔,37℃封闭2 h。倒掉封闭液,用TBST(TBS+1 mL/L Tween-20),快速洗涤10次。然后在干净的纸巾上甩拍,以除去洗涤液,加入噬菌体,100 μL/孔,37℃孵育1 h。弃去未结合的噬菌体,用TBST洗涤10次,再用TBS洗5次。加入缓冲洗脱液,100 μL/孔,把结合的噬菌体洗脱到洗脱液中,温和摇动8 min。把洗脱液转移到微量离心管中,加入100 μL中和缓冲液,使洗脱液为中性。取中和后的洗脱液少许测定滴度,其余用于扩增。取400 μL洗脱液,感染4 mL对数期TG1细胞,摇匀后37℃静置30 min,加入16 mL的2×YT/AMP-GLU培养,37℃、220 r/min培养至对数期。向培养液中加入20 μL的M13KO7辅助噬菌体,摇匀后室温静置30 min,2 800 r/min室温离心10 min,弃上清,菌体用100 μL 2×YT/AMP-KANA培养基重悬,37℃、220 r/min培养14 h。用PEG8000/NaCl溶液对其进行浓缩纯化,每管加入0.5 mL PBS,重悬噬菌体沉淀。
重复步骤,完成第2轮和第3轮淘选。RAC-BSA包被原浓度依次降低,分别为100、50、25 μg/mL。洗涤液中的Tween20的含量依次升高,分别为1、3、5 mL/L。
1.2.6 阳性克隆的phage-ELISA鉴定 从第3轮筛选中大平皿上挑取单菌落于96孔板中,分别进行扩增纯化,取每轮筛选后扩增的噬菌体库,用phage-ELISA检测特异性重组噬菌体,步骤如下:将RAC-OVA用PBS缓冲液稀释至10 μg/mL,取96孔酶标板,每孔加入100 μL,4℃包被过夜。用PBST洗涤酶标板4次,加入封闭液,每孔加入200 μL,室温封闭2 h。用PBST洗涤酶标板4次,取浓缩纯化的噬菌体溶液,用封闭液稀释后加入酶标板中,每孔100 μL,室温孵育2 h。用PBST洗涤酶标板4次,加入稀释好的鼠抗M13噬菌体单抗(以50 g/L的脱脂奶1∶5 000稀释),每孔100 μL,室温孵育2 h。用PBST洗涤酶标板4次,加入TMB显色底物,每孔加入100 μL,室温避光显色5 min左右。显色完成后,每孔加入100 μL 3 mol/L硫酸终止反应,用分光光度计测定各孔OD 450 nm值。
1.2.7 重组纳米抗体的诱导表达及粗提物的获取 取筛选得到的阳性噬菌体扩增纯化后,加入含有1 mmol/L IPTG,37℃、200 r/min诱导过夜。取培养液,3 200 r/min 4℃离心10 min,弃上清,放入-20℃冰箱,冷冻30 min。取出,室温放置15 min,每孔加入500 μL PBS,250 r/min振荡30 min重悬菌体。3 500 r/min 4℃离心15 min,收集上清即为可溶性重组纳米抗体粗提物,用于下一步ELISA检测。
1.2.8 可溶性重组纳米抗体的 ELISA检测 ELISA检测可溶性重组纳米抗体粗提物的步骤如下:将RAC-OVA用PBS缓冲液稀释至4 μg/mL,取96孔酶标板,每孔加入100 μL,4℃包被过夜,PBS作为无抗原对照。用PBST洗涤酶标板4次,每孔加入200 μL封闭液,室温封闭2 h。用PBST洗涤酶标板4次,取可溶性重组纳米抗体粗提物,用封闭液稀释后加入酶标板中,每孔100 μL,室温孵育2 h。用PBST洗涤酶标板4次,加入稀释好的兔抗E-tag 多克隆抗体(以50 g/L的脱脂奶1∶2 000稀释),每孔100 μL,室温孵育2 h。用PBST洗涤酶标板4次,加入稀释好的二抗(HRP标记的羊抗兔IgG)。用PBST洗涤酶标板4次,加入TMB显色底物,每孔加入100 μL,室温避光显色5 min左右。显色完成后,每孔加入100 μL 3 mol/L硫酸终止反应,用分光光度计测定各孔OD 450 nm值。
2 结果
2.1 莱克多巴胺人工抗原的鉴定
2.1.1 紫外光谱扫描鉴定结果 载体蛋白OVA和BSA在279 nm处有最大吸收峰,RAC在274 nm处有最大吸收峰(图1)。合成的人工抗原的最大吸收峰与OVA和BSA的最大吸收峰相比,发生了蓝移现象,与相关报道一致,说明RAC与载体蛋白偶联成功(图2)。

图1 RAC-OVA、OVA、RAC紫外扫描结果

图2 RAC-BSA、BSA、 RAC紫外扫描结果
2.1.2 紫外光谱扫描鉴定结果 BSA分子质量约为67 ku,OVA分子质量约为43 ku,偶联物RAC-OVA、RAC-BSA分子质量有所增加,其条带比OVA、BSA条带滞后,与相关报道基本一致,证明偶联成功(图3)。
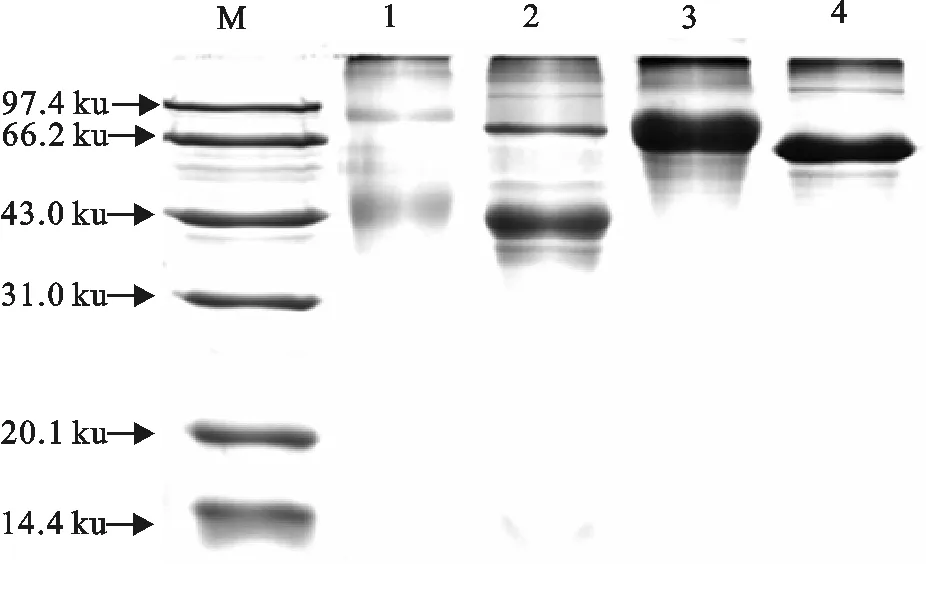
M.蛋白分子质量标准;1.RAC-OVA;2.OVA;3.RAC-BSA;4.BSA
M.Protein molecular weight Marker;1.RAC-OVA;2.OVA;3.RAC-BSA;4.BSA
图3 RAC-OVA、RAC-BSA的SDS-PAGE结果
Fig.3 SDS-PAGE results of RAC-OVA and RAC-BSA
2.2 总RNA的提取及分析
经血球计数板计数,从骆驼外周血收集到约109个淋巴细胞。紫外分光光度法测定提取总RNA, OD 260 nm/OD 280 nm=1.95,浓度为1 658 ng/μL,表明提取的总RNA分子完整,无降解(图4)。
2.3 骆驼重链抗体可变区基因的扩增
以从骆驼外周血淋巴细胞提取的总RNA为模板,用随机引物进行反转录为cDNA后,利用引物VHH-SfiⅠ和VHH1-NotⅠ、VHH2-NotⅠ分别进行骆驼重链可变区长片段和短片段基因的扩增。结果显示,经过PCR扩增后,获得的片段大小约为500 bp的骆驼重链可变区基因VHH,PCR产物经过纯化回收后用于后续试验(图5)。

M.DNA 标准DL 2 000;1、2.总RNA
M.DNA Marker DL 2 000;1,2.Total RNA
图4总RNA琼脂糖凝胶电泳结果
Fig.4 Agarose gel electrophoresis results of total RNA

M.DNA 标准DL 2 000;S.短铰链段;L.长铰链片段
M.DNA Marker DL 2 000;S.Short segments of hinge;L.Long segments of hinge
图5 PCR产物琼脂糖凝胶电泳结果
Fig.5 Agarose gel electrophoresis results of PCR products
2.4 噬菌体重链单域抗体库的构建及鉴定
将等量的长片段和短片段重链可变区基因进行双酶切,用同样的酶对噬菌质粒载体pCANTAB5E进行双酶切,双酶切的结果如图6所示。分别以1∶1、3∶1和5∶1的PCR产物-载体摩尔比进行连接,取10 μL连接产物电转化大肠埃希菌TG1,加入1 mL的LB培养基孵育后,吸取100 μL涂布LB/Amp平板,培养过夜。当摩尔比为3∶1时,得到的菌落数最多,以此比率进行大规模连接。多次电转化到感受态细胞TG1后,获得抗体文库。
随机挑取文库中的20个单克隆进行菌液PCR鉴定,结果显示有18个阳性克隆,说明天然抗体库重组率大约为90%,菌落计数计算得文库的库容量约为107CFU/mL(图7)。挑取了8个克隆送至金唯智生物技术有限公司进行测定,将测序结果翻译为氨基酸序列,经过多序列比对分析,结果显示,8个克隆的外源片段均为编码重链抗体可变区的基因(图8)。

M.DNA 标准DL 15 000;1.VHH;2.噬菌粒载体
M.DNA Marker DL 15 000;1.VHH;2:Phagemid vector
图6 VHH及噬菌体载体双酶切鉴定
Fig.6 Identification of phagemid vector and VHH bySfiⅠ andNotⅠ digestion
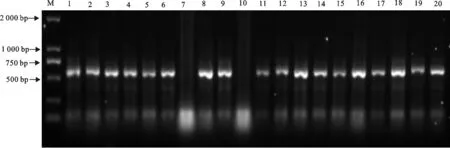
M.DNA 标准DL 15 000;1~20.随机挑取克隆
M.DNA Marker DL 15 000;1-20.Random selected clones
图7文库PCR鉴定结果
Fig.7 PCR identification results of library

图8 VHH抗体库中8个随机克隆氨基酸序列
2.5 噬菌体单域抗体库的筛选富集情况
将RAC-BSA作为包被抗原筛选特异性纳米抗体,在筛选过程中,对每一轮洗脱和扩增后的噬菌体进行滴度测量,用来评估特异性VHH重组噬菌体的富集效果。结果如表2及图9所示,莱克多巴胺纳米抗体的筛选效果主要通过回收率来评价,本试验对噬菌体抗体库进行了2 轮扩增和3 轮淘选的过程,包被的抗原量逐渐减少而洗脱强度逐渐增大,回收率却逐渐增大,说明筛选过程中特异性吸附的抗体已经得到了明显的富集(回收率(%)=噬菌体洗脱量/噬菌体投入量×100%)。

表2 筛选过程中噬菌体的回收率
2.6 phage-ELISA鉴定阳性克隆
对随即挑选出的单菌落扩增后进行phage-ELISA鉴定,试验组包被RAC-OVA,对照组包被OVA,经鉴定有3株阳性克隆,分别命名为A4、C5、D9(图10)。
由图10可以看出,包被RAC-OVA孔的OD值为包被OVA孔OD值的2倍以上,由此可以说明,筛选出的纳米抗体是针对莱克多巴胺的抗体,可进行后续抗体表达、鉴定试验。其中,单克隆A8进行phage-ELISA鉴定表明,单克隆A8不仅可以与RAC-OVA结合,还能与OVA结合,筛选出的阳性克隆A8与载体蛋白OVA有较大的交叉反应。

图9 三轮淘选噬菌体回收率

图10 ELISA方法鉴定特异性阳性克隆
2.7 可溶性重组纳米抗体粗提物的ELISA检测
用ELISA方法检测纳米抗体粗提物的特异性,结果显示,PBS作为无抗原对照NC,相对于对照组,纳米抗体粗提物具有抗原结合能力,OD值大于PBS对照3倍以上(图11)。

图11 ELISA鉴定纳米抗体的结合能力
3 讨论
骆驼血液中有3种类型的IgG,分别为 IgG1、IgG2和 IgG3,其中IgG1为传统抗体,而IgG2和IgG3属于单域重链抗体。这种纳米抗体由于天然缺失轻链,具有亲和力高、稳定性好等优点,可以在原核细胞中表达[10-11],大大降低了制备抗体的成本和周期。由于骆驼或鲨鱼等属于稀有大型动物,对其进行主动免疫而获得特异性抗体,操作困难,所以通过构建天然纳米抗体文库,从中淘选特异性抗体,避免复杂的免疫过程,操作简便。纳米抗体不但分子量小,而且表位识别能力强,所以可以识别微量抗原,例如较难检测出的靶点[12]以及毒素或外来病原[13]。本试验构建非免疫噬菌体抗体库,操作简便,耗费时间短。
噬菌体展示技术具有操作简单、筛选周期短等优点,可以对较大容量的文库进行高通量筛选,是筛选纳米抗体常用的方法。构建库容量大、多样性好的文库是从中淘选出亲和力高、特异性强的纳米抗体的关键。本试验获得了库容约为107的抗体文库,序列分析结果表明文库具有较好的多样性,可以用于其他目标抗体的筛选。
综上所述,本试验通过构建库容量大,多样性好的天然噬菌体抗体库,为进一步筛选其他特异性纳米抗体奠定了基础。
[1] Hamers-Casterman C,Atarhouch T,Muyldermans S,et al.Naturally occurring antibodies devoid of light chains[J].Nature,1993,363(6428):446-448.
[2] Steeland S,Vandenbroucke R E,Libert C.Nanobodies as therapeutics: big opportunities for small antibodies[J].Drug Discov Today,2016,21(7):1076-1113.
[3] 周陶然,詹守斌,翟 飞,等.纳米抗体技术及其在疾病诊断和治疗中的应用[J].生物化学与生物物理进展,2016(10):936-945.
[4] Buckner F S,Griffin J H,Wilson A J,et al.Potent anti-Trypanosomacruziactivities of oxidosqualene cyclase inhibitors[J].Antimicrl Agent Chemother,2001,45(4):1210-1215.
[5] Siontorou C G.Nanobodies as novel agents for disease diagnosis and therapy[J].Int J Nanomed,2013,8:4215-4227.
[6] Huang P,Tay L,Tan Ha j,et al.Single-domain antibody-conjugated nanoaggregate-embedded beads for targeted detection of pathogenic bacteria[J].ChemA Eur J,2009,15(37):9330-9334.
[7] 陈敏艳,王香敏,朱 弘,等.畜禽产品兽药残留危害现状与分析[J].动物医学进展,2012,33(9):109-112.
[8] Arbabi Ghahroudi M,Desmyter A,Wyns L,et al.Selection and identification of single domain antibody fragments from camel heavy-chain antibodies.[J].FEBS Let,1997,414(3):521-526.
[9] Li J,Xia L,Su Y,et al.Molecular imprint of enzyme active site by camel nanobodies rapid and efficient approach to produce abzymes with alliinase activity[J].J Biolog Chem,2012,287(17):13713-13721.
[10] Arbabi-Ghahroudi M,Tanha J,Mackenzie R.Prokaryotic expression of antibodies[J].Can Metasta Rev,2005,24(4):501-519.
[11] Bronsema K J,Bischoff R,Bouche M,et al.High-sensitivity quantitation of a nanobody (R) in plasma by single-cartridge multidimensional SPE and ultra-performance LC-MS/MS[J].Bioanalysis,2015,7(1):53-64.
[12] Stijlemans B,Conrath K,Cortez-retamozo V,et al.Efficient targeting of conserved cryptic epitopes of infectious agents by single domain antibodies-African trypanosomes as paradigm[J].J Biol Chem,2004,279(2):1256-1261.
[13] Eyer L,Hruska K.Single-domain antibody fragments derived from heavy-chain antibodies:a review[J]. Vet Med,2012,57(9):439-513.
