不同CpG ONDs对猪源细胞免疫分子转录水平的影响
2018-02-10张丽琳黎瑞巧黄金海
邓 慧, 张丽琳,黎瑞巧, 张 蕾, 黄金海
(天津大学生命科学学院,天津 300072)
CpG ODNs寡聚脱氧核苷酸(CpG oligodeoxy-nucleotieds,CpG ODNs)是含胞嘧啶和鸟嘌呤的二核苷酸的寡聚脱氧核苷酸。大量研究证实,含有未甲基化CpG基序的细菌DNA或人工合成的寡聚脱氧核苷酸是一种强大的免疫激动剂。CpG ODNs能够直接激活pDC和B细胞,从而引发先天性和适应性免疫应答[1]。由CpG ODNs引发的级联反应能够间接诱导NK细胞、单核细胞、T细胞和巨噬细胞的成熟分化和增殖[2-6]。TLR9的激活可诱导B细胞产生IL-6、IL-12和趋化因子CXC并诱导B细胞表达IgM[7-9]。被CpG ODNs激活的B细胞可上调表达Fc的表达受体(FcR)和共刺激分子MHC Ⅱ类分子(CD40、CD80、CD86)[10-11]。CpG ODNs刺激的B细胞增殖并分化为浆细胞和记忆B细胞[12]。CpG ODNs作为免疫增强剂和疫苗佐剂一开始主要以小鼠和人为研究模型,2001年,Kamstrup S等[13]首次研究了CpG ODNs对猪PBMCs刺激的作用以及筛选出最适合猪的特异性基序ATCGAT。有研究表明,使用CpG ODNs作为免疫佐剂,可以增强仔猪对猪链球菌败血症疫苗(SSSK疫苗)的免疫应答,包括增强SSSK疫苗的特异性抗体滴度、淋巴细胞增殖,增强PBMCs上IFN-γ、IL-6、MHCⅡ和CD14的表达[14]。
为了筛选出能有效激活猪免疫系统的CpG ODNs的序列,设计并合成了7种引物[13],包含CpG的寡聚核苷酸,并用其刺激猪小肠上皮细胞(IPEC-J2)、猪肺泡巨噬细胞(3D4/21)和猪外周血单核细胞(PBMCs),检测3种细胞中多种细胞因子转录水平变化,同时还检测了经CpG ODNs处理后的IPEC-J2中病毒增殖的变化。
1 材料与方法
1.1 材料
1.1.1 CpG ODNs的设计与合成 总结人与小鼠的CpG ODNs的特征,结合最适合猪的CpG基序ATCGAT共设计合成了7条包含CpG单元的序列(部分硫代修饰),引物由苏州金唯智生物科技有限公司合成(表1)。
1.1.2 细胞及病毒 猪肠道上皮细胞系(IPEC-J2),购自广州吉妮欧生物科技有限公司;外周血单核细胞(PBMCs),天津大学生命科学学院微生物与免疫实验室分离自天津市宁河原种猪场的猪;猪肺泡巨噬细胞(3D4/21),中国农业大学动物医学院病毒室惠赠;猪流行性腹泻病毒(PEDV)及水疱性口炎病毒(VSV)-GFP,天津大学生命科学学院微生物与免疫实验室保存。
1.1.3 主要试剂 淋巴细胞分离液,天津灏洋生物制剂有限公司产品;RMPI-1640与H-DMEM完全培养液,Gibico公司产品;胎牛血清(FCS),兰州百灵生物技术有限公司产品;Poly(I:C),北京达科为生物有限公司产品;荧光定量PCR试剂:AceQ qPCR SYBR Green Master Mix试剂盒,南京诺唯赞生物公司产品;Tran Script First-Strand cDNA Synthesis Super Mix第一链合成试剂盒,北京全式金生物技术有限公司产品;Trizol LS reagent、DEPC,Invitrogen公司产品。

表1 CpG ODNs序列及能量
*代表硫代磷酸二酯键;下划线代表CpG单元。
*Phosphorothioate backbone;CpG motif marked with underline.
1.1.4 主要仪器 CO2培养箱和生物安全柜,美国Thermo fisher公司产品;实时荧光定量PCR仪(ABI 7500)、倒置荧光显微镜(型号 IX73),日本奥林巴斯公司产品。
1.2 方法
1.2.1 外周血单核细胞的分离及培养 无菌采集猪全血与EDTA抗凝剂按4∶1加入到50 mL离心管,淋巴细胞分离按说明书分离。IPEC-J2细胞与3D4/21细胞的培养与计数同PBMCs,IPEC-J2细胞使用100 mL/L FCS-H-DMEM培养,PBMCs与3D4/21细胞使用100 mL/L FCS-RMPI 1640培养。活细胞计数按照细胞浓度1×106个/mL每孔2 mL铺于6孔细胞培养板中,置于37℃体积分数为5%的CO2培养箱内培养备用。
1.2.2 CpG ODNs体外刺激试验 按照7个试验组(CpG1、CpG6-CpG11)、阳性对照组(Poly(I:C))、阴性对照(non-CG序列)、空白对照设置培养孔,每个试验组均设3组重复。待细胞生长稳定后进行体外刺激试验。试验组、阳性对照、阴性对照刺激终浓度均为10 μg/mL,等体积PBS刺激作为空白对照。同时置于37℃体积分数为5%的CO2培养箱内培养24 h后提取总RNA,并合成cDNA。RNA的提取操作按照Invitrogen公司Trizol提取试剂盒说明进行,cDNA以提取的总RNA为模板,合成按照Trans Script First-strand cDNA Synthesis Super Mix说明操作。
1.2.3 荧光定量PCR检测细胞因子转录水平的变化
1.2.3.1 检测引物设计 参照NCBI/GenBank登录的基因用DNA Man软件分析其序列保守区,Oligo 7.0软件分别在其保守区内设计荧光定量PCR检测引物,由北京金维智公司合成(表2~表6)。

表2 猪TLR分子相对荧光定量PCR引物

表3 猪TLR信号通路分子相对荧光定量PCR引物

表4 猪白细胞介素相对荧光定量PCR引物

表5 猪肿瘤坏死因子和干扰素相对荧光定量PCR引物
1.2.3.2 实时荧光定量PCR 按照AceQ qPCR SYBR Green Master Mix试剂盒说明书,建立20 μL实时荧光定量PCR反应体系,退火温度按照引物的最适退火温度减少2℃操作。real-time qPCR反应体系:2×Trans Start Top Green qPCR Super Mix 10 μL,上、下游引物各0.4 μL,cDNA模板 2 μL,Passive reference Dye(50×) 0.4 μL,去离子水6.8 μL。real-time qPCR反应程序:95℃ 5 min;95℃ 15 s,Tm降低2℃ 30 s,70℃ 20 s,共45个循环;60℃~95℃,熔解曲线分析。
1.2.3.3 数据处理 采用相对荧光定量2-ΔΔCT法进行相对定量分析(ΔΔCT =(Cttarget x-Ctβ-actin)sample-(Cttarget x-Ctβ-actin)control),值采用Graph Pad Prism统计软件进行Student's t test分析,取转录水平的平均值作雷达图模型取值。CpG ODNs的能量分析使用Chem 3D 15.0软件分析。
1.2.4 PEDV在IPEC-J2上标准曲线的建立 将500 μL毒液中加入1 mL Trizol Reagent震荡摇匀,按1.2.2提取RNA并合成cDNA,扩增PEDV M基因,引物序列见表7。50 μL反应体系如下:10×PCR buffer 5 μL,dNTPs(10 mmol/L)2 μL,上、下游引物(25 pmol/μL)各1 μL,TaqDNA 聚合酶 0.5 μL,cDNA 4 μL,ddH2O 36.5 μL。PCR反应程序:94℃ 5 min;53℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min。

表6 猪抗原递呈相关分子相对荧光定量PCR引物

表7 猪PEDV M基因克隆及相对荧光定量PCR引物
取35 μL PCR产物用15 g/L琼脂糖凝胶电泳,利用TIANGEN普通琼脂糖凝胶回收试剂盒对PCR产物进行纯化回收,操作按试剂盒说明进行。PCR产物与pUM19-T载体的连接,10 μL反应体系:Pum19-T Easy(50 μg/μL) 0.5 μL,胶回收目的片段 3 μL,10×T4连接酶buffer 1 μL,T4 DNA 连接酶 1 μL,ddH2O 4.5 μL。16℃过夜连接后转化到DH-5α感受态细胞,蓝白斑筛选菌株并扩大培养。小提质粒使用OMEGA公司Plasmid Mini Kit I试剂盒,操作按说明书进行。用Nanodrop测定重组质粒浓度,根据质粒拷贝数计算公式换算成拷贝数。

108~10310倍梯度稀释,real-time PCR反应体系和程序同1.2.3.2,以每个浓度对应的CT值做标准曲线,计算标准曲线的R2。
1.2.5 不同CpG ODNs对PEDV在IPEC-J2上增殖的影响 将IPEC-J2调整细胞浓度至1×106个/mL,铺于6孔细胞培养板中。按照7个试验组(CpG1、CpG6-CpG11)、阳性对照组(Poly(I:C))、阴性对照孔、空白对照设置培养孔,并设立3组重复试验。试验组加CpG ODNs、阳性对照加入Poly(I:C)、刺激终浓度均为10 μg/mL,阴性对照和空白对照孔加入等体积的PBS。同时置于37℃、体积分数为5%的CO2培养箱内培养6 h,弃培养基,在试验组、阳性对照组与阴性对照组接种10 MOI PEDV,空白对照组不接种PEDV,只加入与试验组等量的培养基,37℃、体积分数为5%的CO2培养箱内培养72 h后,按照1.2.2提取总RNA并合成cDNA。以此为模板,进行荧光定量PCR扩增,将得到的CT值带入标准曲线中,计算不同组的病毒载量。
1.2.6 不同CpG ODNs对VSV-GFP在IPEC-J2上增殖的影响 试验组和对照组的设置与CpG ODNs处理细胞的方法均按照1.2.5,处理细胞6 h后每孔接0.1 MOI VSV-GFP,24 h后清洗3次,DAPI染色10 min,倒置荧光显微镜观察绿色荧光,以绿色荧光强度判断VSV-GFP的增殖情况。
2 结果
2.1 CpG ODNs对TLR9、TLR3、TLR8和TLR9的影响
CpG ODNs在IPEC-J2细胞上主要促进TLR9和TLR3两种TLRs转录水平升高,其中除CpG7外,其余CpG ODNs均能促进TLR9的转录水平升高,其中以CpG1和CpG11的促进作用最明显,CpG7可以促进TLR3转录水平的升高。除CpG1和CpG10,其余CpG ODNs可以促进TLR3转录水平升高。CpG ODNs不能促进TLR7的转录水平升高,并且抑制TLR8的转录。CpG1和CpG11能够使3D4/21细胞上TLR3和TLR9的转录水平显著升高(图1)。
2.2 CpG ODNs对MyD88、NF-κB、p38和IRF3的影响
在IPEC-J2上,CpG ODNs促进IPEC-J2细胞MyD88和NF-κB转录水平升高,CpG8和CpG10能够促进p38的转录水平升高,虽然有多种CpG ODNs能够促进TLR3的转录,但是普遍不能使IRF3的转录水平升高,只有CpG10和CpG11能够在PBMCs上促进IRF3的转录水平升高(图2)。

A.IPEC-J2 cells;B.3D4/21;C.PBMCs
图1 TLR3、TLR7、TLR8和TLR9在3种细胞转录水平的变化
Fig.1 The relative expressions of TLR3,TLR7,TLR8 and TLR9 in different CpG ODNs treatment cells

A.IPEC-J2 cells;B.3D4/21;C.PBMCs
图2 MyD88、NF-κB、p38和IRF3在3种细胞转录水平的变化
Fig.2 The relative expressions of MyD88,NF-κB,p38 and IRF3 in different CpG treatment cells
2.3 CpG ODNs对白细胞介素的影响
CpG ODNs能够促进IPEC-J2上IL-2转录水平的升高,在PBMCs上,能够促进IL-4转录水平升高,在3D4/21细胞上,CpG ODNs能促进多种白介素转录水平升高,CpG1和CpG11能够促进IL-4、IL-6、IL-10、IL-12和IL-17的转录水平升高,CpG7和CpG10也能够促进上述白介素转录水平升高,但是促进作用不如CpG1和CpG11显著(图3)。
2.4 CpG ODNs对IFN-α和IFN-β的影响
CpG ODNs能够促进IPEC-J2上TNF-α的高效转录,但是对干扰素的促进作用较弱,CpG1、CpG11、CpG7和CpG10能够促进3D4/21细胞上TNF-α、IFN-α和IFN-β的转录水平升高。在PBMCs上CpG ODNs能够促进IFN-γ的转录水平升高(图4)。
2.5 CpG ODNs对抗原递呈相关分子的影响
在IPEC-J2上CpG ODNs对抗原递呈相关分子转录的促进作用较差,只有CpG10能够促进MHCⅡ的转录,在3D4/21细胞和PBMCs上,CpG ODNs能够强烈促进CD86转录,并且CpG10和CpG11能够在3D4/21细胞上促进MHCⅡ的转录(图5)。

A.IPEC-J2 cells;B.3D4/21;C.PBMCs
图3白细胞介素在3种细胞转录水平的变化
Fig.3 The relative expressions of the interleukin in different CpG ODNs treatment cells
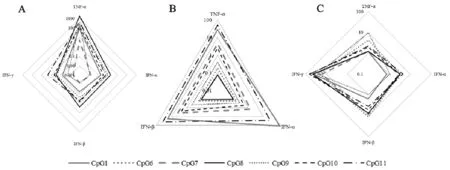
A.IPEC-J2 cells;B.3D4/21;C.PBMCs
图4干扰素和肿瘤坏死因子在3种细胞上转录水平的变化
Fig.4 The relative expressions of the interferon and anti-tumor necrosis factor in different CpG ODNs treatment cells

A.IPEC-J2 cells;B.3D4/21;C.PBMCs
图5 MHCⅠ、MHCⅡ和CD86在3种细胞转录水平的变化
Fig.5 The relative expressions of major histocompatibility complexes and adhesion molecules in different CpG ODNs treatment cells
2.6 CpG ODNs对VSV-GFP在IPEC-J2细胞上增殖的影响
根据1.2.4得到PEDV标准曲线,R2=0.985 8的线性回归方程y=-3.167x+36.86,将1.2.5得到的Ct值带入y中,即得到PEDV的M基因的拷贝数(即x的值)(图6)经CpG ODNs处理后的IPEC-J2感染PEDV后可显著降低PEDV在细胞上的增殖,其中CpG1抵抗PEDV能力最强,经CpG ODNs处理后的IPEC-J2也可以明显观察到细胞中绿色荧光数量少于空白对照组和阴性对照组,说明CpG ODNs也能够降低VSV-GFP在细胞上增殖(图7和图8)。

图6 PEDV在IPEC-J2增殖标准曲线

图7 不同CpG ODNs对PEDV在IPEC-J2增殖的影响

图8 VSV-GFP在经CpG ODN处理IPEC-J2细胞的增殖
3 讨论
通过查阅总结文献设计并合成了7条具有不同特征的CpG ODNs,对7条CpG ODNs在体外对3种猪源细胞(IPEC-J2细胞,3D4/21细胞,PBMCs)上免疫分子的转录水平的影响进行了评价,包括胞内TLRs、TLRs相关信号通路分子、白细胞介素、干扰素和肿瘤坏死因子、抗原递呈相关分子等。最后还探究了CpG ODNs处理过IPEC-J2的抗病毒能力的变化。本研究选取了2种单链RNA病毒PEDV和VSV,比较了经过CpG ODNs处理过的细胞的抗病毒的能力。
检测了CpG ODNs处理的3种猪源细胞免疫应答相关分子的转录水平变化。表明CpG ODNs可以促进IPEC-J2上TLR3和TLR9转录水平的升高。虽然CpG ODNs促进3D4/21细胞和PBMCs的TLRs及信号通路分子的转录升高,作用不及IPEC-J2,但是这并不妨碍3D4/21和PBMCs下游的细胞因子转录水平升高,这可能说明CpG ODNs在3种细胞上的作用时间不同,CpG ODNs可以在IPEC-J2上作用更长的时间。CpG ODNs可调节细胞的免疫应答类型,平衡Th1/Th2反应:CpG1、CpG7、CpG9、CpG10和CpG11可以促进多种Th类型细胞因子的转录(如Th2型细胞因子IL-4、Th1型细胞因子IL-12和IFN-γ、局部炎性因子IL-17等);CpG6和CpG8能够平衡Th1/Th2反应,同时促进Th1型细胞因子IFN-γ和/或IL-12的转录水平升高。CpG ODNs也能够促进抗原递呈能力的增强,CpG ODNs在3D4/21和PBMCs上促进了黏附分子CD86转录水平的升高,提高了APC对诱导T淋巴细胞增殖及产生IL-2的能力。并且CpG ODNs对3种细胞的MHC分子的转录也有促进作用。CpG ODNs能够促进PBMCs细胞上干扰素的转录,PBMCs上IFN-γ和IFN-β相比于IPEC-J2细胞和3D4/21细胞的转录水平更高。CpG ODNs对不同细胞免疫分子转录的促进作用的能力也有较大的差别,例如CpG7促进IPEC-J2细胞的免疫分子转录较差,但是对促进3D4/21细胞的免疫分子转录较强,因此CpG7更加适用于需要提高APC的抗原递能力的疫苗,而CpG11对3种细胞免疫分子转录的促进作用都比较强;CpG1能够促进3D4/21细胞表达多种白介素,可以使APC促进多种T细胞的活化。
3种猪源细胞对CpG ODNs免疫应答反应不同。IPEC-J2细胞作为肠上皮细胞是机体的屏障并且是先天免疫反应发生地,3D4/21细胞是先天免疫细胞并且可在免疫系统中发挥APC的作用,在猪小肠上皮细胞上促进TLR9和/或TLR3的转录水平的效果更为明显,说明CpG ODNs可较好地激活天然免疫反应,增强黏膜免疫应答。CpG ODNs作为佐剂可促进3D4/21细胞的抗原递呈能力及协助T细胞的激活。CpG ODNs可直接促进PBMCs产生干扰素,增强抗感染能力。
不同CpG ODNs对病毒增殖的抑制作用因病毒而异。CpG ODNs处理细胞显著抑制了PEDV的增殖(P<0.01),其能力排序为CpG1> CpG7> CpG6>CpG10> CpG11> CpG9> CpG8。CpG1最接近天然的CpG ODNs结构且能量最高,拥有最好的抗病能力。CpG ODNs处理细胞对VSV增殖的抑制作用为CpG11> CpG6> CpG10> CpG8> CpG7> CpG9> CpG1。
综上所述,本研究发现了CpG ODNs能够促进TLR9或TLR3、及其信号通路分子的转录,引发B细胞活化,通过改变细胞因子谱的表达调节Th细胞的反应类型,可以促进APC的抗原递呈能力。因此可通过选择不同型CpG ODNs作为佐剂,根据疫苗免疫应答特点,以强化体液免疫或局部黏膜免疫;特定型CpG ODNs也可作为潜在干扰素诱生剂,用于PEDV或VSV感染的防控。
[1] Hartmann G,Krieg A M.Mechanism and function of a newly identified CpG DNA motif in human primary B cells[J].J Immunol,2000,164(2):944-953.
[2] Ballas Z K,Rasmussen W L,Krieg A M.Induction of NK activity in murine and human cells by CpG motifs in oligodeoxynucleotides and bacterial DNA[J].J Immunol,1996,157(5):1840-1845.
[3] Klinman D M,Yi A K,Beaucage S L,et al.CpG motifs present in bacteria DNA rapidly induce lymphocytes to secrete interleukin 6,interleukin 12,and interferon gamma[J].Proc Nat Acad Sci U S A,1996,93(7):2879-2883.
[4] Sun S,Zhang X,Tough D F,et al.Type I interferon-mediated stimulation of T cells by CpG DNA[J].J Exp Med,1998,188(12):2335-2342.
[5] StaceyY K J,Sweet M J,Hume D A.Macrophages ingest and are activated by bacterial DNA[J].J Immunol,1996,157(5):2116-2122.
[6] Roman M,Martin-orozco E,Goodman J S,et al.Immunostimulatory DNA sequences function as T helper-1-promoting adjuvants[J].Nat Med,1997,3(8):849-854.
[7] Krieg A M,Yi A K,Matson S,et al.CpG motifs in bacterial DNA trigger direct B-cell activation[J].Nature,1995,374(6522):546-549.
[8] Kato A,Ogasawara T,Homma T,et al.CpG oligodeoxynucleotides directly induce CXCR3 chemokines in human B cells[J].Biochem Biophys Res Commun,2004,320(4):1139-1147.
[9] Yi A K,Klinman D M,Martin T L,et al.Rapid immune activation by CpG motifs in bacterial DNA.Systemic induction of IL-6 transcription through an antioxidant-sensitive pathway[J].J Immunol,1996,157(12):5394-5402.
[10] Davis H L,Weeratna R,Waldschmidt T J,et al.CpG DNA is a potent enhancer of specific immunity in mice immunized with recombinant hepatitis B surface antigen[J].J Immunol,1998,160(2):870-876.
[11] Kobayashi H,Horner A A,Takabayashi K,et al.Immunostimulatory DNA pre-priming: a novel approach for prolonged Th1-biased immunity[J].Cell Immunol,1999,198(1):69-75.
[12] Jung J,Yi A K,Zhang X,et al.Distinct response of human B cell subpopulations in recognition of an innate immune signal, CpG DNA[J].J Immunol,,2002,169(5):2368-2373.
[13] Kamstrup S,Verthelyi D,Klinman D M.Response of porcine peripheral blood mononuclear cells to CpG-containing oligodeoxynucleotides[J].Vet Microbiol,2001,78(4):353-362.
[14] Hartmann G,Marschner A,Viveros P R,et al.CpG oligodinucleotides induce strong humoral and cellular responses to swine streptococcic septicemia vaccine in pigletsinvivo[J].Int Immunopharmacol,2006,6(3):342-350.
