氟西汀对抑郁症大鼠行为学表现及丝裂原活化蛋白激酶-p38信号通路的影响
2018-02-09邵秋静赵利芹谷景阳王长虹
邵秋静,赵利芹,李 晏,谷景阳,刘 聪,王长虹
(1.新乡医学院第二附属医院精神科,河南 新乡 453002;2.郑州大学公共卫生学院,河南 郑州 450001)
抑郁症是一种慢性、易复发的常见精神疾病,发病机制较为复杂,目前尚无一种假说能够全面地解释病因,临床治疗的发展也受到阻碍[1]。随着抑郁症分子病理学研究的发展,近年来,有关细胞信号通路的研究受到了人们的广泛关注[2]。丝裂原活化蛋白激酶磷酸酶-1(mitogen-activated protein kinase phosphatase-1,MKP-1)主要分布于细胞核内,参与抑郁和神经炎症等的调节[3],其主要作用是介导丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)去磷酸化,MAPK是真核生物中一类高度保守的丝氨酸/苏氨酸蛋白激酶,包括3个亚族:细胞外信号调节激酶、应激活化蛋白激酶和 p38[4]。MAPK可调节细胞核内不同基因的转录,其活性受蛋白激酶的磷酸化及去磷酸化调节,是一个重要的细胞信号通路[3]。目前,抑郁症的炎性假说越来越受到人们重视,而MAPK的3个亚族中p38与炎症较为密切[5]。本研究以慢性不可预见性刺激(chronic unpredictablemild stress,CUMS)制备抑郁症大鼠模型,以氟西汀为干预药物,探讨氟西汀对抑郁症大鼠行为学表现及海马内MKP-1、磷酸化p38(phosphorylated p38,p-p38)和p38表达的影响,以期为抑郁症的发病机制及治疗提供线索。
1 材料与方法
1.1 实验动物无特定病原体级雄性Sprague Dawley大鼠80只,6~8周龄,体质量180~200 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001,质量合格证号:11400700139232。大鼠饲养于湿度40%~50%、温度(24.0±1.0)℃的独立通气笼系统,昼夜比为12 h/12 h。
1.2 药物、试剂与仪器盐酸氟西汀(礼来苏州制药有限公司,国药准字J 20130010),MKP-1抗体(英国Abcam公司),p38蛋白(p38 MAPK)抗体、pp38(p-p38 MAPK)抗体(美国CST公司),磷酸甘油醛脱氢酶 (glyceraldehyde phosphate dehydrogenase,GAPDH)抗体(上海碧云天生物技术有限公司)、羊抗兔二抗和小鼠抗兔二抗(中衫金桥生物技术有限公司)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodi-um dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)仪和转移装置(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 动物分组40只大鼠采用随机数字表法分为正常组、抑郁症组、生理盐水组和氟西汀组,每组10只。
1.3.2 抑郁症大鼠模型制备抑郁症组、生理盐水组和氟西汀组大鼠均孤养,并给予8周CUMS,制备抑郁症模型;正常组大鼠以每笼3只正常环境饲养8周,不给予CUMS。抑郁症造模方法参照LIU等[6]的方法,CUMS包括:潮湿垫料24 h、禁食24 h、禁水24 h、昼夜颠倒24 h、夹尾(夹大鼠尾部近体端1/3处,每次1 min,)、电击足底(电压 60 V,每次10 s,每次间隔5 s)、强迫游泳(水温4℃,每次5 min)、行为限制(每次2 h)、夜间笼子倾斜45°,上述9种刺激随机排列,相同刺激不可连续出现,连续8周。
1.3.3 干预方法于CUMS第5~8周,氟西汀组大鼠给予氟西汀灌胃(10 mg·kg-1·d-1)[7],生理盐水组大鼠给予同体积的生理盐水灌胃(10 mg·kg-1·d-1)。正常组和抑郁症组大鼠不给予任何干预。
1.3.4 大鼠行为学评估分别于造模前、造模后(CUMS 4周后)及干预后对4组大鼠进行体质量称量、蔗糖偏好实验、旷场实验及强迫游泳实验,评估大鼠行为学。(1)蔗糖偏好实验[8-9]:将大鼠置于安静的房间;第1天,在笼子上放置2瓶10 g·L-1蔗糖溶液;第2天,1瓶10 g·L-1蔗糖溶液,1瓶清水;第3天,大鼠禁食禁水;第 4天,定量好 1瓶10 g·L-1蔗糖水,1瓶清水,12 h后将糖水瓶与清水瓶交换位置,测试24 h,称量。计算蔗糖偏好指数。蔗糖偏好指数=糖水消耗量/(清水和糖水消耗量)×100%。(2)旷场实验[10]:旷场由不透明钢板制成(100 cm×100 cm×40 cm),置于暗室,将大鼠置于旷场中心,摄像机拍摄,Smart virsion2.5软件(上海欣软信息科技有限公司)记录大鼠5 min内行为,计算大鼠运动总路程,并人工同步记录大鼠直立次数。(3)强迫游泳实验:参考 PORSOLT等[11]的方法稍作修改,水温约25℃,测试6 min,记录后5 min的不动时间。
1.3.5 W estern blot法测定大鼠海马组织内M KP-1、p-p38和p38蛋白表达4组大鼠最后一次行为评估后,给予 100 g·L-1水合氯醛(4 mL·kg-1)腹腔注射麻醉,在冰上迅速钝性分离出双侧海马组织,用生理盐水冲洗后放入冷存管(-80℃),置入液氮备用。取适量海马组织放入2 mL离心管中,加入放射免疫沉淀裂解液和磷酸酶抑制剂的混合物,最后加入研磨珠,使用组织研磨仪研磨约60 s,在冰上裂解30 min,放入离心机,4℃下13 000×g离心15 min,置于-80℃冰箱备用。采用二喹啉甲酸法检测海马组织总蛋白浓度;进行SDS-PAGE:90 V电泳30 min、160 V电泳50 min;转膜:300 mA转膜90 min;使用Tris洗膜缓冲液洗膜2 min;封闭:50 g·L-1牛血清白蛋白封闭室温摇床1 h;用Tris洗膜缓冲液洗膜3次,每次8 min;一抗孵育:加入一抗,室温摇床1 h,4℃过夜;用Tris洗膜缓冲液洗膜3次,每次8 min;孵育二抗:室温孵育2 h;用Tris洗膜缓冲液洗膜3次,每次8 min。滴加超敏增强化学发光液至聚偏氟乙烯膜上,显影拍照、保存条带图片。应用化学发光成像分析仪自带分析软件对目的蛋白、管家基因蛋白条带进行定量分析。
1.4 统计学处理应用SPSS 20.0软件进行处理数据,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较方差齐时采用最小显著性差异法,方差不齐时采用Tamhane法,P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠行为学指标比较结果见表1。造模前4组大鼠行为学指标比较差异均无统计学意义(P>0.05)。与造模前比较,造模后抑郁症组、生理盐水组和氟西汀组大鼠蔗糖偏好指数降低,旷场实验水平运动距离和直立次数减少,强迫游泳不动时间增加,差异均有统计学意义(P<0.05)。造模后抑郁症组、生理盐水组和氟西汀组大鼠行为学指标比较差异均无统计学意义(P>0.05)。与正常组比较,造模后抑郁症组、生理盐水组和氟西汀组大鼠蔗糖偏好指数降低,旷场实验水平运动距离和直立次数减少,强迫游泳不动时间增加,差异均有统计学意义(P<0.05)。与正常组比较,干预后抑郁症组和生理盐水组大鼠蔗糖偏好指数降低,旷场实验水平运动距离和直立次数减少,强迫游泳不动时间增加,差异均有统计学意义(P<0.05);与抑郁症组和生理盐水组比较,干预后氟西汀组大鼠蔗糖偏好指数升高,旷场实验水平运动距离和直立次数增加,强迫游泳不动时间缩短,差异均有统计学意义(P<0.05)。
表1 4组大鼠行为学指标比较Tab.1 Comparison of the behavioral indexes of rats in the four groups (±s)
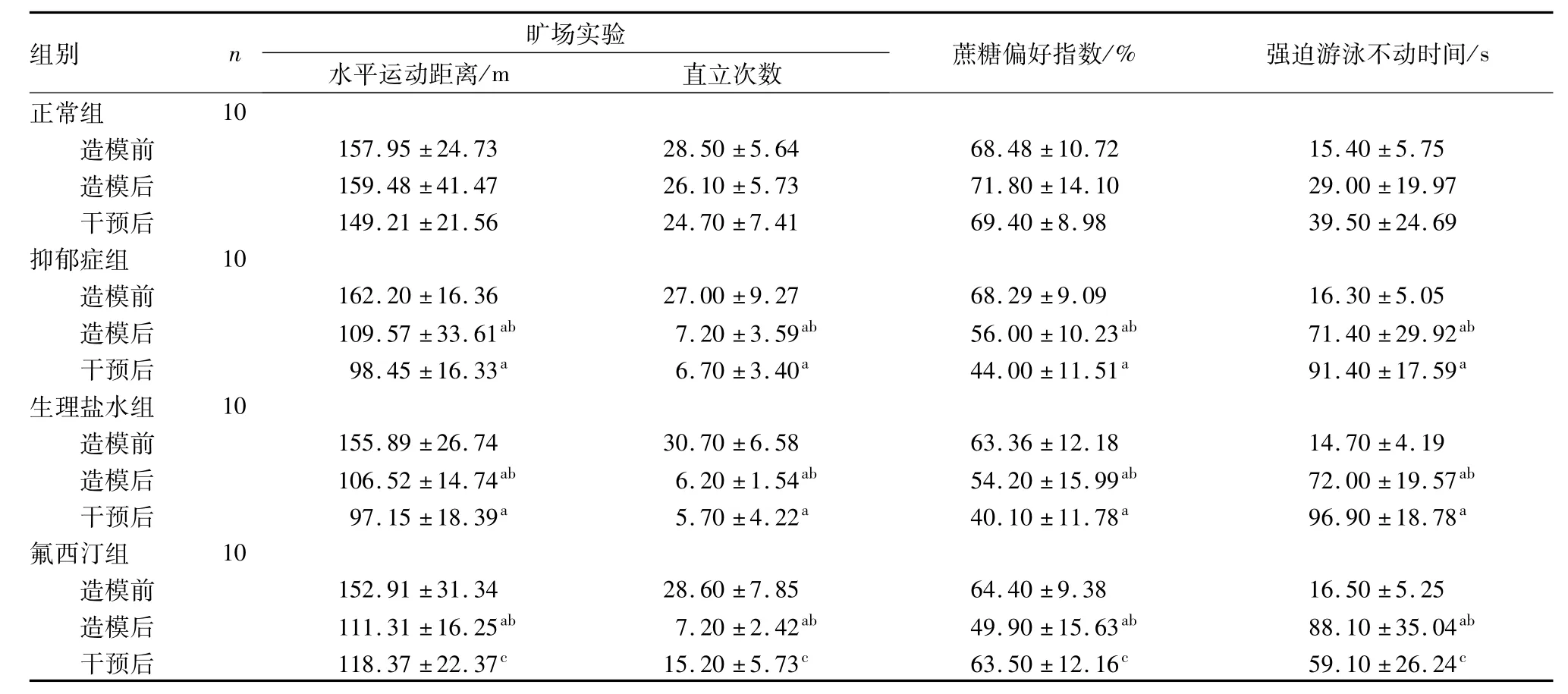
表1 4组大鼠行为学指标比较Tab.1 Comparison of the behavioral indexes of rats in the four groups (±s)
注:与正常组比较a P<0.05;与造模前比较b P<0.05;与抑郁症组和生理盐水组比较c P<0.05。
组别 n/s正常组旷场实验水平运动距离/m 直立次数 蔗糖偏好指数/% 强迫游泳不动时间10造模前 157.95±24.73 28.50±5.64 68.48±10.72 15.40±5.75造模后 159.48±41.47 26.10±5.73 71.80±14.10 29.00±19.97干预后 149.21±21.56 24.70±7.41 69.40±8.98 39.50±24.69抑郁症组 10造模前 162.20±16.36 27.00±9.27 68.29±9.09 16.30±5.05造模后 109.57±33.61ab 7.20±3.59ab 56.00±10.23ab 71.40±29.92ab干预后 98.45±16.33a 6.70±3.40a 44.00±11.51a 91.40±17.59a生理盐水组 10造模前 155.89±26.74 30.70±6.58 63.36±12.18 14.70±4.19造模后 106.52±14.74ab 6.20±1.54ab 54.20±15.99ab 72.00±19.57ab干预后 97.15±18.39a 5.70±4.22a 40.10±11.78a 96.90±18.78a氟西汀组 10造模前 152.91±31.34 28.60±7.85 64.40±9.38 16.50±5.25造模后 111.31±16.25ab 7.20±2.42ab 49.90±15.63ab 88.10±35.04ab干预后 118.37±22.37c 15.20±5.73c 63.50±12.16c 59.10±26.24c
2.2 4组大鼠海马组织中 MKP-1、p-p38、p38蛋白表达及p-p38/p38比较结果见图1、图2和表2。抑郁症组和生理盐水组大鼠海马组织中MKP-1表达显著高于正常组(P<0.05),氟西汀组大鼠海马组织中MKP-1表达显著低于抑郁症组和生理盐水组(P<0.05),抑郁症组与生理盐水组大鼠海马组织中MKP-1表达比较差异无统计学意义(P>0.05),氟西汀组与正常组大鼠海马组织中MKP-1表达比较差异无统计学意义(P>0.05)。4组大鼠海马组织中p-p38、p38蛋白表达及p-p38/p38比较差异均无统计学意义(P>0.05)。
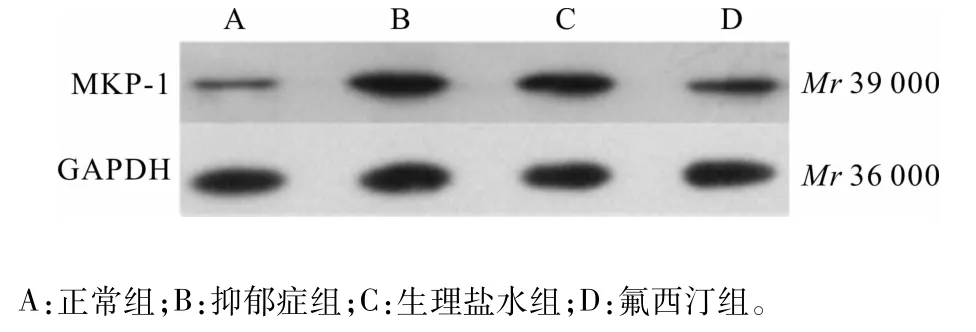
图1 4组大鼠海马组织中M KP-1蛋白表达(W estern blot)Fig.1 Expression of MKP-1 protein in the hippocampus tissues of rats in the four groups(Western blot)
图2 4组大鼠海马组织中p-p38和p38蛋白表达(W estern blot)Fig.2 Expression of p-p38 and p38 protein in the hippocampus tissues of rats in the four groups(W estern blot)
表2 4组大鼠海马组织中MKP-1、p-p38、p38蛋白表达及p-p38/p38比较Tab.2 Com parison of the expression of MKP-1,p-p38,p38 protein and p-p38/p38 in the hippocampus tissues of rats in the four groups (±s)
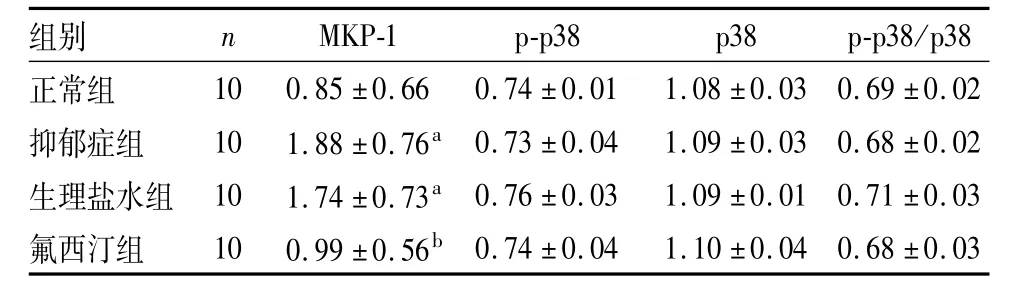
表2 4组大鼠海马组织中MKP-1、p-p38、p38蛋白表达及p-p38/p38比较Tab.2 Com parison of the expression of MKP-1,p-p38,p38 protein and p-p38/p38 in the hippocampus tissues of rats in the four groups (±s)
注:与正常组比较a P<0.05;与抑郁症组和生理盐水组比较b P<0.05。
组别 n MKP-1 p-p38 p38 p-p38/p38正常组10 0.85±0.66 0.74±0.01 1.08±0.03 0.69±0.02抑郁症组 10 1.88±0.76a 0.73±0.04 1.09±0.03 0.68±0.02生理盐水组 10 1.74±0.73a 0.76±0.03 1.09±0.01 0.71±0.03氟西汀组 10 0.99±0.56b 0.74±0.04 1.10±0.04 0.68±0.03
3 讨论
抑郁症发病机制复杂,主要与单胺类神经递质的减少、HPA轴功能失调、神经营养因子分泌失调、炎症反应系统紊乱等因素有关,目前,抑郁症的确切发病机制尚不明确[1,6]。
CUMS模型是目前最常用的抑郁模型,被广泛应用于抑郁症病理机制与药物治疗学研究[12]。本研究采用CUMS制备大鼠抑郁症模型,经过4周的CUMS,大鼠表现出蔗糖偏好指数降低,运动能力下降,表明成功建立了抑郁模型。这与国内外学者[7,13-14]的研究结果一致。
有研究表明,MKP-1抑制剂血根碱和氟西汀均可使抑郁症大鼠出现强迫游泳不动时间显著减少,海马组织中 MKP-1表达降低[15]。DURIC等[16]研究发现,抑郁症患者尸体海马组织中MKP-1蛋白表达显著上调。研究显示,氟西汀可改善CUMS诱导的大鼠快感缺乏和无助行为,并部分逆转MKP-1表达上调;在正常大鼠海马中靶向注入MKP-1过表达质粒,大鼠可出现抑郁样行为;而MKP-1基因敲除的小鼠给予CUMS造模,并未出现抑郁样症状[16]。本研究结果显示,抑郁症组和生理盐水组大鼠海马组织中MKP-1表达显著高于正常组,氟西汀组大鼠海马组织中MKP-1表达显著低于抑郁症组和生理盐水组,抑郁症组与生理盐水组大鼠海马组织中MKP-1表达比较差异无统计学意义。这与国内外的相关研究结果一致[17-18]。据此推测,MKP-1在抑郁症发病机制中起重要作用,有望成为抑郁症治疗的一个关键靶点;氟西汀可以逆转CUMS所致抑郁症大鼠海马组织内MKP-1高表达,MKP-1可能参与了氟西汀治疗抑郁症的作用机制。
抑郁症的炎性假说越来越受到重视,所以设想p38通路是否通过炎性反应与抑郁症有关联。p38通路与炎症反应联系密切,类风湿关节炎、阿尔茨海默病等被证实部分由p38途径调节[19-21]。本研究结果显示,4组大鼠海马组织中p-p38、p38蛋白表达及p-p38/p38比较差异均无统计学意义;推测p38信号通路与CUMS所致抑郁症大鼠无关,氟西汀对CUMS所致抑郁症大鼠海马组织中p38信号通路无影响。这与BUDZISZEWSKA等[22]研究结果一致。
综上所述,CUMS可成功诱导大鼠抑郁症,MKP-1可能与抑郁症的发病机制有关,MKP-1在抑郁症的发病机制中可能不是通过p38信号通路起作用;氟西汀可能是通过下调海马组织中MKP-1表达而发挥治疗抑郁症的作用。
[1]KESSLER R C.The costs of depression[J].Psychiatr Clin North Am,2012,35(1):1-14.
[2]李牧函,余冰颖,刘屏.胞外信号调控激酶(ERK)信号通路与抑郁症[J].神经药理学报,2015,5(1):38-44.
[3]NISHIDA E,GOTOH Y.The MAP kinase cascade is essential for diverse signal transduction pathways[J].Trends Biochem Sci,1993,18(4):128-131.
[4]JEFFREY K L,CAMPSM,ROMMEL C,et al.Targeting dual-specificity phosphatases:manipulating MAP kinase signalling and immune responses[J].Nat Rev Drug Discov,2007,6(5):391-403.
[5]ZARUBIN T,HAN JH.Activation and signaling of the p38 MAP kinase pathway[J].Cell Res,2005,15(1):11-18.
[6]LIU D,WANG Z,GAO Z,et al.Effects of curcumin on learning and memory deficits,BDNF,and ERK protein expression in rats exposed to chronic unpredictable stress[J].Behav Brain Res,2014,271:116-121.
[7]WANG C H,ZHANG X L,LIY,et al.Role of hippocampusmitogen-activated protein kinase phosphatase-1 mRNA expression and DNA methylation in the depression of the rats with chronic unpredicted stress[J].Cell Mol Neurobiol,2015,35(4):473-482.
[8]BANASRM,VALENTINEGW,LIX Y,etal.Chronic unpredictable stressdecreases cell proliferation in the cerebral cortex of the adult rat[J].Biol Psychiatry,2007,62(5):496-504.
[9]LUO Y,KUANGS,XUE L,etal.Themechanism of5-lipoxygenase in the impairmentof learning andmemory in rats subjected to chronic unpredictable mild stress[J].Physiol Behav,2016,167:145-153.
[10]LIZ Y,ZHENG X Y,GAO X X,et al.Study of plasmametabolic profiling and biomarkers of chronic unpredictablemild stress rats based on gas chromatography/mass spectrometry[J].Rapid Commun Mass Spectrom,2010,24(24):3539-3546.
[11]PORSOLT R D,BERTIN A,JALFRE M.Behavioral despair in mice:a primary screening test for antidepressants[J].Arch Int Pharmacodyn Ther,1977,229(2):327-336.
[12]庞珍珍,詹合琴,陈正跃,等.甜叶菊正丁醇提取物对抑郁小鼠肝脏单一免疫球蛋白白细胞介素1受体相关蛋白和核转录因子κB表达的影响[J].中华实用儿科临床杂志,2016,31(19):1480-1483.
[13]DOWELL N G,COOPER E A,TIBBLE J,et al.Acute changes in striatalmicrostructure predict the development of interferon-alpha induced fatigue[J].Biol Psychiatry,2016,79(4):320-328.
[14]赵利芹,李晏,邵秋静,等.丰富环境对抑郁大鼠行为学及海马组织中丝裂原活化蛋白激酶磷酸酶-1表达的影响[J].新乡医学院学报,2017,34(9):798-802.
[15]VOGT A,TAMEWITZ A,SKOKO J,et al.The benzophenanthridine alkaloid,sanguinarine,is a selective,cell-active inhibitor of mitogen-activated protein kinase phosphatase-1[J].JBiol Chem,2005,280(19):19078-19086.
[16]DURIC V,BANASR M,LICZNERSKIP,et al.A negative regulator of MAP kinase causes depressive behavior[J].Nat Med,2010,16(11):1328-1332.
[17]LIOW,MATSUKAWA N,TSUKAHARA T,et al.Effects of chronic social defeat stress on MAP kinase cascade[J].Neurosci Lett,2011,504(3):281-284.
[18]王国栋.慢性不可预见性应激抑郁模型大鼠海马MKP-1表达及其启动子区组蛋白H3乙酰化状态研究[D].新乡:新乡医学院,2013.
[19]KUMAR S,MCDONNELL P C,GUM R J,et al.Novel homologues of CSBP/p38 MAP kinase:activation,substrate specificity and sensitivity to inhibition by pyridinyl imidazoles[J].Biochem Biophys Res Commun,1997,235(3):533-538.
[20]JOHNSON G V,BAILEY C D.The p38 MAP kinase signaling pathway in Alzheimer′s disease[J].Exp Neurol,2003,183(2):263-268.
[21]HOLLENBACH E,NEUMANN M,VIETH M,et al.Inhibition of p38 MAP kinase-and RICK/NF-kappaB-signaling suppresses inflammatory bowel disease[J].FASEB J,2004,18(13):1550-1552.
[22]BUDZISZEWSKA B,SZYMANSKAM,LESKIEWICZM,etal.The decrease in JNK-and p38-MAP kinase activity is accompanied by the enhancement of PP2A phosphate level in the brain of prenatally stressed rats[J].J Physiol Pharmacol,2010,61(2):207-215.
