miRNA-21和左旋精氨酸在大鼠肾缺血再灌注损伤中的作用
2018-02-06于湘友李元媛
徐 婷, 马 龙, 王 毅, 于湘友, 吴 昆, 李元媛
(1南京医科大学附属淮安第一医院中心实验室, 江苏 淮安 223300; 2新疆医科大学第一附属医院重症医学科, 乌鲁木齐 830000; 3南京医科大学附属淮安第一医院, 江苏 淮安 223300)
肾脏对缺血再灌注损伤很敏感,缺血再灌注损伤很容易引起肾小管坏死、凋亡、氧化应激及炎症反应,能导致急性或者慢性肾功能不全。肾缺血再灌注损伤常发生于围手术期,如心脏手术、血管手术。由于体温降低或血流阻断,缺血再灌注损伤在肾移植手术中几乎无法避免[1-2]。由于肾缺血再灌注损伤引起的急性肾损伤发病率及死亡率都很高,当前尚无有效的方法降低缺血再灌注损伤对器官的影响,因此需要寻找有效的手段应对肾缺血再灌注损伤。
左旋精氨酸(L-Arg)是一种碱性氨基酸,是内生性一氧化氮(NO)的前体物质,L-Arg 可通过提高体内NO水平,平衡NO和氧自由基而减轻缺血再灌注损伤(ischemia-reperfusion injury,IRI )时的细胞凋亡[3]。
MicroRNAs(miRNAs) 是一种单链非编码小RNA,通过降解或抑制多种靶基mRNA的翻译,从而对多种靶基因表达进行负调节[4]。miRNAs在缺血再灌注损伤中起重要作用,如心肌、肝脏、脑缺血再灌注损伤[5-6]。微小RNA-21(miRNA-21)能促进细胞增殖,抑制凋亡,调节氧化应激,可能在肾损伤及组织修复过程的病理机制中起到关键作用。大鼠肾缺血再灌注损伤模型研究发现,miRNA-21上调后血尿素氮和肌酐水平降低,对肾缺血再灌注损伤具有保护作用[7]。
本研究探讨L-Arg预处理对肾缺血再灌注损伤的保护作用,以及L-Arg预处理后miRNA-21表达水平变化,并研究miRNA-21水平变化和其调控的凋亡前体靶点程序性凋亡因子4(PDCD4)、PTEN及Akt信号途径在肾缺血再灌注损伤中的作用。
1 材料与方法
1.1实验动物SPF级雄性SD大鼠(许可证号:SCXK苏2009-0002),由江苏大学动物中心提供,10~12周龄,体质量180~280 g,饲养于江苏大学动物中心,在温度、湿度可控制的笼中饲养,自由摄食和饮水,所有实验操作通过伦理委员会批准。
1.2主要试剂左旋精氨酸(L-Arg)购自美国Sigma公司,将L-Arg溶解于生理盐水中,制成浓度为150 mg/mL注射液[8]。miRNeasy Kit购自德国Qiagen公司,兔抗PDCD4抗体(Santa Cruz),PTEN抗体(美国Abcam),AKT抗体(美国Cell Signaling Technology),p-AKT抗体(美国 Cell Signaling Technology),蛋白样本提取试剂,BCA蛋白定量试剂盒SDS-PAGE凝胶制备试剂盒,Western Blot Kit(ECL发光试剂盒)均购自美国pierce司,HRP标记的抗大鼠、抗兔IgG、免疫组织化学试剂盒购自武汉博士德生物公司,大鼠MPO(Myeloperoxidase,MPO,髓过氧化物酶),酶联免疫吸附剂测定法(ELISA)检测试剂盒构自南京建成生物公司。
1.3研究方法
1.3.1 IRI模型及左旋精氨酸预处理 构建大鼠IRI模型及L-Arg预处理模型,即建立缺血再灌注模型24 h和0.5 h之前,尾静脉注射L-Arg(250 mg/kg)[8-9]。一共分为sham组(假手术组)、IRI组、生理盐水+IRI组、L-Arg+IRI组,每组6只大鼠。分别于手术后4、8、12、24、48、72和96 h收集每组大鼠的血标本和肾脏组织。
1.3.2 大鼠体内敲低miRNA-21水平 L-Arg+IRI组大鼠在L-Arg预处理前,参考Zhang等[10]的方法,按照剂量80 mg/kg的剂量给予腹腔内注射micrOFFTMmiRNA antagomiR-21及其对照物antagomiR-control连续注射3 d。
1.4检测指标
1.4.1 血尿素氮(BUN)、肌酐(Scr)及髓过氧化物酶(MPO)水平测定 大鼠下腔静脉血离心后,取上清,全自动生化分析仪检测BUN及Scr水平,采用酶联免疫吸附实验(ELISA)测定MPO水平。
1.4.2 组织形态学观察 肾皮质组织取材后,10%福尔马林固定,48 h后脱水,常规制备石蜡切片后,行PAS染色。肾小管间质损伤程度评价采用Jabfonski评分法,根据盲法原则由病理医师完成。每个标本在200倍光镜下随机选取外髓质部10个不重叠视野,正常为0分,受损肾小管间质<25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分,以此作半定量分析并计算其均值,评分值越高代表损伤程度越重。
1.4.3 实时荧光定量PCR检测miRNA-21表达水平 提取不同分组肾脏组织的总RNA 60 ng,应用miRNA Isolation Kit分离小分子RNA,应用SuperScript Ⅲ Reverse Trandcriptase Kit逆转录合成cDNA,再应用定量PCR 仪进行定量miRNA-21的检测。样品目的基因的相对表达率(RQ)采用△△CT方法计算。RQ=2-△△CT。CT 表示反应的实时荧光强度显著大于背景值时的循环数。
1.4.4 Western blot 各组大鼠肾组织加蛋白质溶解液制成组织匀浆,然后4℃,39 000 r/min离心15 min,取上清液作为样品,蛋白测定试剂盒测定蛋白浓度。制备电泳胶,取20 μg组织匀浆在SDS-PAGE上电泳;电转膜2 h后,4℃下分别滴加PDCD4抗体(1∶1 000)、PTEN抗体(1∶500)、AKT抗体(1∶500)、p-AKT抗体(1∶2 000),在脱脂牛乳中孵育12~16 h;加辣根过氧化物酶标记的驴抗兔IgG二抗1 h;ECL增强发光和曝光。

2 结果
2.1L-Arg预处理能缓解大鼠肾缺血再灌注损伤IRI组BUN、Scr及MPO水平较假手术组(Sham组)明显升高(P<0.05)。L-Arg+IRI组与IRI组、生理盐水+IRI组相比,术后24 h Scr和BUN及MPO水平明显降低(P<0.05),见表1。

表1 各组大鼠肾缺血后不同再灌注时间BUN、Scr、MPO水平变化
注:与Sham组比较,*P<0.05;与IRI组比较,△P<0.05; 与生理盐水+IRI组比较,#P<0.05。
2.2miRNA-21在L-Arg缓解大鼠肾缺血再灌注损伤中的作用荧光定量PCR结果显示,缺血再灌注4、8和12 h后,与Sham组比较,IRI组和L-Arg-IRI组miRNA-21表达水平未见明显变化;缺血再灌注24 h后,与IRI组比较,L-Arg+IRI组肾组织miRNA-21的表达水平明显上调(P<0.05)。L-Arg预处理后12 h,miRNA-21表达水平开始升高,48 h后水平到达峰值,此后L-Arg+IRI组miRNA-21表达水平开始下降,96 h后较峰值水平明显降低(P<0.05),但仍然明显高于IRI组水平(P<0.05),见图1。
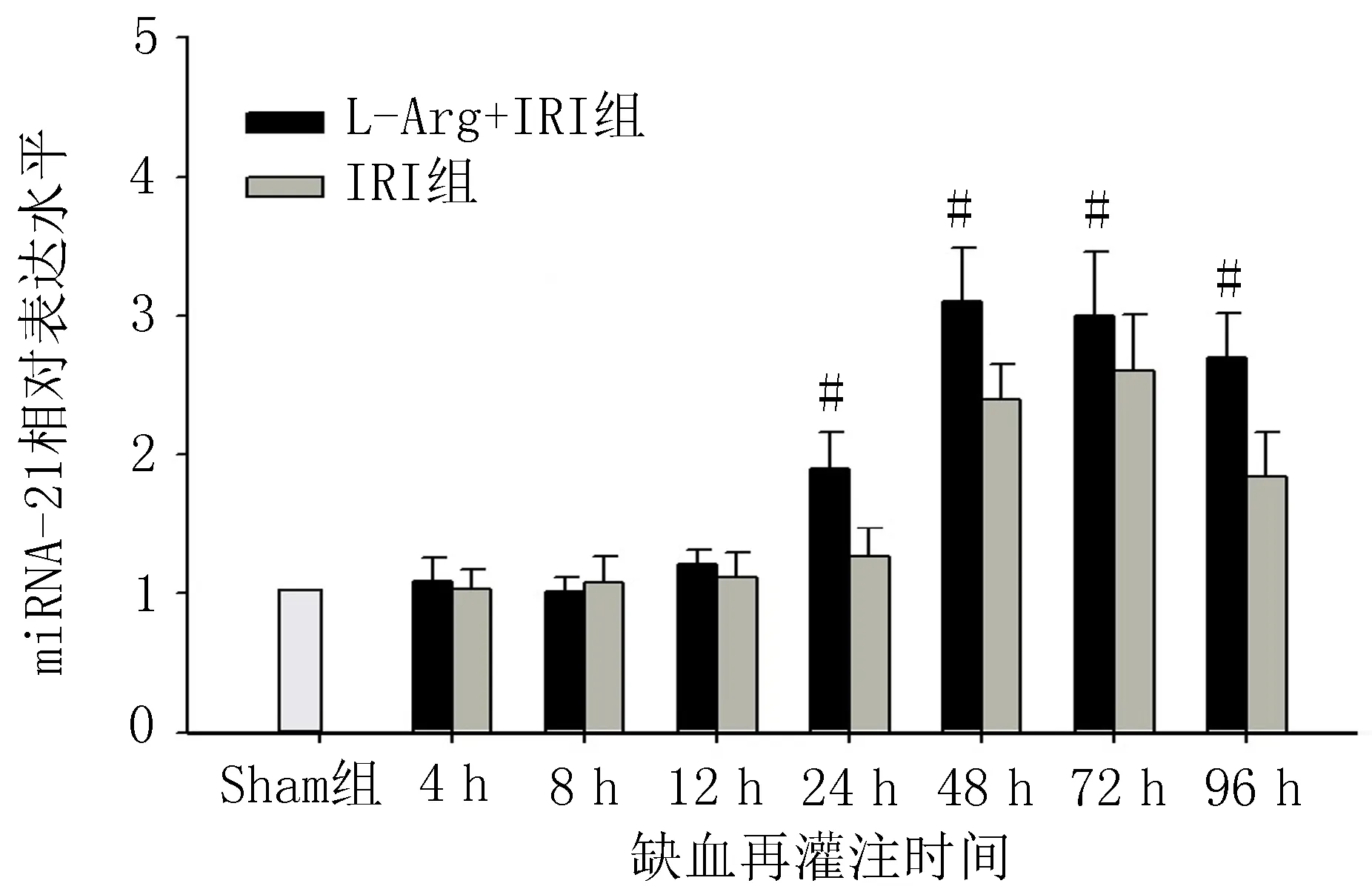
注: 与IRI组比较, #P<0.05。
IRI组、L-Arg+IRI组大鼠在antagomiRNA-21处理后,肾组织miRNA-21水平明显降低(P<0.05),见图2。

注: *P<0.05。
antagomiRNA-21+L-Arg+IRI组大鼠在IRI 12 h后BUN水平较 L-Arg+IRI组和antagomiR-control+L-Arg+IRI组明显升高(P<0.05),48 h达到达顶峰(P<0.05)此后水平未见明显下降;而 L-Arg+IRI组和antagomiR-control+L-Arg+IRI组相比无明显变化,24 h后水平开始下降,见图3。antagomiRNA-21+L-Arg+IRI和L-Arg+IRI组比较,肾小管上皮细胞坏死程度增加,Jabfonski评分值明显升高(P<0.05),见图4。结果表明,敲低miRNA-21可抑制L-Arg对大鼠肾缺血再灌注损伤的保护作用,加重缺血再灌注损伤。
2.3miRNA-21在L-Arg预处理保护肾缺血再灌注损伤中的作用L-Arg组大鼠使用antagomiRNA-21敲低miRNA-21后,肾组织PDCD4 和PTEN蛋白水平明显升高,p-Akt水平明显下调,而Akt水平未见明显变化;提示L-Arg能缓解肾缺血再灌注损伤,减轻细胞凋亡的作用,作用机制可能为上调miRNA-21表达后激活Akt途径进而下调PDCD4和PTEN的表达,见图5。

注: 与L-Arg+IRI组比较, *P<0.05。
3 讨 论
一氧化氮(NO)参与多种生理调节过程,如内皮依赖性血管舒张功能,炎症反应,神经传递,细胞介导的免疫反应。在动物实验中发现,NO能使肾出球小动脉血管舒张,有助于利尿,尿钠排泄,增加肾小球率过滤。L-Arg/NO途径功能的缺失在急性肾衰竭(ARF)的病理机制中起到重要作用。多种细胞类型之间的相互作用参与了缺血性急性肾衰竭的病理生理过程。NO的前体,特别是L-Arg,对缺血再灌注损伤组织有保护作用[11]。

注: *P<0.05。
本研究发现,L-Arg预处理能减轻肾小管上皮细胞损伤,抑制细胞凋亡,通过保护肾功能,降低血肌酐和尿素氮水平,从而发挥对大鼠肾缺血再灌注损伤大鼠的保护作用。L-Arg通过增加大鼠肾缺血再灌注后miRNA-21的表达水平,从而减轻缺血再灌注对肾脏的损伤。
MPO是中性粒细胞的功能标志和激活标志,其活性反应中性粒细胞的浸润程度,可导致氧化应激和氧化性组织损伤[12]。L-Arg预处理后,与IRI组比较,肾脏组织内MPO水平明显降低,说明L-Arg预处理对大鼠肾缺血再灌注损伤的保护作用原因在于可减轻再灌注后的氧化性损伤和炎性反应。
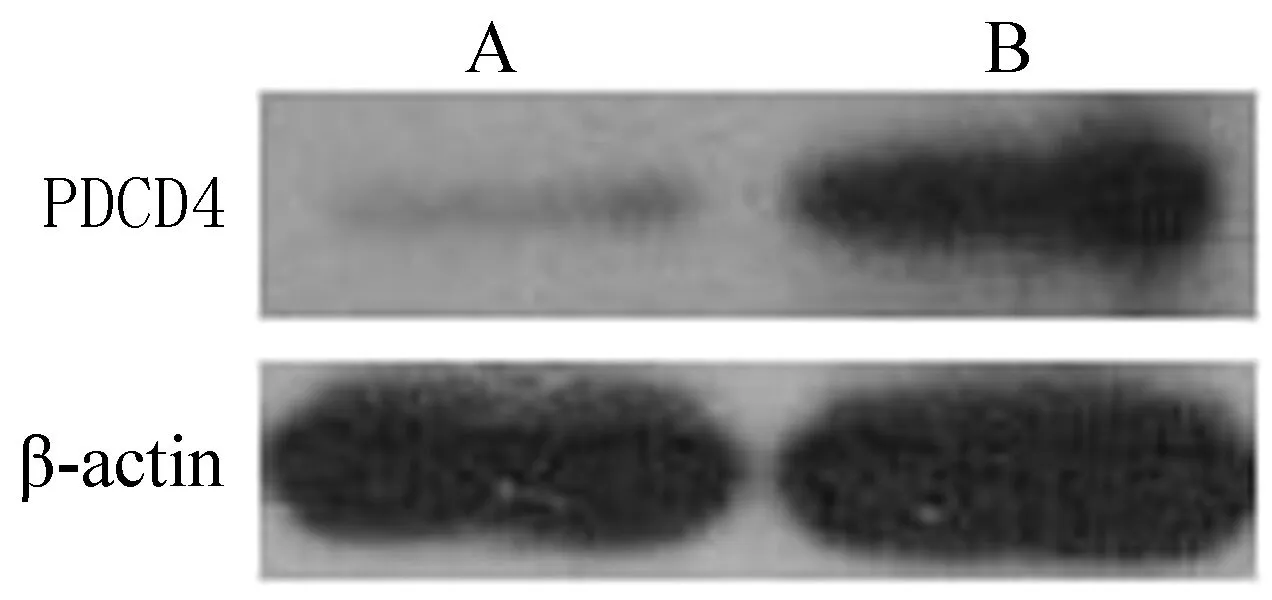


注:A:L-Arg+antagomiR-control+IRI; B:L-Arg+antagomiRNA-21+IRI
大鼠肾缺血再灌注后,肾组织miRNA-21表达水平上调,急性肾损伤病人尿液miRNA-21水平增加[13]。我们在前期研究中发现,miRNA-21在肾缺血再灌注损伤的不同阶段及不同缺血时间会发生不同程度的表达量变化,有可能成为肾缺血再灌注损伤的潜在诊断指标[9]。Yin等[14]在研究中发现,给予大鼠注射化学合成的外源性miRNA-21后,能保护心脏缺血再灌注损伤。在本次研究中,我们发现miRNA-21表达水平的上调是L-Arg预处理保护肾缺血再灌注损伤的主要因素,当合并给予antagomiRNA-21后,miRNA-21诱导的肾保护作用被拮抗。
miRNA-21作为抗凋亡因子,能反向调节一些凋亡基因,如PTEN和PDCD4。PDCD是癌细胞凋亡的重要介质,进来研究发现miRNA-21通过下调PDCD4抑制细胞凋亡[15-16]。PTEN是拮抗PI3K-AKT信号的必要条件,PTEN通过将细胞膜上的PIP3去磷酸化生成PIP2,进而拮抗PI3K介导的细胞生长、代谢、增殖和存活信号。缺血预处理通过肾组织磷酸化Akt和Bad表达水平增加,激活Akt信号途径减低缺血再灌注损伤引起的细胞凋亡[17]。本研究发现敲低大鼠肾组织miRNA-21水平能显著上调PTEN和PDCD4,从而下调p-Akt, 导致肾小管上皮细胞凋亡增加,加重肾缺血再灌注损伤。
总而言之,本研究结果表明L-Arg是一种有效的miRNA-21诱导剂,miRNA-21水平上调后通过调控凋亡前体靶点PDCD4, PTEN及Akt信号途径对肾缺血再灌注损伤产生保护作用,为肾脏缺血再灌注损伤的干预措施,以及肾移植围手术期综合治疗以及新型分子靶向免疫药物研发提供新的理论基础。
[1] NIGWKAR S U, KANDULA P, HIX J K, et al. Off-pump coronary artery bypass surgery and acute kidney injury: A meta-analysis of randomized and observational studies[J]. Am J Kidney Dis,2009,54(3):413-423.
[2] JONES D R, LEE H T. Perioperative renal protection[J]. Best Pract Res Clin Anaesthesiol,2008,22(1):193-208.
[3] OU Z J,WEI W,HUAND D D,et a1.L-arginine restores endothelial nitric oxide synthase-coupled activity and attenuates monocrotaline induced pulmonary artery hypertension in rats[J].Am J Physiol Endocrinol Metab,2010,298(6):E1131-E1139.
[4] ABELLA V,VALLADARES M,RODRIGUES T, et al. mir-203 regulates cell proliferation through its influence on hakai expression[J]. PLoS One,2012,7(12) :e52568.
[5] CHEN Q, KONG L, XU X, et al.Down-regulation of microRNA-146a in the early stage of liver ischemia-reperfusion injury[J]. Transplant Proc,2013,45(2):492-496.
[6] ZHU F, LIU J L, LI J P, et al.MicroRNA-124 (miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion[J]. J Mol Neurosci,2014,52(1):148-155.
[7] YANG Q,YANG K,LI A,et al.microRNA-21 protects against ischemia-reperfusion and hypoxia- reperfusion-induced cardiocyte apoptosis via the phosphatase and tensin homolog/Akt-dependent mechanism[J].Mol Med Rep,2014,9(6) :2213-2220.
[8] 马龙,吴昆,马明福,等.L-Arg+IRI对老龄大鼠缺血再灌注损伤的保护作用[J].华南国防医学杂志,2014,28(2):89-93.
[9] 马龙,吴昆,刘坤,等.miRNA表达谱在大鼠肾缺血再灌注损伤过程中的变化[J].中华医学杂志,2015,95(19):1488-1492.
[10] ZHANG Y,ZHANG T,MA X,et al.Subconjunctival injection of antagomiRNA-21 alleviates corneal neovascularization in a mouse model of alkali-burned cornea[J].Oncotarget,2017 Feb 14;8(7):11797-11808.
[11] SENBEL A M,OMAR A G,ABDEL-MONEIM L M,et al.Evaluation of L-arginine on kidney function and vascular reactivity following ischemic injury in rats: Protective effects and potential interactions[J].Pharmacological Reports,2014,66(6):976-983.
[12] 程江霞,彭晓红,赵彬,等.右美托咪定联合浅低温对新生大鼠全脑缺血再灌注损伤的影响[J].中华麻醉学杂志,2015,35(1):107-109.
[13] SHAPIRO M D,BAGLEY J,LATZ J,et al.MicroRNA expression data reveals a signature of kidney damage following ischemia reperfusion injury[J].PLoS One,2011,6(8):e23011.
[14] YIN C, WANG X, KUKREJA R C. Endogenous microRNAs induced by heat-shock reduce myocardial infarction following ischemia-reperfusion in mice[J]. FEBS Lett, 2008,582(30):4137-4142.
[15] BRONNUM H,ANDERSON D C,SCHNEIDER M,et al.miRNA-21 promotes fibrogenic epithelial-to-mesenchymal transition of epicardial mesothelial cells involving programmed cell death 4 and sprouty-1[J].PLoS One,2013,8(2) :e56280.
[16] MA X,KUMAR M,CHOUDHURY S N,et al.loss of the miRNA-21 allele elevates the expression of its target genes and reduces tumorigenesis[J].Proc Natl Acad Sci USA,2011,108(25):10144-10149.
[17] ISRAELY E, GINSBERG M, NOLAN D, et al. Akt suppression of TGF beta signaling contributes to the maintenance of vascular identity in embryonic stem cell-derived endothelial cells[J].Stem Cells,2014,32(1):177-190.
