基于医院集中监测对参麦注射液临床用药安全性的再评价研究
2018-02-05李惊雷郑君君马松林
李惊雷,郑君君,张 曼,马松林,杨 凡
0 引言
参麦注射液在我院临床应用时间较长,且多年来其销售金额及用量稳居中药注射剂前列,广泛用于心血管内科、肿瘤内科、呼吸内科、神经内科及血液内科等临床科室。参麦注射液主要成分为红参和麦冬,药理学研究显示,参麦注射液具有抗休克、抗心律失常、强心、调节机体免疫力和抗炎等作用。循证医学研究显示,参麦注射液对冠心病、心肌梗死、慢性阻塞性肺炎、肿瘤患者辅助治疗、病毒性心肌炎等具有辅助治疗作用[1-5]。近年来,“鱼腥草注射液”、“茵栀黄注射液”、“清开灵注射液”等不良反应逐渐被公众所认知,使中药注射剂的安全性倍受医学界关注。参麦注射液说明书中对不良反应项描述过于简单,因此,对参麦注射液上市后安全性进行再评价有助于该药的临床推广应用。目前,多数有关参麦注射液药物不良反应的报道主要来自个案报道、文献分析等,由于样本量偏小,存在地域和时间的差异,使得研究结果说服力有限。本文采用医院集中监测法[6],对参麦注射液临床应用安全性进行再评价,为临床提供参考。
1 资料与方法
1.1 资料来源 2014年8月至2016年12月在我院使用参麦注射液的住院患者,年龄、性别、原患疾病等均不限。
1.2 方法 采用医院集中监测方法,对参麦注射液的临床用药进行研究,结合国家食品药品监督管理局药品不良反应监测中心的《药品不良反应/不良事件报告表》,制定参麦注射液临床安全用药及安全性监测表,采用Excel软件自制的数据提取表,对参麦注射液引发的疑似ADR及时进行跟踪评估,分别由2名临床药师和临床医生交叉性独立进行评价,遇到分歧时,及时请教高年资药学专家进行综合评价,详细记录确认为ADR的病历基本信息,包括患者基本信息(年龄、性别、原患疾病、药物及食物过敏史)和药物基本信息(单次用药剂量、给药频次、溶媒种类及体积、用药时间、联合用药、不良反应发生时间、临床表现、转归等)。
1.3 统计学方法 采用SPSS 19.0软件分析,用百分率(%)分析发生率;用构成比(%)分析不良反应严重程度的相对构成,组间差异性比较采用χ2检验,检验水准为P<0.05或0.01。
2 结果
2.1 一般资料 共纳入1 425例患者,发生不良反应34例,发生率为2.38%,其中男768例,发生不良反应22例,发生率为2.86%;女657例,发生不良反应12例,发生率为1.83%,ADR发生率与患者性别无显著相关性(P>0.05)。1 425例患者中,年龄最小为25岁,最大88岁,基本呈正态分布,结果显示,各年龄段不良反应发生率差异无统计学意义(P>0.05)。见表1。
2.2 原患疾病与不良反应 心肌梗死、冠心病和病毒性心肌炎是使用参麦注射液患者较多的原患疾病,分别占23.93%、20.14%和16.56%;肿瘤、慢性阻塞性肺疾病和心源性休克是ADR发生率较高的原患疾病,分别为5.59%、4.08%和3.92%。结果表明,肿瘤患者的ADR发生率显著高于其他原患疾病(P<0.05)。见表2。
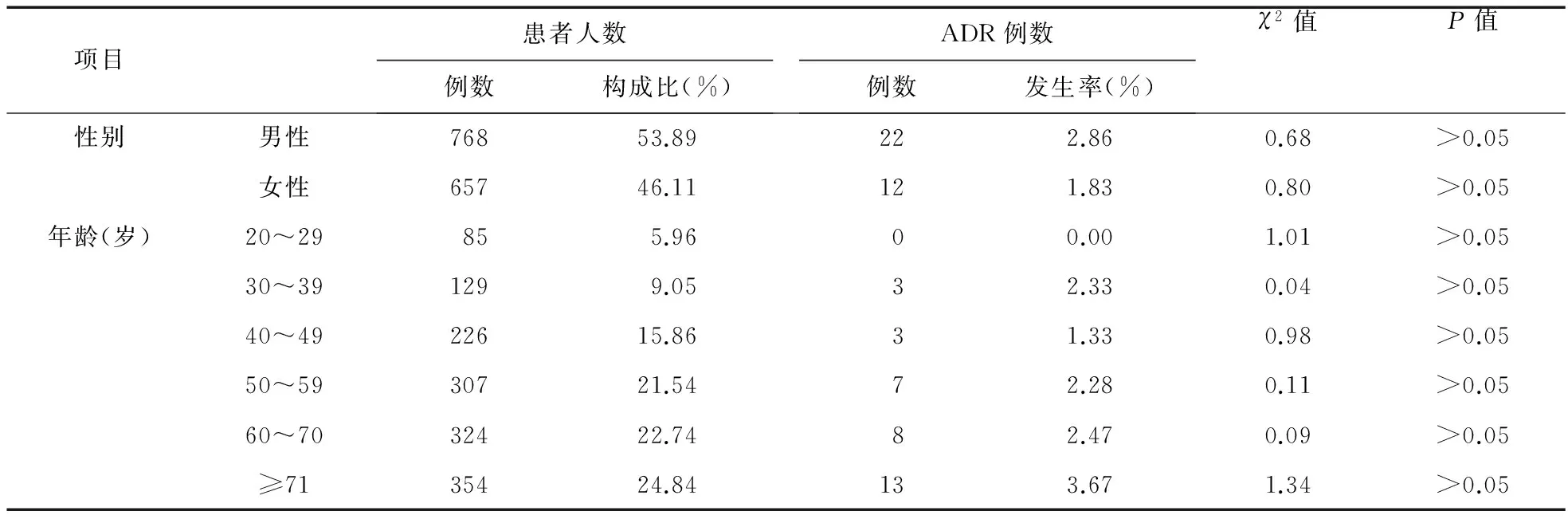
表1 参麦注射液致ADR的一般性特征
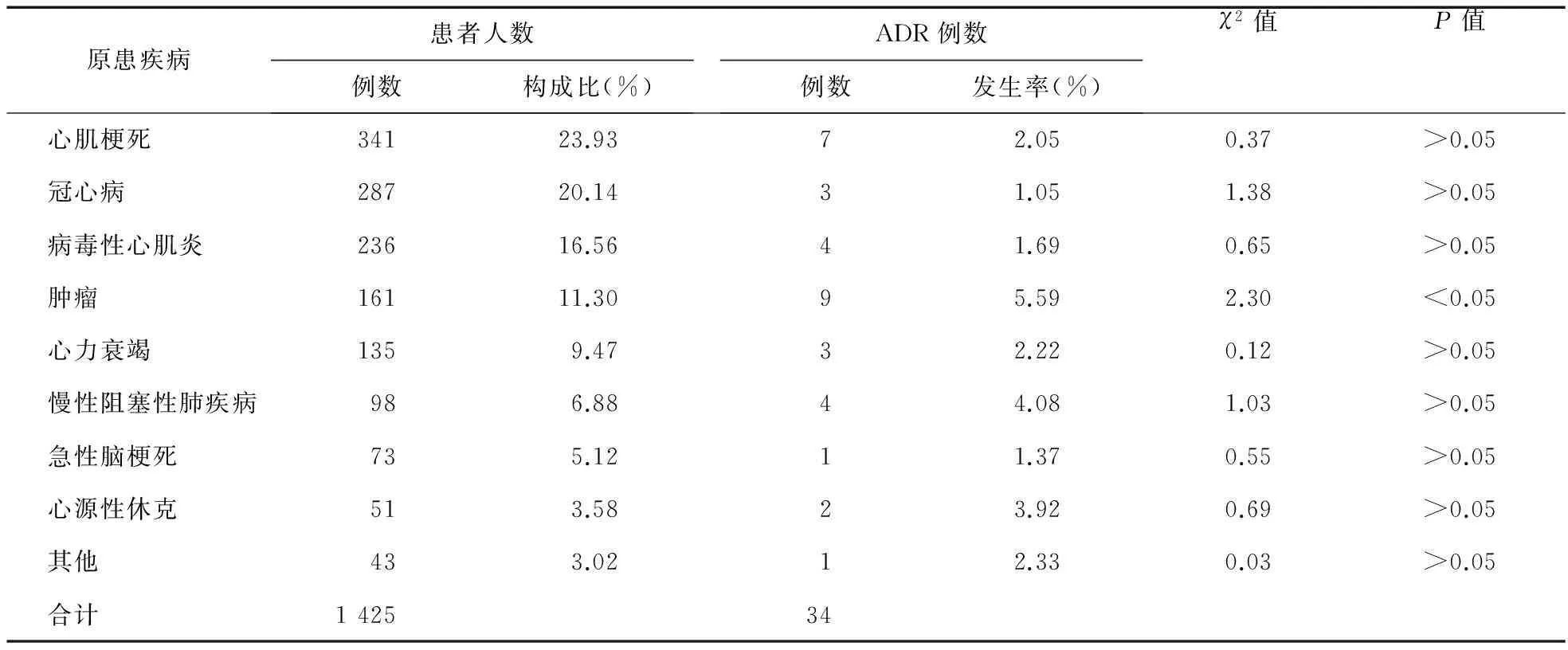
表2 参麦注射液致ADR与原患疾病相关性
2.3 用药时间与不良反应 34例ADR中,发生时间最短于首次用药15 min时,发生时间最长于累计用药18 d,平均用药时间(4.38±2.12)d。结果表明,用药时间≤1 d的不良反应发生率最大,≥12 d的最小,差异均有统计学意义(P<0.05)。见表3。
2.4 药物浓度与不良反应 所有患者溶媒均选择5%葡萄糖注射液,药物浓度最大为0.32 mL/mL(参麦注射液体积为80 mL,溶媒体积为250 mL),最小为0.08 mL/mL(参麦注射液体积为40 mL,溶媒体积为500 mL)。结果表明,给药浓度在0.08~0.32 mL/mL范围内,不良反应发生率差异无统计学意义(P>0.05)。见表4。
2.5 联合用药与不良反应 34例发生ADR的患者均合并1种以上药物,参麦注射液与中药注射剂和抗菌药物联合用药时易发生不良反应,分别占35.29%和26.47%。见表5。
2.6 不良反应主要累及器官及主要临床表现 参麦注射液致不良反应主要以皮肤及附件、中枢神经系统和呼吸系统损害常见,分别占32.35%、20.59%和17.65%。见表6。
2.7 转归 一般ADR经停药后症状即消失或明显好转,严重ADR停药后并给以相应对症干预措施后明显好转,无加重或死亡患者。
3 讨论
参麦注射液说明书中,其用法为:肌内注射,2~4 mL/次,1次/d。静脉滴注,20~100 mL/次(用5%葡萄糖注射液250~500 mL稀释后应用)。Logistic模型研究显示,参麦注射液不良反应可能与患者的性别、年龄、静脉滴注的速度有关,ROC曲线研究显示,参麦注射液不良反应的独立危险因素包括年龄分组(≥50)、用药总天数和单次用药剂量[7-8]。本研究结果显示,参麦注射液致不良反应发生率与患者性别、年龄、单次用药剂量(用药剂量在说明书常规范围内)等均无相关性。
本研究结果显示,几乎所有原患疾病均可能引发不良反应,其中肿瘤患者的不良反应发生率高于其他原患疾病,主要是因为肿瘤患者(特别是恶性肿瘤患者)常联合多种化疗药物,或长期反复使用某种化疗药物,使患者免疫力下降,对药物的代谢和耐受力下降。万宇等[9]研究显示,参麦注射液辅助治疗非小细胞肺癌引发的不良反应发生率为4.32%,患者病理类型、分期、同治疾病、化疗史、靶向治疗史、参麦注射液的剂量、用法及溶媒介质、合并用药等因素均与不良反应的发生无明显的相关性。参麦注射液与中药注射剂和抗菌药物联合用药发生不良反应较多,提示尽量避免联合用药。文献报道,使用溶媒冲管或更换输液器能有效减少中药注射剂与其他药物联用时发生不良反应,因此,参麦注射液必须联用抗菌药物或中药注射剂时,用5%葡萄糖注射液冲管或更换输液器[10]。不良反应主要以皮肤及附件、中枢及神经系统和呼吸系统损害常见,分别占32.35%、20.59%和17.65%。向东等[11]对1 533例参麦注射液致不良反应进行研究,结果显示,临床表现主要为皮肤及其附件损害(20.22%)、全身性损害(18.74%)、中枢及外周神经系统损害(17.78%)常见,这可能是由于不同厂家制剂工艺不完全相同有关。整个用药期间均有可能发生不良反应,其中用药时间≤1 d的不良反应发生率最高,≥12 d的最低,这可能是因为参麦注射液致不良反应以皮肤损害和头痛、头晕等不适常见,这类不良反应多为速发反应,多集中于首次用药30 min内;另一方面,一旦发生不良反应,临床首选停止使用该药。用药12 d后不良反应发生率最小,可能是因为患者此时已经产生耐受性,可耐受某些轻微不良反应。
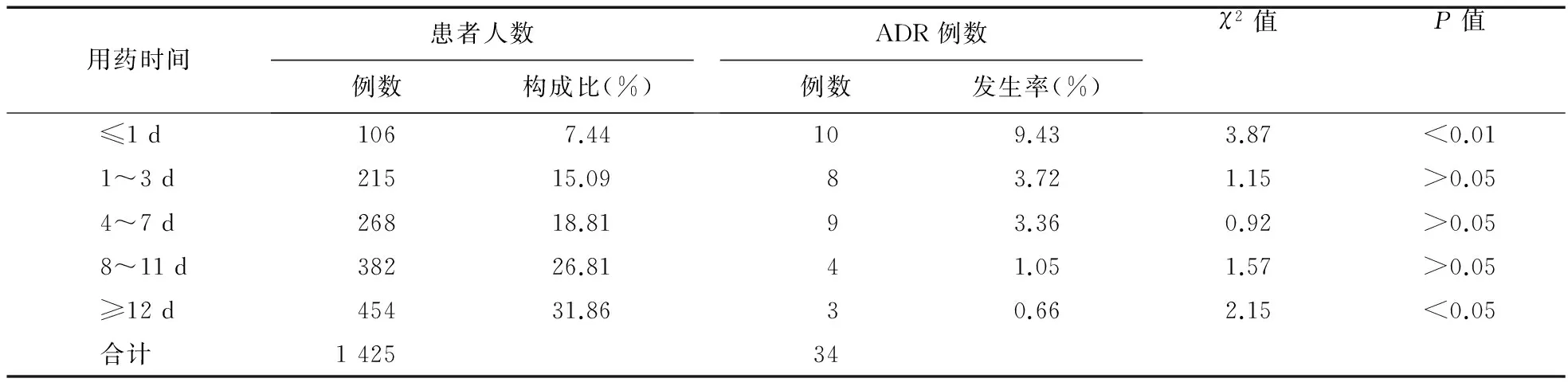
表3 参麦注射液致ADR与用药时间相关性
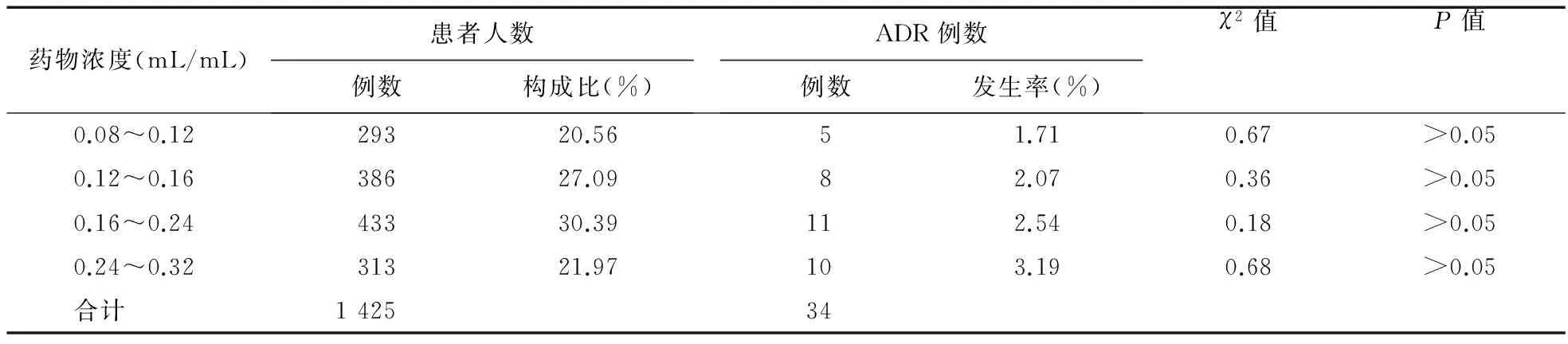
表4 参麦注射液致ADR与给药浓度相关性
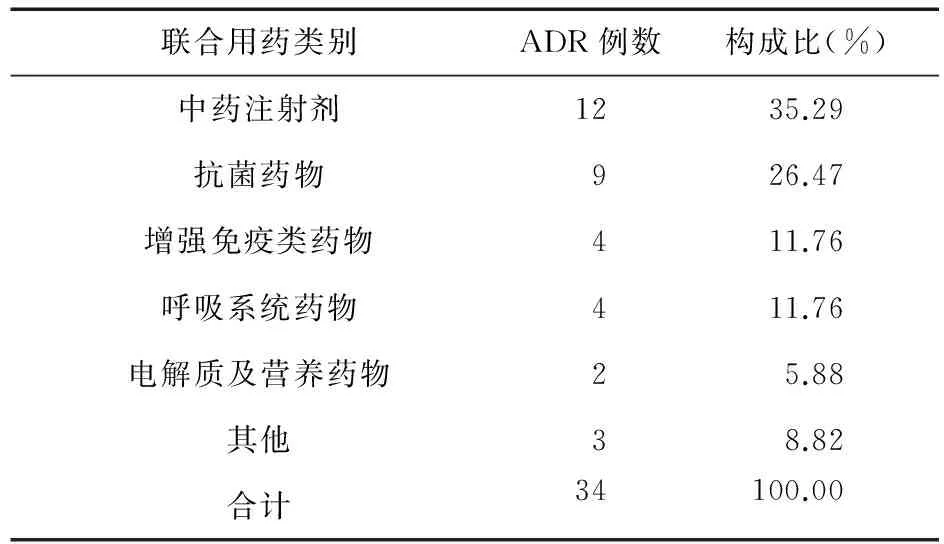
表5 参麦注射液致ADR与联合用药相关性
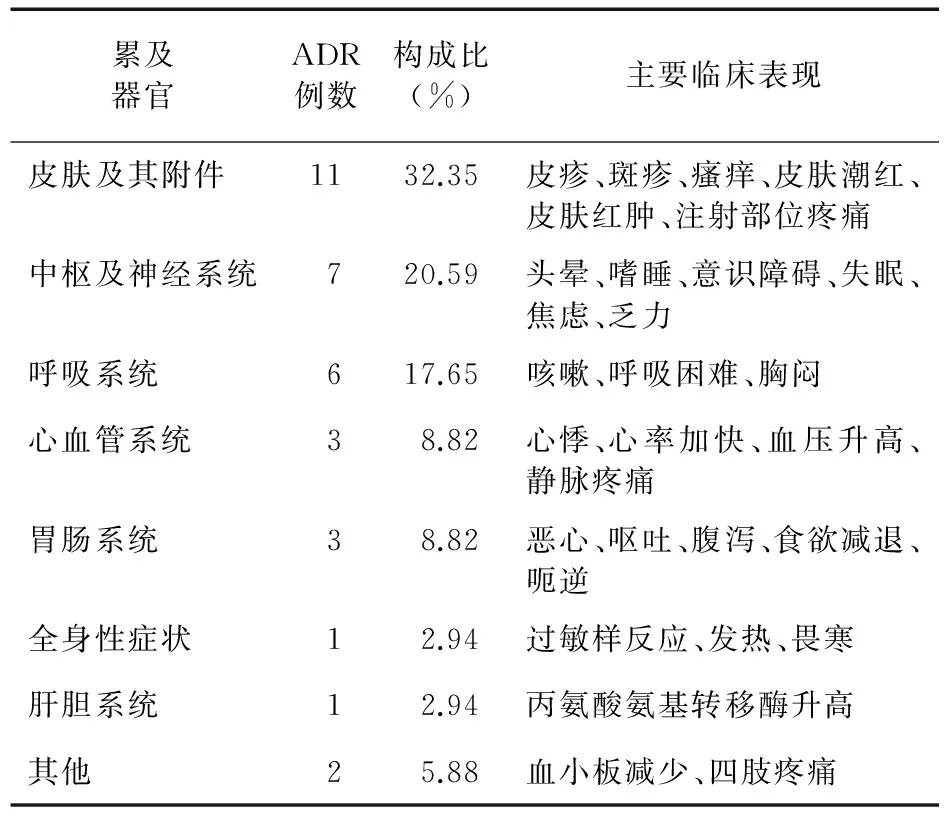
表6 参麦注射液致ADR主要累及器官及主要临床表现
参麦注射液自上市以来,先后进行两次说明书修订,在2013年修订的说明书中,不良反应的描述为“全身性损害、心血管系统、神经系统、呼吸系统、消化系统和泌尿系统不良反应均为十分罕见,皮肤损害不良反应为罕见”,本研究发现的转氨酶升高、四肢疼痛、血小板下降及血尿等不良反应均未见描述。因此,建议生产厂家及时收集药物不良反应信息,完善药品说明书。
本研究也存在一定缺陷,本文非多中心研究,样本量明显偏少,导致发生不良反应的阳性案例也较少,因此,监测结论和评价意见可能存在偏差;本文纳入时间段为2014-2016年,在此时间段之外的病例无法纳入,因此,监测结果具有一定时限性,缺乏一定的连续性;本研究纳入的参麦注射液的生产厂家为神威药业有限公司,而我国有数十家生产参麦注射液的制药企业,各生产厂家的制剂工艺不完全一致,导致发生不良反应的特点不尽相同,因此,不具有普遍性。因此,准确结论尚需大规模、多中心、大样本量的研究去验证。
[1] 王震,鞠建庆,李运伦.参麦注射液对急性心肌梗死病死率影响的系统评价及试验序贯分析[J].中国实验方剂学杂志,2015,21(19):189-193.
[2] 朱亚兰,郭佳奕,包美蓉.参麦注射液辅助化疗治疗恶性肿瘤疗效的Meta分析[J].中国药房,2015,26(12):1654-1657.
[3] 夏蕾,王丽霞.参麦注射液辅助治疗慢性阻塞性肺疾病的疗效与安全性的Meta分析[J].中国药房,2013,24(36):3384-3388.
[4] 李洵,吴樱.参麦注射液辅助治疗病毒性心肌炎的Meta分析[J].中药材,2012,35(7):1185-1188.
[5] 陈弘东,谢雁鸣,王连心,等.参麦注射液辅助治疗慢性心力衰竭的有效性及安全性系统评价[J].中国中药杂志,2014,39(18):3650-3661.
[6] 王连心,谢雁鸣,王志飞.建立中药注射剂上市后临床安全性医院集中监测网络的思考[J].中国中药杂志,2012,37(18):2692-2694.
[7] 丁峰,石庆平,姜晓东,等.Logistic模型和ROC曲线对参麦注射液致不良反应的预测分析[J].中国中药杂志,2015,40(7):1404-1409.
[8] 石庆平,姜晓东,桑冉,等.参麦注射液不良反应影响因素Logistic回归分析[J].中国医院药学杂志,2013,33(7):587-589.
[9] 万宇,王辉,张菡,等.参麦注射液在非小细胞肺癌治疗中不良反应的回顾性研究[J].中华全科医学,2015,13(10):1627-1629.
[10]郑昆,王金玉,李艳玲,等.2013~2014年我院中药注射剂引发的不良反应调查分析[J].中国医药科学,2015,5(17):64-67.
[11]向东,黄渊,邓丽,等.参麦注射液1533例临床不良反应/事件分析[J].中国医院药学杂志,2017,37(4):393-396.
