精液凝固蛋白Ⅰ活性片段的精子抑制活性分析*
2018-02-05韩飞孙凯赵晖
韩飞,孙凯,赵晖
(1.昆明医科大学,云南 昆明 650500;2.云南省第二人民医院,云南 昆明 650021;3.昆明医科大学第一附属医院,云南 昆明 650032)
在精液的液化过程中,精液中具有抑制精子活动作用的凝固蛋白-精液凝固蛋白(Semenogelin,Sg)被来源于前列腺的蛋白激酶分解,其主要由精囊分泌合成,存在于人类精浆中,并且具有抗菌活性[1]。SgⅠ有助于精子凝固,与Zn2+作用后可以通过前列腺特异性抗原(prostate specific antigen,PSA)被蛋白酶水解,从而导致在射精后精子的释放。SgⅠ在射精后与附睾蛋白酶抑制剂-附睾蛋白激酶结合,作为前列腺特异性抗原的生理底物,与SgⅡ及纤维连结蛋白Fibronectin结合形成网状结构共同限制精子的运动。而后与由前列腺分泌的Zn2+结合,释放蛋白C抑制因子,从而失去对SgⅠ的保护作用。SgⅠ、SgⅡ及Fibronectin随即被水解,从而解除了SgⅠ对精子活动的抑制作用,精子运动逐渐活跃。精子从凝固物中逸出对精子运动及在女性生殖道进一步获能具有重要的意义[2]。精液SgⅠ在生理条件下对精子活动抑制作用的相关片段是本次研究的重点。人们认为这种抑制活性与精子活力低下的弱精子症患者的不育有关。
1 资料与方法
1.1 主要试剂和仪器
1.1.1 试剂PET-32a载体(美国Clontech公司),Taq聚合酶(DR001A)、EcoR Ⅰ(D1040A)和KpnⅠ(D1068A)限制性内切酶、T4DNA连接酶(D2011A)、Wide-Range(D520A)、DL1000(D526A)、DL2000(D501A)DNA Marker、DH5α感受态细胞(D9057)、6×R Loadingbuffer(D604)、cDNA-链合成试剂盒(D6110A)购自日本TaKaRa公司,TritonTMX-100(X100)、TWEEN®20(P9416)、Prestained Protein Molecular Weight Marker(SM0671)购自美国Sigma公司,质粒小抽试剂盒(DP103)、总RNA提取试剂盒(DP419)、2×Tag PCR MasterMi(KT201)、普通琼脂糖凝胶DNA回收试剂盒(DP209)购自北京天根生物公司,甲醇、乙醇、丙三醇、三氯甲烷等其他试剂均为国产分析纯引物合成及DNA测序由深圳华大基因公司完成。
1.1.2 仪器 超净工作台、Forma Class Ⅱ A2 Biological Safety Cabinet、精密pH计、ORION 3 STAR PH PORTABLE购自美国Thermo Electron Corporation公司,激光共聚焦显微镜(日本Olympus公司),电泳仪、Bio-Rad powerpacTMuniversal、凝胶成像分析系统、Bio-Rad Gel Doc XR+购自美国Bio Rad公司,低温冷冻离心机、Microfuge 22R centrifuge购自美国Beckman Conlter公司,超速冷冻离心机CR21G(日本HITACHI公司),手掌离心机C1301-230V(韩国Labnet公司),PCR仪(日本KaTaRa公司),分光光度仪GeneQuant 1300 Classic(美国GE公司)。
1.2 方法
1.2.1 重组Sg的制备 用分子克隆技术从精囊中提取精囊组织总RNA,经逆转录成cDNA,设计特异性的引物,通过PCR扩增Sg的N端和C端片段的DNA,将DNA插入质粒载体PET32a,筛选出序列正确的阳性克隆,转染BL21大肠埃希菌,通过诱导表达重组人类Sg的N端和C端片段,用镍柱亲和纯化重组蛋白,通过盐透析恢复活性,通过梯度密度离心法得到重组Sg。
1.2.2 重组Sg对精子运动的抑制实验 ①精子制备:实验所用10例标本均由昆明医科大学第一附属医院男性科实验室提供。通过手淫法收集禁欲3~7 d后的新鲜精液标本,水浴箱内37℃液化30min,精液分析符合WHO标准。以Percoll不连续密度梯度离心法筛选活力优良的精子。②计算机辅助精液分析:通过计算机辅助精液分析,记录实验精子的总体活率、快速前向运动精子率(A级),慢速或呆滞前向运动精子率(B级)、精子尾部鞭打频率(beat cross frequency,BCF)、精子平均曲线运动速度(curvilinear velocity,VCL)、运动前向性(Straightness,STR)及平均侧摆幅 值(amplitude of lateral head displacement,ALH)。③精子活动实验:本实验选取200 pg/s为最佳作用浓度,共收集10份精液,按照200 pg/s浓度,用重组的C端精液凝固蛋白(Sg164~283)和N端精液凝固蛋白(Sg 24~163)与精子进行作用。
1.3 统计学方法
采用SPSS 12.0软件进行数据分析,计量资料以均数±标准差(±s)表示,采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 对照组实验前后精子活性抑制结果比较
对照实验中仅加入人输软管培养液。对照组90 min后精子活率、A级、B级、VCL、VSL、BCF、ALH、STR与初始值比较,差异无统计学意义(P>0.05)。见表1。
2.2 实验组实验前后Sg 24~163抑制精子活性结果比较
实验组精子各运动参数与初始值相比,差异有统计学意义(P<0.05),Sg 24~163对精子的活动具有抑制作用。见表2。
2.3 实验组实验前后Sg 164~283抑制精子活性结果比较
实验组各项运动参数与初始值相比,差异有统计学意义(P<0.05),Sg164~283对精子运动存在一定的抑制作用。通过对Sg分解片段的进一步分析,精液液化过程中,射精后的Sg164~283与精子表面的表面蛋白Eppin相结合的片段受到保护,Cys~239是Sg164~283与Eppin结合的唯一位点,当位点突变时,SgⅠ失去了对精子活性的抑制作用,因此认为Cys~239可能对SgⅠ的精子活性的抑制有着重要的作用。见表3。
表1 对照组实验前后精子活性抑制结果比较 (±s)

表1 对照组实验前后精子活性抑制结果比较 (±s)
时间 活率/% A级/% B级/% VCL/(μm/s) VSL/(μm/s) BCF/(b/s) ALH/μm STR/%初始 81.20±4.21 51.20±10.38 15.20±8.25 35.52±6.25 23.58±6.23 14.56±5.23 5.32±0.85 77.56±1.96 90 min 后 76.23±5.69 48.56±12.36 16.35±7.23 36.23±5.56 26.39±5.98 18.03±3.23 4.89±0.65 74.36±2.23 t值 9.099 1.075 3.541 0.450 4.818 1.983 1.331 1.222 P值 0.096 0.936 0.412 0.425 0.365 0.338 0.985 0.501
表2 实验组实验前后Sg 24~163抑制精子活性结果比较 (±s)

表2 实验组实验前后Sg 24~163抑制精子活性结果比较 (±s)
时间 活率/% A级/% B级/% VCL/(μm/s) VSL/(μm/s) BCF/(b/s) ALH/μm STR/%初始 78.20±6.21 50.20±11.38 14.20±6.25 35.52±6.25 25.58±5.23 17.56±3.23 4.32±0.06 74.56±1.92 90 min 后 46.23±6.69 25.56±10.36 6.35±3.23 26.23±7.58 18.39±6.98 12.03± 3.23 2.89±0.05 62.36±2.22 t值 2.448 3.524 8.823 11.769 7.851 10.464 21.504 20.832 P值 0.000 0.000 0.011 0.032 0.020 0.031 0.000 0.001
表3 实验组实验前后Sg 164~283抑制精子活性结果比较 (±s)
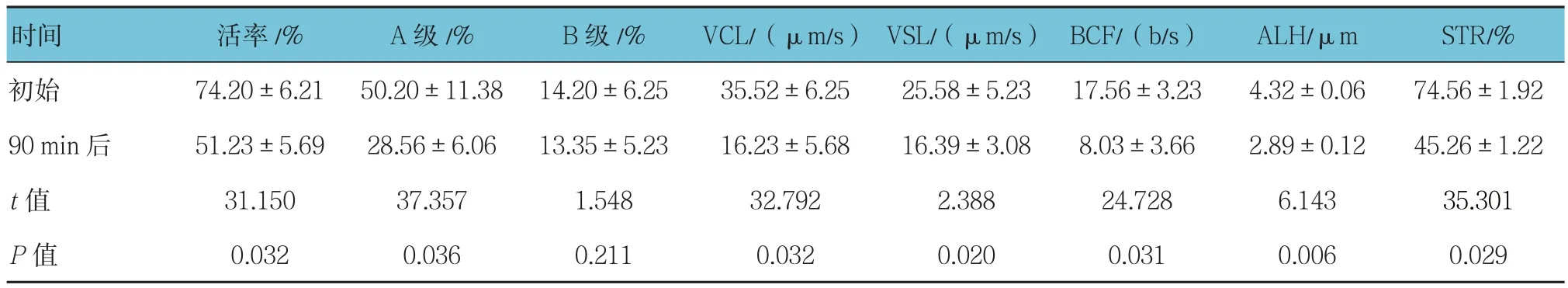
表3 实验组实验前后Sg 164~283抑制精子活性结果比较 (±s)
时间 活率/% A级/% B级/% VCL/(μm/s) VSL/(μm/s) BCF/(b/s) ALH/μm STR/%初始 74.20±6.21 50.20±11.38 14.20±6.25 35.52±6.25 25.58±5.23 17.56±3.23 4.32±0.06 74.56±1.92 90 min 后 51.23±5.69 28.56±6.06 13.35±5.23 16.23±5.68 16.39±3.08 8.03±3.66 2.89±0.12 45.26±1.22 t值 31.150 37.357 1.548 32.792 2.388 24.728 6.143 35.301 P值 0.032 0.036 0.211 0.032 0.020 0.031 0.006 0.029
3 讨论
附睾蛋白激酶(Eppin)由睾丸和附睾特异性分泌,存在于精子表面且含量丰富,在研究过程中被发现在精子活性抑制过程中有重要作用。Eppin蛋白是存在于灵长类(人类)精子一种表达良好的基本功能蛋白[3]。射精后,Eppin作为精液Sg的特异性结合受体,也是精子表面蛋白复合体(其他成分为乳铁转运蛋白、丛生蛋白、精液凝固蛋白)的一部分。该蛋白复合体能够调节前列腺特异性抗原蛋白酶的活性,从而促进精子液化。
Eppin中包含与精液SgⅠ结合的重要位点(氨基酸序列102~133片段),而与蛋白复合体中的乳铁蛋白结合部位也在同一区域内,故而说明Eppin在此蛋白质复合体中与其他蛋白质相互作用起重要作用[4]。不过,目前还有研究利用合成的SgⅠ和Eppin的氨基端及梭基端分子片段研究发现,射精后SgⅠ液化片段Sg 164~283结合在精子表面的Eppin第75~133氨基酸片段上,且SgⅠ分子结构中的半肤氨酸残基Cys~239是唯一的结合位点,将Cys~239用甘氨酸取代后,进行SgⅠ重组片段的精子活性抑制实验。另外有研究得出不一 样的结论,Cys~239才是对于精子活性抑制的决定性氨基酸,这与本研究的结论有差异,因目前关于精子活性研究均为体外研究并使用人工重组的衍生肽,这需要学者去进一步研究SgⅠ及其衍生肽对精子活动的影响。同时也有研究证明,Eppin的基因多态性与特发性男性不育症的易患相关[5]。
精液Sg在精液液化和精子获能的过程中通过直接参与精液凝固从而影响精子获得向前运动能力[6]。青春期后,Sg大多数由精囊上皮细胞特异性分泌。相关实验表明,大量的Sg抗原分布在精囊上皮细胞中,在精浆凝固中起重要作用的成分就是来源于精囊的Sg[7]。Sg包括SgⅠ和SgⅡ,在射精后的一定时间内精液的凝固是因为上述两者之间相互连接,从而抑制精子运动[8]。之后精液液化,精液凝固蛋白及纤维连接蛋白被PSA,在其他来源于前列腺的丝氨酸蛋白激酶作用下分解成小分子片段[8]。前列腺特异性抗原的生理底物就是精液凝固蛋白,并受Zn2+抑制呈无活性状态[8]。射精后,前体形式的前列腺特异性抗原因Zn2+失用被激活[8]。精液液化过程中,在PSA的作用下,精液获得向前运动和受精的能力[4]。精液SgⅠ水解后会产生具有多种生物学活性的片段。例如抗菌活性、抑制素样活性及促甲状腺激素释放激素样活性等。另外,Zn2+在精子核DNA结构的完整性和功能方面发挥着重要的作用[9],精子表面上SEMG1/EPPIN的相互作用也具有调节精子运动能力的功能[3]。所以精液Sg的分解片段,携带着多种功能。了解这些不同的生物学活性,对于研究精液液化的机制具有极为重要的意义。近年来,研究发现SgⅠ的部分片段与HIV感染也有着密切的联系[10]。
[1]LIU B, SONG Z, SU S, et al. Abnormal expression of Sg I is closely related to seminal vesiculitis[J]. Urology, 2016, 88 (Suppl 1):227.
[2]ISHIGURO H, IZUMI K, KASHIWAGI E, et al. Semenogelin I promotes prostate cancer cell growth via functioning as an androgen receptor coactivator and protecting against zinc cytotoxicity[J]. Am J Cancer Res, 2015, 15, 5(2): 738-747.
[3]O’RAND M G, SILVA E J, HAMIL K G. Non-hormonal male contraception: a review and development of an Eppin based contraceptive[J]. Pharmacol Ther, 2016 , 157: 105-111.
[4]SILVA E J, HAMIL K G, O’RAND M G. Interacting proteins on human spermatozoa: adaptive evolution of the binding of semenogelin I to EPPIN[J]. PLoS One, 2013, 8(12): DOI: 10.1371/journal.pone.0082014.
[5]丁新良, 张洁. Eppin+基因多态性与原发性男性不育的相关性研究[J]. 中华预防医学杂志, 2014, 48(12): 1072-1077.
[6]易成, 何仁松, 赵晖, 等. 精液凝固蛋白对精子运动抑制机制的研究进展[J]. 中华男科学, 2010, 11: 1023-1026.
[7]胡辰, 赵晖. 精囊蛋白Semenogelin Ⅰ小分子片段的功能[J]. 中华男科学, 2013, 19(2): 169-172.
[8]ISHIGURO H, IZUMI K, KASHIWAGI E, et al. Semenogelin I promotes prostate cancer cell growth via functioning as an androgen receptor coactivator and protecting against zinc cytotoxicity[J]. Am J Cancer Res, 2015, 5(2): 738-747.
[9]SHARMA N, VISHWANATH S, PATEL B K. Recombinant human Semenogelin-1 (Sg1) and Sg1 (1-159) form detergent stable amyloid like aggregates in vitro[J]. Protein Pept Lett, 2016, 23(1):87-96.
[10]FRENCH K C, ROAN N R, MAKHATADZE G I. Structural characterization of semen coagulum-derived SEM1 (86-107)amyloid fibrils that enhance HIV-1 infection[J]. Biochemistry,2014, 53(20): 3267-3377.
