Ⅱ型和Ⅲ型儿童紫癜性肾炎肾小管早期损伤的评价
2018-02-05杨晓青黄岩杰张龙真梅晓峰李金刚毕亮亮翟文生宋纯东
杨晓青,黄岩杰,张龙真,李 静,梅晓峰,李金刚,毕亮亮,翟文生,宋纯东
河南中医药大学第一附属医院儿科 郑州 450000
紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN)是儿童最常见的继发性肾小球肾炎,是过敏性紫癜(Henoch-Schönlein purpura,HSP)最严重的并发症,其肾脏受累的严重程度直接影响HSP的预后[1]。国际儿童肾病研究协会(International Study of Kidney Disease in Children,ISKDC)分类标准根据肾小球病变,将HSPN分为Ⅰ~Ⅵ型,未对肾小管、间质病变进行分级描述。临床实践中通过病理形态学检查发现HSPN Ⅲ型以上的病变可见不同程度的肾小管间质损伤,而HSPN Ⅰ~Ⅱ型未见明显肾小管间质病变。那么,在HSPN出现显微镜下可见的肾小管病理损伤前是否已经存在一定程度的肾小管功能障碍和上皮细胞的损伤,目前尚缺乏大样本的研究报道。肾小管损伤时尿中会出现一系列小分子蛋白,如α1微球蛋白(Alpha-1-microglobulin,α1m)、视黄醇结合蛋白(retinol-binding protein,RBP)和N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)。尿α1m(相对分子量为27 kD)和RBP(相对分子质量为21 kD)属于小分子蛋白,这些小分子蛋白可自由透过肾小球滤过膜,几乎全部被肾小管重吸收,当肾脏近端小管受损时,对小分子蛋白的重吸收功能下降,尿中α1m和RBP排泄相应增加,可反映近端肾小管重吸收功能障碍。NAG酶是一种大分子蛋白,相对分子质量为130 kD,不能自由从肾小球滤过,主要存在于近端小管上皮细胞溶酶体内,当近端小管上皮细胞破坏时,尿中NAG酶升高。本研究通过检测正常儿童、HSP患儿、HSPN患儿尿中α1m、RBP和NAG酶水平,结合肾脏病理评价尿小分子蛋白和NAG酶是否能反映HSPN早期肾小管的损伤。
1 对象与方法
1.1研究对象与分组从2015年7月至2016年2月河南中医学院第一附属医院儿科肾脏病区住院的患儿中收集病例。按照中华医学会儿科分会肾脏病学会组《紫癜性肾炎的诊治循证指南》[2]和ISKDC的病理分类标准[3]对HSPN患儿进行临床分型和病理分型。入选患儿年龄2~18(8.8±3.2)岁,其中男112例,女88例。共获取HSP患儿99例(HSP组),年龄2~16(8.0±3.3)岁,其中男58例,女41例;HSPN患儿101例(HSPN组),年龄3~18(9.3±3.0)岁,其中男54例,女47例;临床分型:单纯蛋白尿型2例,血尿和蛋白尿型90例,肾病综合征型9例;病理分型:Ⅱa型21例、Ⅱb型13例、Ⅲa型41例、Ⅲb型26例。收集同期33例同龄正常儿童作为正常对照组。患儿组与正常对照组性别、年龄比较差异无统计学意义(P>0.05)。
1.2HSPN肾组织活检均在所有患儿家长知情同意后,在B超引导下行经皮肾脏穿刺活检术,获取的肾小球数量≥10个,标本经苏木精伊红(HE)、过碘酸雪夫反应(PAS)、六胺银(PASM)、Masson染色,行光镜检查,免疫荧光检查包括IgA、IgM、IgG、C3、C4、C1q和Fibrinogen。肾小管间质急性损伤表现为肾小管上皮细胞刷状缘脱落、细胞变性、坏死, 间质水肿、炎细胞浸润;慢性病变表现为肾小管萎缩,间质纤维化等。参考文献[4],根据病变组织累及的面积将肾小管间质损伤程度半定量评分:肾小管间质无病变(0~5)%为0分;肾小管间质呈轻度病变,病变范围>5%且≤25%为1分;肾小管间质呈中度病变,病变范围>25%且≤50%为2分;肾小管间质呈重度病变,病变范围>50%且≤75%为3分;肾小管间质有极重度病变,病变范围>75%为4分。
1.3尿标本留取及检测方法收集患儿肾脏穿刺前一日晨起清洁中段尿10 mL,离心后取上清液置-80 ℃超低温冰箱中保存待用。用免疫比浊方法检测尿标本肾小管损伤标志物(α1m、RBP),用酶比色法检测尿NAG酶和尿肌酐,用免疫比浊方法检测尿标本总蛋白。试剂均购自浙江宁波仁汇公司。
1.4统计学处理采用SPSS 20.0进行分析。应用单因素方差分析和LSD-t检验比较正常组、HSP组和HSPN组尿液中小分子蛋白α1m、RBP和NAG酶的变化,相关性分析用Pearson相关。检验水准α=0.05。
2 结果
2.1HSPN肾小管间质显微镜下表现见图1。HSPN Ⅱa型1例和Ⅱb型1例患儿可见小灶性肾小管间质急性损伤,Ⅱb型1例患儿可见小灶性肾小管间质慢性病变,评分均为1分;HSPN型 Ⅲa(21例)和Ⅲb(17例)型多数病例可见灶性小管间质急性损伤,多分布在新月体形成、球囊断裂的肾小球周围, 评分均为1分;Ⅲb型(1例)偶见灶性小管间质慢性病变,评分为1分。在HSPN Ⅲ型肾小球细胞和纤维细胞性新月体形成、球囊断裂、球囊周围间质水肿、炎细胞浸润的病理状态下,可见肾小管上皮细胞刷状缘脱落、管腔相对扩张、腔内脱落的上皮细胞,以及肾小管炎和肾小管再生等明显的肾小管间质损伤。
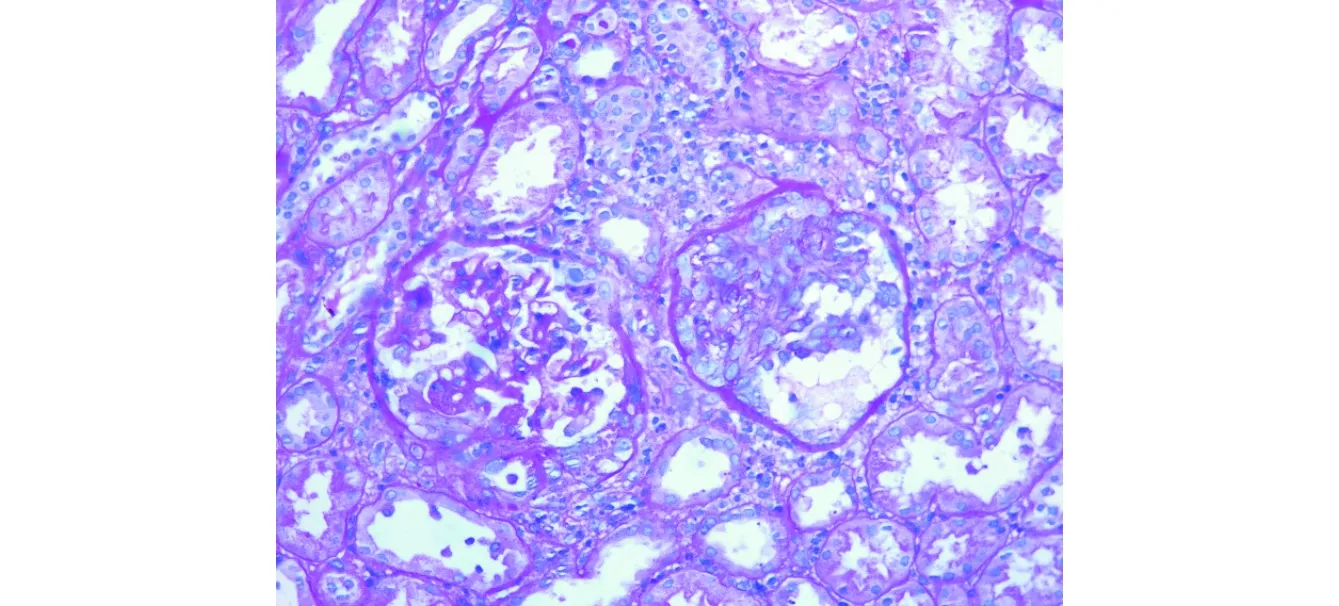
新月体形成,肾小球周围小管间质损伤图1 HSPN肾小管间质显微镜下表现(PAS染色,×200)
2.2正常组、HSP组和HSPN组尿液中α1m、RBP和NAG酶的变化比较见表1。
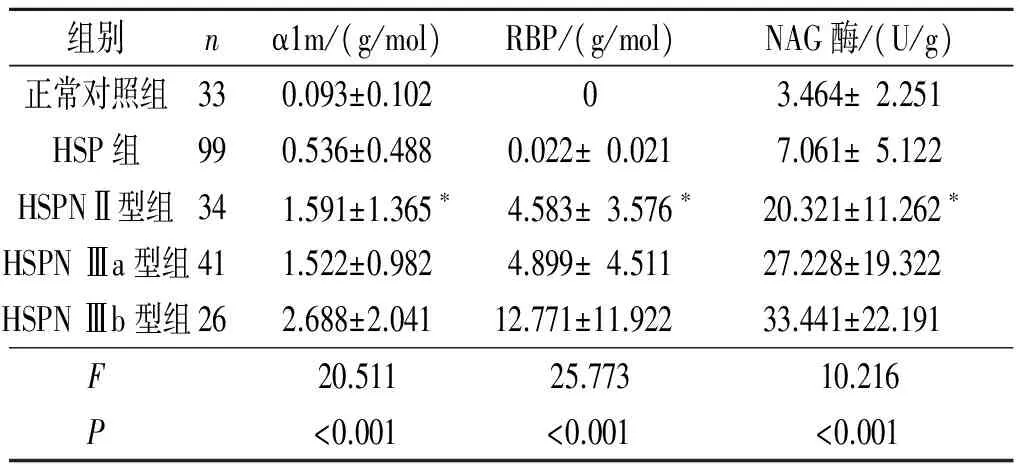
表1 正常组、HSP组和HSPN组尿液中α1m、RBP和NAG酶的变化比较
*:除与HSPN Ⅲa型组相比P>0.05外,其余各组两两比较,P均<0.05
2.3HSPNⅢ型新月体形成比例与尿NAG酶的相关性以及尿α1m和RBP的相关性分析HSPN Ⅲ型尿NAG酶[(2.847~137.105) U/g]与新月体形成比例[(3.238~34.382) %]存在相关性,r=0.331,P=0.007;HSPN Ⅲ型尿α1m[(0.083~11.242) g/mol]和RBP[(0.001~32.307) g/mol]存在相关性,r=0.513,P<0.001。
3 讨论
目前,对HSP肾损伤标志物的研究多集中在对肾小球损伤的早期诊断,如尿微量白蛋白可用于对肾小球损伤的早期诊断[5-7],而对HSPN肾小管损伤早期诊断的相关研究较少,作者前期的研究结果[8]显示尿RBP、CysC、NAG酶三者联合检测对早期诊断和全面监测肾小管-间质损伤具有重要的临床意义。近年来,越来越多的研究证据表明肾小管间质损伤在肾脏病的进展过程中起重要作用,其损害的严重程度直接与肾脏病变的发展速度和预后密切相关,甚至超过肾小球病变本身[9-11]。ISKDC对HSPN的病理分型中只分级描述了肾小球病变,未对肾小管间质病变进行分级描述。本研究探索了HSPN在出现肾小球病变的同时是否伴有肾小管损伤,结果显示:HSPN Ⅱ型显微镜下未见明显小管间质损伤,但患儿尿液中小分子蛋白α1m、RBP和NAG酶已较正常对照和HSP患儿明显增高,提示存在肾小管上皮细胞重吸收功能障碍和光学显微镜下不易看到的轻微肾小管上皮细胞损伤。其原因如下:①HSP的病变本质是IgA血管炎,可累及全身小血管;HSP发生肾损伤时可能同时伴发肾间质血管炎,从而引起临近肾小管受损。② HSPN肾小球病变时,尿中蛋白、红细胞对肾小管上皮细胞有直接毒性作用。这些因素势必会引起不同程度的肾小管上皮细胞损伤和近端肾小管重吸收功能障碍。
吴智慧等[12]的研究显示,53.49%的糖尿病患者、48.98%的高血压患者、52.38%的系统性红斑狼疮患者在尿蛋白定性检测为阴性的尿液中NAG酶水平明显增高。方林钧等[13]的研究显示尿微量系列蛋白检测可作为早期诊断儿童相关肾病的敏感指标。几项对糖尿病肾病的研究结果[14-15]也显示尿小分子蛋白的检测能更早地反映肾损伤。Petrica等[16]发现,糖尿病患者尿白蛋白尚在正常水平时,尿α1m水平已有升高,其升高早于微量蛋白尿的出现。Sheira等[17]的研究也显示尿NAG酶与血清肌酐呈正相关,可以预测糖尿病肾病肾损伤的严重程度。以上研究也提示尿中小分子蛋白α1m、RBP和NAG酶是评价肾小管早期损伤的标志物。本研究结果提示:用尿α1m、RBP反映远端肾小管重吸收功能的变化,用NAG酶反映近端肾小管上皮细胞损伤,三者联合的评价方法更全面、更敏感,既可用于早期评价,又可用于动态监测HSPN肾小管损伤。
本研究结果显示,HSPN Ⅲ型 (新月体形成组) 尿小分子蛋白α1m、RBP和NAG酶比HSPNⅡ型(无新月体形成组)进一步升高。在三项检测指标中,尿NAG酶与肾小球新月体百分比有较好的相关性,提示肾小球新月体形成可能是导致HSPN Ⅲ型肾小管上皮细胞进一步损伤的重要病理因素。结合本研究肾脏病理观察结果,分析原因可能为肾小球新月体形成时,一些蛋白酶和炎症因子破坏肾小球包曼氏囊、导致炎症波及肾小球周围的肾小管和间质。在新月体形成(<50%)的基础上,HSPN Ⅲ型按照系膜增生的程度分为Ⅲa和Ⅲb。本研究结果显示,与HSPN Ⅲa型相比,HSPN Ⅲb型尿小分子蛋白α1m和RBP均明显增高,且有较好的相关性,但尿NAG酶组间无明显差异。这些研究结果提示HSPN Ⅲ型在同等新月体形成比例的基础上,系膜增生的程度并不能明显影响肾小管上皮细胞溶酶体的破坏。文献[5-7, 12]中报道有关对HSPN和其他继发性肾小球肾炎尿小分子蛋白和NAG酶的检测,多作为有无肾损伤的评价,未见与新月体病变的相关性研究。
综上所述,在HSP出现肾脏损伤的早期,除了及时对肾小球病变进行分级外,动态检测肾小管损伤,有利于全面评价肾损伤的程度、决定治疗方案和判断预后。随着HSPN病情的加重,肾小球新月体形成是加重肾小管上皮细胞损伤的重要病理因素之一。将来的研究尚需进一步扩大样本量、延长观察时间,检测HSPN经过临床治疗后尿小分子蛋白α1m、RBP和NAG酶的动态变化。
[1] MAO S,XUAN XY,SHA YG,et al.Clinico-pathological association of Henoch-Schönlein purpura nephritis and IgA nephropathy in children[J].Int J Clin Exp Pathol,2015,8(3):2334
[2] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志,2009,47(12):911.
[3] JENNETE JC, OLSEN JL, SCHWARTZ MM, eds. Heptinstall's pathology of the kidney. Philadelphia: Lippincott Williams & Wilkins, 2007:423
[4] HUANG YJ,YANG XQ,ZHAI WS,et al.Clinicopathological features and prognosis of membranoproliferative-like Henoch-Schönlein purpura nephritis in children[J].World J Pediatr,2015,11(4):338
[5] 杨琴.血清胱抑素C及尿微量白蛋白联合检测在紫癜性肾炎早期肾功能损害中的意义[J].现代中西医结合杂志,2014,23(20):2198
[6] 杜立树,平龙玉,熊伟.尿微量蛋白和尿酶测定在过敏性紫癜患儿早期肾损伤中的临床意义[J].国际检验医学杂志,2015,36(5):599
[7] 商树坤.75例过敏性紫癜患儿的尿5项蛋白与肾脏病理的检测及分析[J].中国卫生标准管理,2016,7(6):165
[8] 黄岩杰,陈文霞,郑宏,等.过敏性紫癜性肾炎患儿肾小管功能检测[J].郑州大学学报(医学版),2005,40(5):853
[9] LOUIS K,HERTIG A.How tubular epithelial cells dictate the rate of renal fibrogenesis?[J].World J Nephrol,2015,4(3):367
[10]DAVIN JC.Henoch-Schönlein purpura nephritis: pathophysiology, treatment, and future strategy[J].Clin J Am Soc Nephrol,2011,6(3):679
[11]PILLEBOUT E,ALBERTI C,GUILLEVIN LA,et al.Addition of cyclophosphamide to steroids provides no benefit compared with steroids alone in treating adult patients with severe Henoch Schönlein purpura[J].Kidney Int,2010,78(5):495
[12]吴智慧,唐小铁,王艳娥,等.NAG酶、γ-谷氨酰转移酶联合尿微量蛋白检测对早期肾损伤的诊断价值[J].海南医学院学报,2014,20(5):627
[13]方林钧,何威逊.尿微量系列蛋白测定对肥胖相关肾病早期诊断的意义[J].实用儿科临床杂志,2005,20(6):514
[14]SALEM MA,EL-HABASHY S,SAEID OM,et al.Urinary excretion of n-acetyl- beta-D-glucosaminidase and retinol binding protein as alternative indicators of nephropathy in patients with type 1 diabetes mellitus[J].Pediatr Diabe- tes,2002,3(1):37
[15]BOUVET BR,PAPARELLA CV,ARRIAGA SM,et al.Evaluation of urinary N-acetyl-beta-D-glucosaminidase as a marker of early renal damage in patients with type 2 diabetes mellitus[J].Arq Bras Endocrinol Metabol,2014,58(8):798
[16]PETRICA L,PETRICA M,VLAD A,et al.Proximal tubule dysfunction is dissociated from endothelial dysfunction in normoalbuminuric patients with type 2 diabetes mellitus:a cross-sectional study[J].Nephron Clin Prat,2011,118(2):c155
[17]SHEIRA G,NORELDIN N,TAMER A,et al.Urinary biomarker N-acetyl-β-D-glucosaminidase can predict severity of renal damage in diabetic nephropathy[J].J Diabetes Metab Disord,2015,14(4):4
