2,6-二氰基-3-吡啶基-5-雄甾烯基苯胺对食管癌EC109细胞周期及凋亡的影响
2018-02-05石晓丽徐晓微秦甜甜刘卫华张秀娟周凯瑞霍金玲杨腾蛟
石晓丽,徐晓微,秦甜甜,刘卫华,张秀娟,周凯瑞,霍金玲,杨腾蛟,王 淙
郑州大学药学院 郑州 450001
食管癌是世界最常见癌症之一,主要包括鳞癌和腺癌两种,在中国以鳞癌为主要发病类型,西方发达国家主要以腺癌为主[1-2]。为了治疗这种癌症,常使用吉西他滨、5-氟尿嘧啶和紫杉醇联合化疗,长期治疗容易使患者产生耐药,降低治疗效果[3]。甾族化合物是一类重要的多环化合物,在维持人体功能、调节代谢等方面发挥着重要的作用。1994年,Fotsis等[4]发现雌激素代谢产物2-甲氧基雌二醇能够抑制血管生成而抑制肿瘤生长,这为抗癌药物的研发提供了新思路:对甾体类化合物进行结构改造和修饰,获得新型抗癌化合物。该实验旨在探讨2,6-二氰基-3-吡啶基-5-雄甾烯基苯胺(简称4d)对食管癌EC109细胞的作用,现将结果报道如下。
1 材料与方法
1.1细胞和主要试剂化合物4d合成方法,碳谱、氢谱及质谱分析方法见参考文献[5]。4d溶解于二甲基亚砜(DMSO)中,化学结构见图1。食管癌细胞株EC109、正常食管上皮细胞Het-1a由郑州大学药物研究院保存。RPMI 1640培养基及胰蛋白酶消化液(北京索莱宝公司),标准胎牛血清(以色列BI公司),Bcl-2、Bax、Bid抗体(美国CST公司),Mcl-1和β-actin抗体(南京恩晶生物科技有限公司)。凋亡检测试剂盒、细胞周期检测试剂(南京凯基生物科技有限公司)。
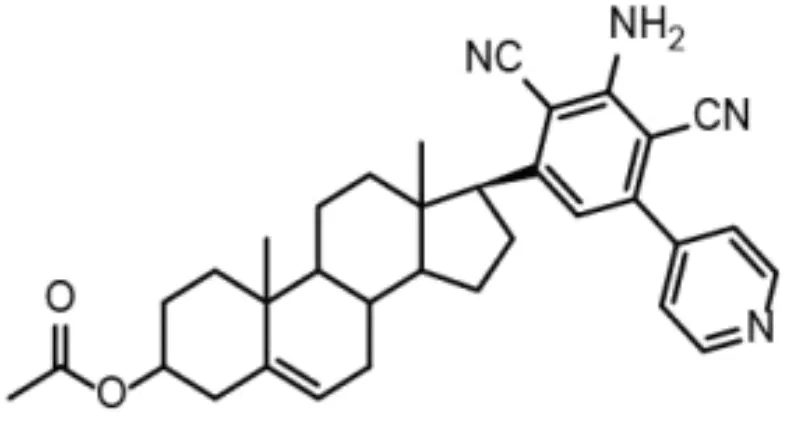
图1 4d结构式
1.2细胞培养EC109及Het-1a细胞在RPMI 1640培养基中培养,培养基中补充体积分数10%胎牛血清。细胞在37 ℃、体积分数5%CO2加湿环境中培养,2~3 d传代1次,隔天更换RPMI 1640培养基,取对数生长期细胞用于后续实验。
1.3MTT法检测细胞增殖抑制率分别收集2种细胞,计数板计数。用RPMI 1640培养基调整每孔细胞数约3×103个,将细胞接种于96孔板中培养过夜。细胞贴壁后,分别加入0.40、0.80、1.60、3.25、6.25、12.50、25.00、50.00、100.00 μmol/L的化合物4d作为实验组,并设置阴性对照组和空白对照组,每组设置3个复孔。48 h或72 h后,每孔加入20 μL MTT,37 ℃孵育4 h,然后小心除去培养基并向每孔加入150 μL DMSO,置于摇床10 min使其充分溶解,酶标仪测定570 nm处的吸光度(A)值。增殖抑制率=(对照孔A值-实验孔A值)/(对照孔A值-空白孔A值)×100%。实验重复3次。
1.4细胞凋亡检测将EC109细胞接种到6孔板中,加入含4d(0.0、0.5、2.0、4.0 μmol/L)的RPMI 1640培养基培养24 h后,使用不含EDTA的胰蛋白酶消化,分别收集细胞并调整细胞密度为1×106mL-1,每孔细胞重悬于500 μL Binding Buffer中,加入5 μL Annexin V和5 μL PI避光染色15 min。采用流式细胞仪在1 h内上机检测和分析结果。实验重复3次。
1.5细胞周期检测含0.0、0.5、2.0、4.0 μmol/L的4d的培养基作用EC109 细胞24 h后,分别收集细胞并用体积分数70%乙醇在4 ℃过夜固定。小心吸去固定液,用PBS洗涤固定的细胞,加入400 μL的PI和100 μL的RNase A。样品避光孵育30 min,并采用流式细胞仪进行检测。实验重复3次。
1.6细胞线粒体膜电位检测使用JC-1染料测量线粒体膜电位。1×105个EC109细胞接种于96孔板中,孵育过夜后,细胞用4d(0.0、0.5、2.0或4.0 μmol/L)处理6 h,JC-1(5 mg/L)染色20 min后使用温热的RPMI 1640培养基洗去染料。染色的细胞通过高通量筛选系统成像。根据高通量筛选系统对采集到的荧光强度进行量化统计,单体用488 nm波长激光(绿色)激发,而聚集体用561 nm波长激光(红色)激发。红色荧光代表JC-1聚合体减少,绿色荧光代表JC-1单体增加,结果用绿色与红色细胞群的荧光强度比值即JC-1单体与聚合体的比值表示。实验重复3次。
1.7Westernblot检测Bcl-2家族蛋白的表达EC109细胞用4d(0.0、0.5、2.0或4.0 μmol/L)处理24 h,收集细胞后PBS清洗2遍,加入裂解液后于冰上裂解30 min,低温离心机4 ℃离心收集上清,使用BCA蛋白定量试剂盒测定蛋白浓度。加入6×Loading Buffer,100 ℃水浴变性10 min。通过SDS-PAGE分离蛋白质并转移至硝酸纤维素膜。用含体积分数0.5%Tween20和体积分数5%脱脂牛奶的Tris缓冲盐水(pH=7.8)在室温下封闭2 h,然后在4 ℃与一抗孵育过夜。TBST洗膜3次,在室温下温育二抗2 h。化学发光显色,暗室曝光。以阴性对照组各蛋白的相对表达量为1,采用Image J分析各蛋白的相对表达量。实验重复3次。
1.8统计学处理使用SPSS 17.0进行数据分析。4d处理不同时间后 Het-1细胞、EC109细胞增殖抑制率的比较采用析因设计的方差分析;不同组间EC109细胞凋亡率、细胞周期、线粒体膜电位及Bcl-2家族蛋白相对表达量的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 4d对Het-1细胞和EC109细胞增殖的影响结果见表1、2。可见化合物4d对食管癌细胞有明显的增殖抑制作用。
F时间=43.073,P<0.001;F浓度=358.051,P<0.001;F交互=323.054,P<0.001

表2 4d处理不同时间后EC109细胞增殖抑制率的比较(n=3) %
F时间=40.608,P<0.001;F浓度=117.980,P<0.001;F交互=109.383,P<0.001
2.2 4d对EC109细胞凋亡的影响结果见表3。由表3可知,4d处理后EC109细胞凋亡率增加。

表3 各组EC109细胞凋亡率的比较 %
F=354.940,P=0.006;*:与阴性对照组相比,P<0.05
2.3 4d对EC109细胞周期的影响结果见表4。由表4可知,4d处理后的EC109细胞出现S期阻滞。
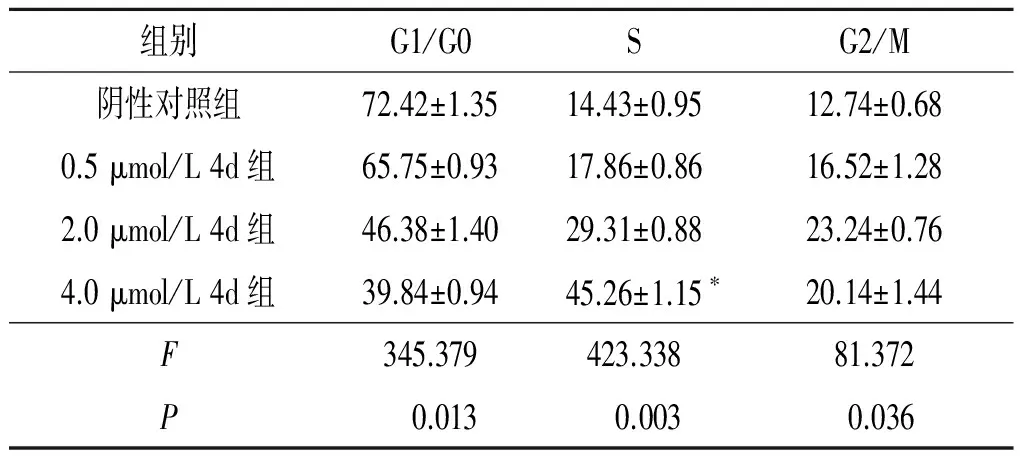
表4 各组EC109细胞周期的比较(n=3) %
*:与阴性对照组相比,P<0.05
2.4 4d对EC109细胞线粒体膜电位和Bcl-2家族蛋白表达的影响各组EC109细胞线粒体膜电位的比较见图2及表5。Bcl-2家族蛋白的表达见图3及表6。可知,4d可降低Mcl-1的表达水平。
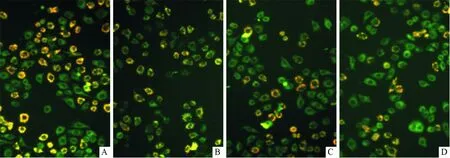
A:阴性对照组;B:0.5 μmol/L 4d组;C:2.0 μmol/L 4d组;D:4.0 μmol/L 4d组图2 各组EC109细胞线粒体膜电位的变化(×400)
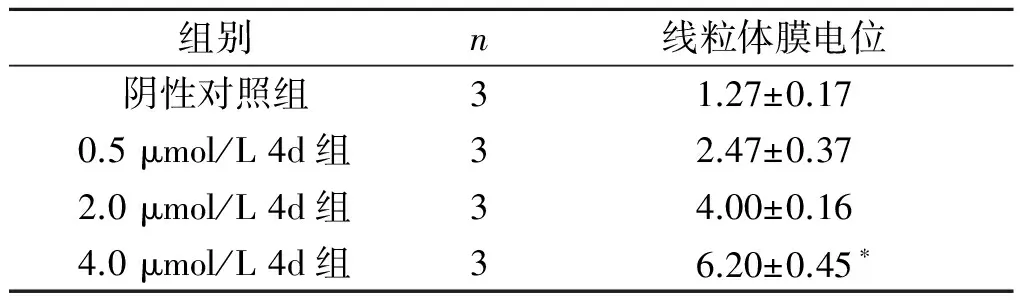
组别n线粒体膜电位阴性对照组31.27±0.170.5μmol/L4d组32.47±0.372.0μmol/L4d组34.00±0.164.0μmol/L4d组36.20±0.45∗
F=91.136,P=0.005;*:与阴性对照组相比,P<0.05
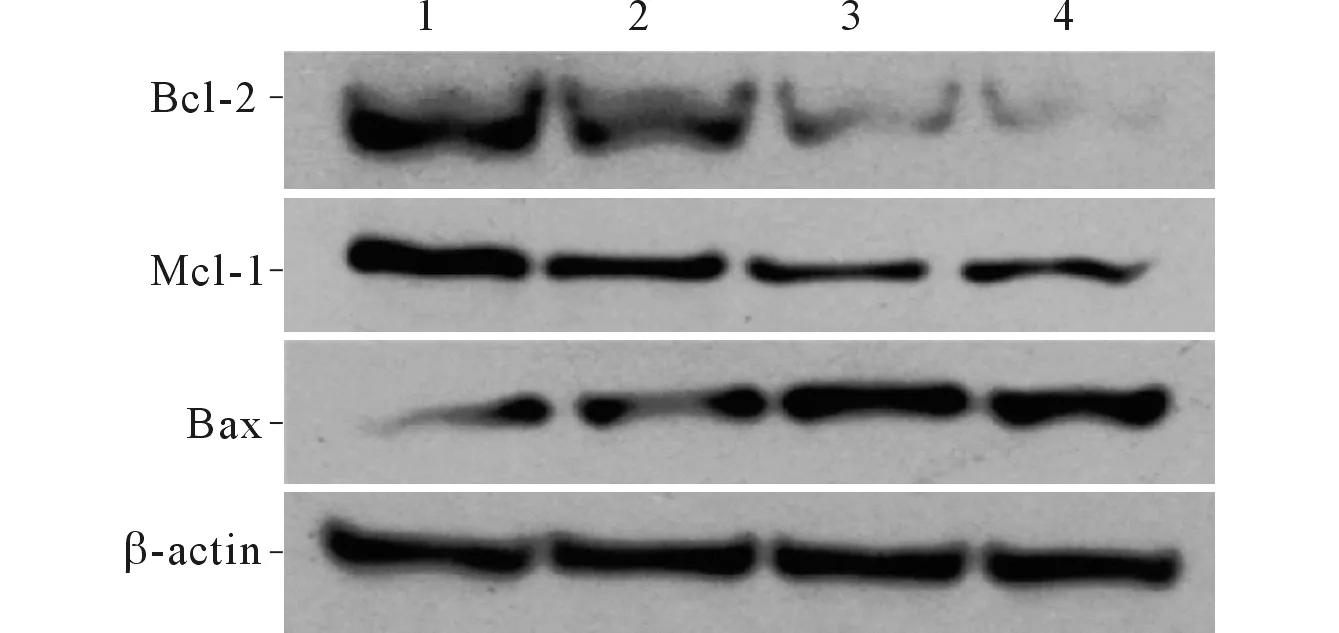
1:阴性对照组;2:0.5 μmol/L 4d组;3:2.0 μmol/L 4d组;4:4.0 μmol/L 4d组图3 各组EC109细胞Bcl-2家族蛋白的表达
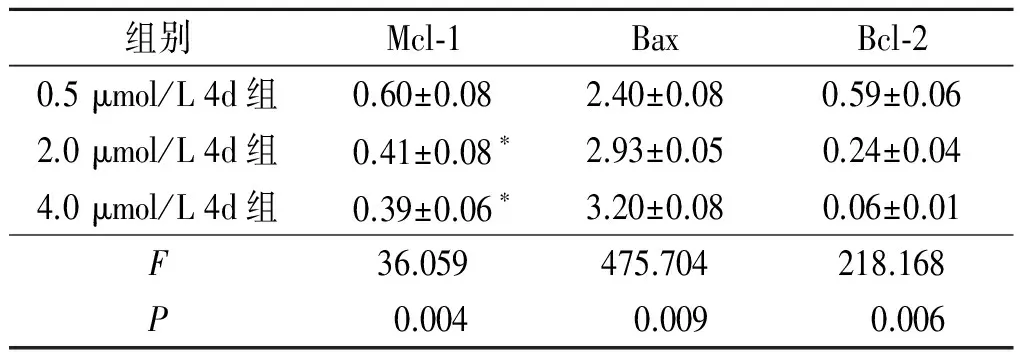
组别Mcl⁃1BaxBcl⁃20.5μmol/L4d组0.60±0.082.40±0.080.59±0.062.0μmol/L4d组0.41±0.08∗2.93±0.050.24±0.044.0μmol/L4d组0.39±0.06∗3.20±0.080.06±0.01F36.059475.704218.168P0.0040.0090.006
*:与0.5 μmol/L 4d组相比,P<0.05
3 讨论
甾体类化合物对许多癌细胞具有广谱的细胞毒性[6]。本实验结果表明,化合物4d可以有效地抑制食管癌EC109细胞的增殖,且具有浓度依赖性和时间依赖性。实验也表明4d对正常的食管上皮细胞Het-1a有一定的细胞毒性。
越来越多的研究[7]表明Bcl-2家族在细胞凋亡方面具有重要作用,这些蛋白使线粒体功能障碍,诱导细胞凋亡。Huang等[8]发现仅具有Bcl-2细胞结构域之一的Bcl-2家族的成员,是细胞凋亡的必需引发剂。一系列Bcl-2家族的抑制剂,如TW37和ABT737已进入临床试验阶段[9-10]。本实验发现化合物4d能使Bcl-2家族中Mcl-1表达下降,这与线粒体功能障碍、线粒体膜电位改变的实验结果相一致。表明4d诱导EC109细胞凋亡与启动Bcl-2家族介导的线粒体凋亡程序有关。
综上所述,化合物4d可以体外抑制食管癌EC109细胞的增殖,抑制增殖的机制与细胞阻滞和细胞凋亡相关;进一步的实验结果证实,诱导细胞凋亡的途径是Bcl-2家族介导的细胞线粒体损伤。
[1] PEERY AF,CROCKETT SD,BARRITT AS,et al.Burden of gastrointestinal, liver, and pancreatic diseases in the United States[J].Gastroenterology,2015,149(7):1731
[2] 李丹.食管癌研究进展[J].吉林中医药,2012,32(9):970
[3] WANG FH,WANG Y,CHEN ZD,et al.A phase Ⅱa study of rhLTα-Da in combination with cisplatin and fluorouracil for patients with metastatic esophageal squamous cell carcinoma or gastric adenocarcinoma[J].Med Oncol,2016,33(11):125
[4] FOTSIS T,ZHANG Y,PEPPER MS,et al.The endogenous oestrogen metabolite 2-methoxyoestradiol inhibits angiogenesis and suppresses tumour growth[J].Nature,1994,368(6468):237
[5] ZHANG YL,LI YF,SHI YK,et al.Efficient three-compo- nent one-pot synthesis of steroidal polysubstituted anilines[J].Steroids,2015,104:1
[6] D′YAKONOV VA,DZHEMILEVA LU,TUKTAROVA RA,et al.Novel hybrid molecules on the basis of steroids and (5Z,9Z)-tetradeca-5,9-dienoic acid:synthesis, anti-cancer studies and human topoisomerase I inhibitory activity[J].Anticancer Agents Med Chem,2017,17(8):1126
[7] 尹晓然,冯诚,张军,等.DADS抑制食管胃交界部腺癌细胞OE19增殖及诱导凋亡的机制[J].西安交通大学学报(医学版),2014,35(3):370
[8] HUANG DC,STRASSER A.BH3-only proteins-essential initiators of apoptotic cell death[J].Cell,2000,103(6):839
[9] THOMAS S,QUINN BA,DAS SK,et al.Targeting the Bcl-2 family for cancer therapy[J].Expert Opin Ther Targets,2013,17(1):61
[10]SONG T,CHAI G,LIU Y,et al.Mechanism of synergy of BH3 mimetics and paclitaxel in chronic myeloid leukemia cells: Mcl-1 inhibition[J].Eur J Pharm Sci,2015,70:64
