低氧训练诱导miR-27/PPARγ调控肥胖大鼠肝脏脂肪酸代谢变化的研究
2018-02-04路瑛丽冯连世
朱 磊,路瑛丽,冯连世
低氧训练诱导miR-27/PPARγ调控肥胖大鼠肝脏脂肪酸代谢变化的研究
朱 磊1,路瑛丽2,冯连世2
1.曲阜师范大学,山东 曲阜 273165;2.国家体育总局体育科学研究所,北京 100061
目的:探讨低氧训练对肥胖大鼠肝脏中miR-27/PPARγ及其下游脂肪酸代谢相关基因、蛋白表达水平的时序性影响。方法:13周龄雄性SD肥胖大鼠50只随机平均分成5组(n=10×5):低氧对照组(C组)、低氧训练1周组(E1组)、低氧训练2周组(E2组)、低氧训练3周组(E3组)和低氧训练4周组(E4组),所有训练组用水平跑台进行耐力训练,训练强度常氧25 m/min,低氧20 m/min(低氧浓度13.6%),持续运动1 h/天、5天/周,共4周。检测血清TC、TG、LDL-C和HDL-C水平;实时荧光定量PCR检测miR-27、PPARγ基因表达,Western Blot和免疫组化检测PPARγ、CD36、ATGL、LPL、L-FABP、SREBP1蛋白表达水平。结果:4周低氧训练过程中,肥胖大鼠脂体比、TC、TG和LDL-C浓度逐步降低,而HDL-C逐步升高;伴随着低氧训练时间的延长,肥胖大鼠肝脏中miR-27表达逐步降低,其中,E3和E4组极显著高于其余各组(≤0.01);与之相反,PPARγ、CD36、ATGL、LPL的表达逐步升高,其中E4组CD36表达量显著高于C组(≤0.05),C组AGTL表达量显著低于E2组(≤0.05),且极显著低于E3和E4组(≤0.01),C组LPL表达量显著低于E2和E3组(≤0.05),而极显著低于E4组(≤0.01);L-FABP表达量在E1组最高,显著高于C组(≤0.05);SREBP1表达量无显著变化(≥0.05)。结论:肥胖大鼠肝脏miR-27表达与低氧训练时间呈现负相关,低氧训练通过miR-27影响PPARγ及其下游脂肪酸代谢相关靶基因和靶蛋白的表达,改善血脂水平,最终机体脂含量伴随低氧训练时间的延长而逐渐下降。
低氧训练;miR-27;PPARγ;肥胖;大鼠
世界卫生组织(WHO)2014年公布的数据显示,全球18岁及其以上的成年人中约有19亿人超重,肥胖人群大约6亿,肥胖及其并发症严重威胁人类健康。国内、外研究结果一致表明,低氧训练不仅具有降低体重和体脂的作用[9,12],而且可以调节人体机能,预防和治疗肥胖引起的心血管和脂代谢紊乱等相关疾病,降低患病风险[35,38]。最近研究认为,miRNA与脂代谢密切相关,通过调节脂类合成、运输、分解、氧化等关键酶转录后水平的表达调控脂代谢,已经成为脂代谢机制的研究热点[23,33,49]。其中,miR-27可以调控其靶基因PPARγ水平,进而影响下游脂肪酸代谢相关基因和蛋白表达,并最终影响机体脂代谢过程[19,45,54]。
由于肝脏组织在机体脂肪酸代谢过程中占据重要位置,因此,目前对于肝脏组织中miR-27调控脂肪酸代谢水平的研究相对较多。但是,低氧训练对肝脏组织内miR-27表达量的时序性影响,及其低氧训练刺激miR-27调控PPARγ影响机体脂肪酸代谢水平的研究较少。
本研究通过观察低氧训练4周过程中肥胖大鼠肝脏组织miR-27/PPARγ及其下游脂肪酸代谢相关基因、蛋白表达量的时序性变化,探讨低氧训练减脂降体重的分子学机制,以期将低氧训练作为预防与控制脂代谢相关疾病的干预手段,为科学制定减脂降重、治疗脂代谢紊乱方案提供理论依据。
1 研究材料与方法
1.1 实验对象
SPF级5周龄雄性Sprague Dawley(SD)大鼠200只,体重176.47±10.75 g,北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001,饲养人员证书编号:1115032300009。随机分为两组:20只普通饲料喂养,体重176.26±10.62 g,180只高脂饲料(D12451,research diets公司,美国)喂养,体重176.54±10.80 g,两组大鼠体重无显著差异。国家体育总局体育科学研究所ABSL-3级动物房饲养,自由饮食,室温22±1ºC,湿度55%±2%,动物房装有昼夜明暗交替照明系统,每12 h轮转照明。
1.2 肥胖动物模型构建
高脂饲料喂养8周后,从高脂饲料组随机抽取20只SD大鼠与20只普通饲料组进行对比,若高脂饲料组大鼠平均体重、脂体比和Lee’S指数显著升高,且血清中TC、TG、LDL-C显著升高,而HDL-C显著降低,判定肥胖动物模型构建成功。从高脂饲料组挑选体重超过对照组平均体重20%的SD大鼠作为实验对象。
1.3 实验分组与运动方案
挑选出建模成功的SD大鼠共97只。进行1周的适应性训练(速度从16 m/min梯度递增到25 m/min,运动时间从20 min/天递增到60 min/天)。根据实验大鼠对跑台训练适应情况,选取50只均分成5组(n=10,各组体重无显著差异):低氧对照组(C组)、低氧训练1周组(E1组)、低氧训练2周组(E2组)、低氧训练3周组(E3组)和低氧训练4周组(E4组),所有训练组用水平跑台进行低氧耐力训练(20 m/min,低氧浓度13.6%,相当于海拔3 500 m),持续运动1 h/天、5天/周。
1.4 实验取材
各组大鼠依据实验设计训练周期进行跑台训练,最后一次训练后恢复24 h后取材。取材前大鼠禁食12 h,按0.3 mL/100 g体重的剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠,测量体长,称量体重;迅速将大鼠固定于有冰块的取材板上,打开腹腔,腹主动脉取血,分离血清;取肝右叶上缘,快速在预冷的生理盐水中漂洗去血,滤纸吸干水分,液氮速冻,而后置于-80 ℃超低温冰箱保存,用于实时荧光定量PCR (Quantitative Real-time PCR,qRT-PCR)和蛋白质印迹法(Western Blot)检测。取右侧肾周脂肪和附睾脂肪,快速在预冷的生理盐水中漂洗去血,滤纸吸干水分,电子天平称重。
1.5 生理生化指标检测
根据大鼠肾周脂肪重量、附睾脂肪重量和体重计算脂体比;半自动生化分析仪检测血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)浓度。

1.6 QRT-PCR
超低温冰箱取100 mg左右肝脏组织,放入盛有液氮的研钵中粉碎,严格按照Trizol法提取肝脏组织总RNA。OD260/OD280检测提取总RNA的纯度,琼脂糖凝胶电泳检测RNA的完整性。
1.6.1 检测mRNA的表达
严格按照试剂盒(RR370A,Takara生物公司)说明书反转录生成cDNA,反应条件:37℃ 15 min,85℃ 5 s,4℃保持,-20℃冰箱保存待测。以合成的cDNA为模板,β-actin为内参,每个样本设计3个复孔,严格按照试剂盒(RR8200A,Takara生物公司)说明书在实时荧光定量PCR仪(ABI 7300)进行检测。反应条件:第1步预变性(95℃ 30 s);第2步PCR反应(95℃ 5 s,60℃ 31 s,共40个循环)。
1.6.2 检测miRNA的表达
严格按照试剂盒(购于北京天根生化科技有限公司)说明书反转录生成cDNA。以合成的cDNA为模板,U6为内参,每个样本设计3个复孔,严格按照试剂盒(购于北京天根生化科技有限公司)说明书在实时荧光定量PCR仪(ABI 7300)进行检测。反应条件:第1步预变性(94℃ 2 min);第2步PCR反应(94℃ 20 s,63℃ 20 s,72℃ 30 s,共5个循环);第3步PCR反应(94℃ 20 s,60℃ 34 s,共40个循环)。
荧光定量PCR得到各待测样本的值,求3个重复样本平均CT值,据此计算△△Ct值:△△Ct=(Ct实验组目的基因-Ct实验组内参基因)-(Ct对照组目的基因-Ct对照组内参基因)。而后计算出各待测样本2-△△Ct值,即各待测样本相对表达量。
实验所用引物均由上海生物工程有限公司设计和合成,序列如表1所示。

表1 Real-Time PCR引物序列
1.7 Western-Blotting
超低温冰箱取100 mg左右肝脏组织,放入盛有液氮的研钵中粉碎,加入蛋白裂解液和蛋白酶(购自碧云天公司生物技术有限公司)。离心后采用BCA法检测样本蛋白浓度,去离子水和缓冲液调整所有样本浓度为4 μg/μl,沸水加热10 min蛋白质变性后置于-20℃冰箱待测。采用10%胶120 V恒压电泳1.5 h,200 mA恒流转膜1 h。5%脱脂奶粉(购于美国BD公司)封闭PVDF膜(购自Millipore公司)1 h,而后加入一级抗体置于摇床4℃过夜,TBST洗涤后加入二级抗体室温孵育1 h。TBST洗膜后加入发光液于暗室中显影、定影。扫描胶片后利用Quantiy One软件分析分析蛋白条带灰度值,求目的蛋白与内参蛋白的相对表达量。
1.8 统计分析

2 实验结果
2.1 低氧训练对肥胖大鼠生理生化指标的时序性影响
C组肥胖大鼠血清TC浓度显著高于E2组和E4组(<0.05),E3组肥胖大鼠血清TC浓度极显著低于C组和E1组(<0.01);C组肥胖大鼠血清TG浓度极显著高于其余各组(<0.01);E4组肥胖大鼠血清LDL-C浓度极显著低于其余各组(<0.01);C组肥胖大鼠血清HDL-C浓度显著低于E2组(<0.05),且极显著低于E1组、E3组和E4组(<0.01),E4组大鼠血清HDL-C浓度极显著高于E2组(<0.01)。E2组肥胖大鼠脂体比显著低于C组(<0.05),E4组肥胖大鼠脂体比极显著低于C组(<0.01),且显著低于E1组和E3组(<0.05)。
2.2 低氧训练对肥胖大鼠肝脏miR-27、PPARγ表达的时序性影响
E3组肥胖大鼠肝脏miR-27表达量极显著低于C组、E1组和E2组(<0.01);E4组肥胖大鼠肝脏miR-27表达量极显著低于C组、E1组和E2组(<0.01)。E2组肥胖大鼠肝脏PPARγ mRNA表达量显著高于E1组(<0.05),且极显著高于C组(<0.01);E4组肥胖大鼠肝脏PPARγ mRNA表达量显著高于C组(<0.05)。C组肥胖大鼠肝脏PPARγ蛋白表达量显著低于E1组(<0.05),且极显著低于E3组和E4组(<0.01);E2组肥胖大鼠肝脏PPARγ蛋白表达量显著低于E4组(<0.05)。

表2 各组肥胖大鼠生理、生化指标
注:单因素方差分析各指标F值和P值,Bonferroni法比较分析组间差异,将α设置为0.05作为显著性水平。
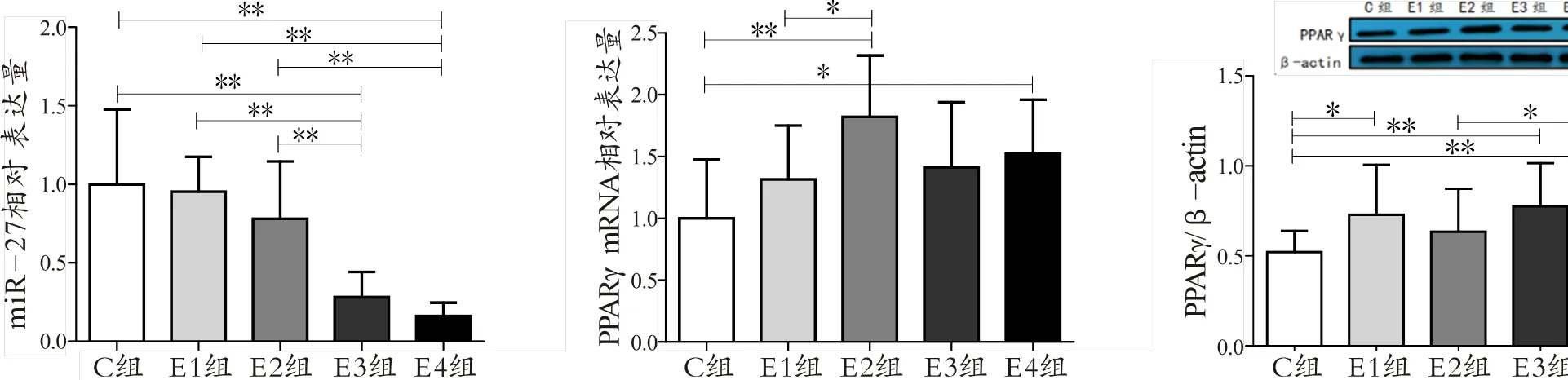
图1 各组肥胖大鼠肝脏miR-27和PPARγ相对表达量
Figure 1. Diagram of Relative of miR-27 and PPARγ in the obesity rat liver
注:单因素方差分析显示,miR-27相对表达量存在组间差异性,=17.00,=0.000;PPARγ mRN相对表达量存在组间差异性,=3.94,=0.008;PPARγ/β-actin的相对表达量存在组间差异性,=3.42,=0.016。Bonferroni法比较分析组间差异,将α设置为0.05作为显著性水平。*表示两组间均值差异显著(<0.05);**表示两组间均值差异极显著(<0.01),下同。
2.3 低氧训练对肥胖大鼠肝脏脂肪酸代谢相关基因表达的时序性影响
伴随着低氧训练时间的延长,肥胖大鼠肝脏CD36、ATGL、LPL和L-FABP蛋白表达量逐渐升高。其中,C组肥胖大鼠肝脏CD36蛋白表达量显著低于E4组(<0.05)。C组肥胖大鼠肝脏ATGL蛋白表达量显著低于E2组(<0.05),且极显著低于E3组和E4组(<0.01);E4组肥胖大鼠肝脏ATGL蛋白表达量显著高于E1组和E2组(<0.05)。C组肥胖大鼠肝脏LPL蛋白表达量显著低于E2组和E3组(<0.05),且极显著低于E4组(<0.01)。E组肥胖大鼠肝脏L-FABP蛋白表达量最高,且显著高于C组(<0.05)。此外,伴随着低氧训练时间的延长,各组肥胖大鼠肝脏SREBP1蛋白表达量均值组间差异无显著性。

图2 肥胖大鼠肝脏CD36、ATGL、LPL、L-FABP和SREBP1蛋白相对表达量
Figure 2. Diagram of Relative of CD36,ATGL,LPL,L-FABP and SREBP1in the obesity rat liver
注:单因素方差分析显示,CD36/β-actin存在组间差异性,=9.86,=0.004;ATGL/β-actin存在组间差异性,=5.13,=0.002;LPL/β-actin存在组间差异性,=3.15,=0.023; L-FABP/β-actin存在组间差异性,=10.7,=0.000; SREBP1/β-actin存在组间差异性,=5.47,=0.001。
3 分析与讨论
3.1 低氧训练对肥胖大鼠生理生化指标的时序性影响
有研究报道高原训练或人工低氧环境能够降低人体体重和体脂[1,7],以大鼠为研究对象也得到了相似的研究结论[20,31]。Lu等[20]研究发现,经过4周的低氧训练,大鼠体重、体脂重量和脂体比均出现极显著降低。本实验大鼠经过4周低氧训练,脂体比也呈现同样的变化趋势。王宁琦等[9]通过实验模拟海拔2 600~2 800 m高度氧气环境,观察4周低氧运动对于青少年减肥的效果,结果显示,经过4周低氧训练,受试者的体重、腰围、BMI、体脂和体脂百分比均显著低于实验前水平,血清中TC、TG、LDL-C显著低于实验前水平,而HDL-C水平与实验前相比升高了5.71%。此外,实验结果还显示,低氧训练第3周肥胖大鼠脂体比不同于之前的变化趋势,而是出现相反的变化,而这一变化在低氧训练4周消失,脂体比再次与之前的变化趋势一致,造成这一现象的原因可能是机体对于低氧训练适应而形成的短暂性反馈,具体机制有待于进一步深入研究。本研究发现,随着低氧训练时间的延长,肥胖大鼠血清中TC、TG和LDL-C的水平呈现逐渐下降的趋势,而HDL-C水平出现显著升高。大部分相关实验研究也得出了类似的结果:低氧、训练和低氧训练均可导致机体血清TC、TG和LDL-C水平下降而HDL-C水平升高,进而改善肥胖机体的血脂水平。马延超等[6]将SD大鼠低氧训练4周后,发现血清中TC、TG和LDL-C水平降低,提示低氧训练具有降血脂的作用。但是,该研究与本实验不同之处在于:本实验结果显示伴随着低氧训练时间的延长,大鼠血清HDL-C水平呈现上升趋势,而马延超等的实验结果显示,SD大鼠经过4周的低氧游泳训练,HDL-C也呈现下降趋势,造成这一结果的不同可能是因为两个研究所采用的运动强度不同。
3.2 低氧训练对肥胖大鼠肝脏miR-27、PPARγ表达的时序性影响
miRNA与脂代谢密切相关,通过调节脂类合成、运输、分解、氧化等关键酶转录后水平的表达调控脂代谢,已经成为脂代谢机制的研究热点[33,49]。目前报道与脂代谢密切相关的有miR-27[50]、miR-370[39]、miR-122[29]、miR-33[21]、miR-143[30]、miR-378[17]等。而miR-27是迄今为止发现的和人类脂肪细胞分化相关性最强的miRNA之一。Vickers等[27]利用基因芯片筛选了肝脏中大约150种miRNA,结果发现,无论是人类还是鼠类,miR-27都是最高效的脂质代谢调控因子。研究发现,miRNA-27模拟物降低了循环中的脂肪酸浓度,减少了脂肪在体内的堆积,被认为是改善血脂和减轻肥胖潜在的治疗靶点[52]。查阅有关文献发现,目前没有低氧训练影响miR-27水平的相关研究和报道。本实验结果表明,低氧训练调低肥胖大鼠肝脏miR-27的表达水平,且这种变化随着低氧训练时间的延长呈现出逐渐下降的趋势。随着低氧训练时间的延长,miR-27的表达进行性降低,与血液中TC、TG、LDL-C和脂体比的变化趋势一致,而与HDL-C的变化趋势相反。这提示,miR-27可能参与了低氧训练调控的脂肪酸代谢和脂肪形成过程。与本研究一致,多项研究发现,在脂肪形成后,miR-27的表达呈现出逐渐降低的变化趋势。miR-27则可进一步通过下游调节因子,阻碍脂肪的进一步生成,并且抑制脂肪细胞的分化[22,37]。
PPARγ作为脂肪代谢的关键转录因子,调控脂肪细胞分化、脂肪酸代谢和胆固醇代谢,与肥胖的发生发展密切相关。荧光素酶报告基因分析,miR-27与PPARγ的3’UTR特异结合,抑制PPARγ的表达,证明PPARγ是miR-27的靶基因[36]。miR-27在脂肪生长过程中发挥负向调节作用,过表达miR-27通过抑制PPARγ的表达,抑制脂肪生成和分化而不影响成肌分化,且抑制作用发生在分化的早期[16,40]。目前研究表明,低氧和训练均可以引起脂肪和肌肉组织中PPARγ表达水平的变化,Lui等[43]的实验研究发现,处于高纬度低氧环境中的鹿鼠腓肠肌中PPARγ mRNA表达量是低纬度鹿鼠的2倍,而且,PPARγ蛋白的表达量也同样呈现出高纬度大于低纬度鹿鼠的差异。实验还发现,低氧环境可以升高鹿鼠腓肠肌中PPARγ蛋白的表达水平。禹尚美[8]探讨了低氧及低氧训练对脂肪代谢的影响,实验选取8周龄雄性SD大鼠作为研究对象,随机分成对照组、训练组、低氧组和低氧训练组,氧分压12.5%的低压氧舱12 h/天,跑台训练坡度为10°,速度25 m/min,每周训练5天,每天训练60 min,3周后发现各组间脂肪组织中PPARγ的表达量无显著差异。本实验也出现相同的结果,低氧训练3周后,PPARγ蛋白表达量与低氧对照组无显著性差异。此外,本实验还检测了其他训练时间点肥胖大鼠肝脏PPARγ mRNA和蛋白表达量,发现伴随着低氧训练时间的延长,PPARγ mRNA和蛋白表达量总体呈现上升趋势。与本实验结果相似,Liu等[41]通过实验发现,30天的自主训练可以显著提高C57Bl/6J小鼠结肠中PPARγ的表达水平。Song等[24]的实验发现,无论是4周的训练还是1周的预适应,大鼠肝脏中PPARγ基因和蛋白表达水平均显著升高。Lu等[42]构建雄性SD大鼠肥胖模型,经过8周训练后发现,小强度、中等强度和大强度训练均可以升高大鼠血浆中PPARγ浓度,且3种训练强度组大鼠脂肪组织中PPARγ mRNA表达水平均显著高于低氧对照组。Szostak等[25]实验发现,3个月的训练显著增加了小鼠主动脉PPARγ的表达水平。
3.3 低氧训练对肥胖大鼠肝脏脂肪酸代谢相关基因、蛋白表达的时序性影响
PPARγ在肝脏、脂肪和骨骼肌中均可表达,目前研究多集中于PPARγ在脂肪组织和肌肉组织中的表达。PPARγ在脂肪组织中表达丰度非常高,多个脂肪酸转运和代谢的基因在转录水平受其调控,如脂肪细胞脂肪酸结合蛋白(Fatty Acid Binding Protein,FABP)、脂肪酸移位酶(CD36/FAT)及脂蛋白脂酶(Lipoprotein lipase,LPL)等[11]。PPARγ能够诱导肝细胞表达载脂蛋白、脂肪酸氧化酶与LPL等,从而促进脂质氧化,降低血脂浓度[40]。研究还发现,PPARγ与肌肉组织LPL、FATP-1、CPT-1的表达密切相关,参与肌肉组织中脂肪酸代谢[41]。因此,PPARγ可以通过调控靶基因CD36、ATGL、LPL、L-FABP和SREBP1的表达影响脂肪酸代谢[11,14,26],进而改善血浆中HDL、LDL和TG含量,最终影响内脏脂肪和体脂百分含量。CD36通过调控脂肪酸的跨膜转运来影响脂肪酸氧化代谢效率[34,18]。ATGL是脂肪水解成脂肪酸的最关键限速酶,是各组织内水解TG的第1步反应的限速酶和关键酶,与脂代谢速率的调节有着密切关系。LPL作为乳糜微粒(CM)和VLDL中TG的限速酶,调节其分解形成甘油和脂肪酸的效率。它可以调节HDL-C的生成,参与VLDL-C与HDL-C的脂质交换[10],还能增加CM结合到肝细胞膜LDL受体相关蛋白上的能力,促使肝细胞摄取CM[46]。通过以上3种途径,LPL影响机体脂代谢能力。FABP具有摄取和转运脂肪酸的功能,在机体脂代谢过程中起着重要作用[44]。FABP位于肝脏内的亚型是L-FABP,不仅可以在细胞膜上结合长链脂肪酸,还可以结合饱和脂肪酸、胆固醇等其他酰基配体[51]。L-FABP与脂肪酸结合后,作为载体将脂肪酸运输到线粒体或者过氧化物酶体,而后进行β氧化,参与到细胞内的脂肪酸稳态调节过程中。L-FABP,与肝脏组织中许多脂代谢相关酶有直接交互作用,进而调控肝脏组织脂代谢酶的活性,参与细胞内的脂质代谢[48]。SREBP1与内质网结合后调节下游FAS、ACC1和SCD1等靶基因的表达,影响TG的合成和脂质储集,几乎参与肝脏中所有与甘油三酯和脂肪酸合成基因的转录,在维持肝脏脂质代谢平衡中有着重要意义。
本实验结果表明,伴随着低氧训练时间的延长,CD36、ATGL、LPL和L-FABP表达水平均逐步升高,这与目前大部分的研究结果一致。Ortiz-Masià等[47]的实验发现,3% O2低氧暴露导致人巨噬细胞CD36蛋白表达水平显著升高。毛孙忠[5]探讨了高原习服过程中骨骼肌脂肪氧化利用特点、机制及意义,低压舱模拟海拔5 000 m高压环境,SD大鼠跑台一次性力竭运动,实验发现,高原暴露15天和30天组SD大鼠骨骼肌CD36表达量显著高于急性高原暴露组。路瑛丽等[3]的实验结果发现,高住高练肥胖大鼠脂肪组织中ATGL表达量第1周调低,第2周上升,第3周没有变化,第4周再次降低到第0周水平,其中,第2周和第3周肥胖大鼠脂肪组织中ATGL表达量显著高于第0周(<0.05)。Jiang等[15]的实验发现,经过3天的0.2% O2低氧暴露,骨髓间充质干细胞中LPL表达水平极显著高于常氧孵育组。路瑛丽[4]实验发现,高住高练组大鼠血清LPL水平在第1周和第2周持续上升,第3周和第4周同样呈现上升趋势,但是上升幅度减小,其中第2周和第3周大鼠血清LPL水平显著高于第0周组,而第4周极显著高于第0周组。Han等[13]实验研究发现,长期间断性低氧显著上调了腹主动脉细胞脂肪型脂肪酸结合蛋白(Adipocyte Fatty Acid-binding Protein,A-FABP)mRNA和表皮型脂肪酸结合蛋白(Epidermal Fatty Acid-binding Protein,E-FABP) mRNA及其蛋白的表达水平。Lam等[38]研究了睡眠呼吸暂停引起的长期间断性低氧对于A-FABP表达水平的影响,实验结果显示,血清中A-FABP水平与最小血氧饱和度及持续时间呈显著正相关,长期间断性低氧可以调高血清中A-FABP的表达水平。经过低氧训练后,肥胖大鼠肝脏中CD36、ATGL、LPL和L-FABP表达水平的升高,且随着低氧训练时间的延长,上述脂肪酸代谢调节相关蛋白的变化幅度越明显,从而引起肝脏中脂肪酸代谢水平的提高,促进了肝脏中胆固醇外流,因此改善了血脂水平,进而减少体脂百分含量,这可能也是低氧训练减脂降体重的生理学机制。本实验还发现,低氧训练过程中SREBP1蛋白的表达无显著性差异,提示,SREBP1并不是低氧训练减脂生理过程的主要影响因子。
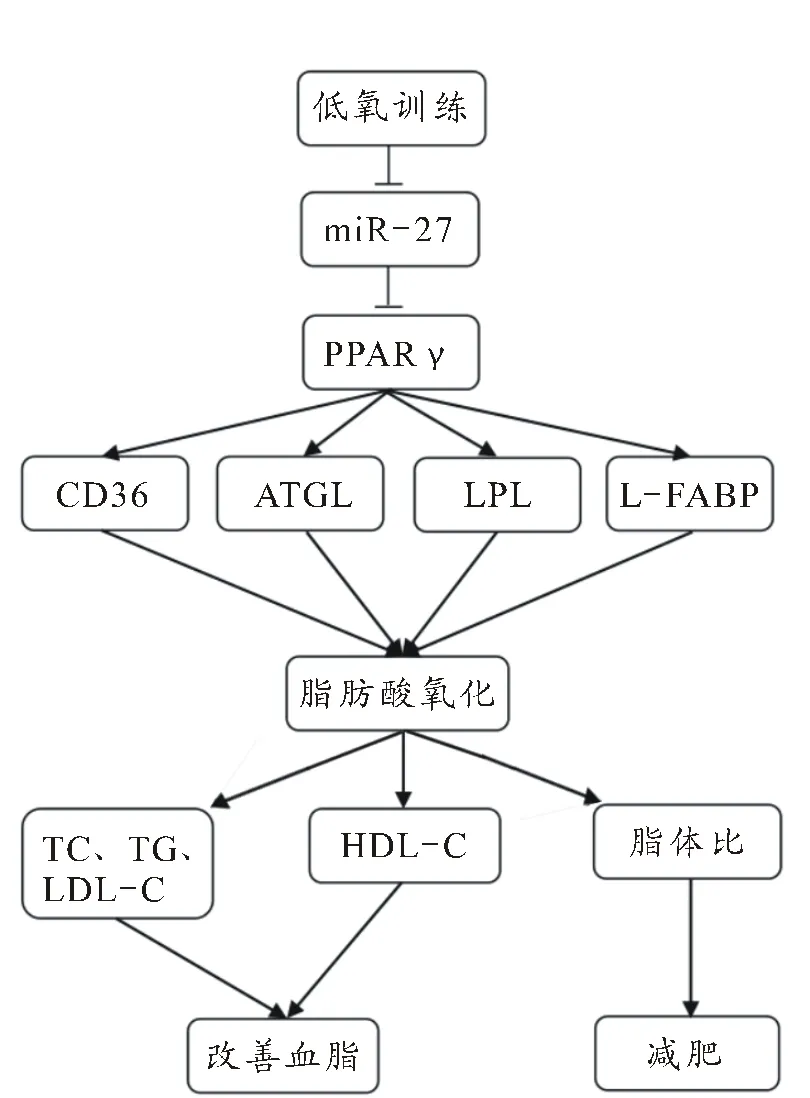
图3 低氧训练诱导miR-27/PPARγ调控脂代谢过程示意图
Fignre 3. Schematic Diagram of Hypoxia Exercise Inducing miR-27/PPARγ to Regulate Fatty Acids Metabolism
综上所述,低氧训练抑制肥胖大鼠肝脏miR-27表达,miR-27进一步通过靶基因PPARγ调节下游靶分子CD36、ATGL、LPL、L-FABP的表达。随着低氧训练时间的延长,miR-27的表达逐渐降低,PPARγ的表达基本呈现逐渐升高的趋势,脂肪酸代谢调节相关蛋白CD36、ATGL、LPL、L-FABP的表达逐渐递增,促进脂肪酸的氧化,抑制TC、TC和LDL-C的合成,促进HDL-C的生成,从而改善肥胖大鼠血脂并降低机体脂含量,可能是低氧训练调控脂肪酸代谢的分子机制。
4 结论
肥胖大鼠肝脏miR-27表达与低氧训练时间呈现负相关,低氧训练通过miR-27影响PPARγ及其下游脂肪酸代谢相关靶基因和靶蛋白的表达,改善血脂水平,最终机体脂含量伴随低氧训练时间的延长而逐渐下降。
[1] 安江红,赵凡,赵之光. HiHiLo对优秀古典跤运动员备战全运会赛前减控体重期间部分生理生化指标的影响[J]. 中国运动医学杂志, 2014(02): 115-118,182.
[2] 冯连世,张漓,高炳宏,等. 不同环境下有氧运动对超重和肥胖青少年体重与体脂含量的影响[J]. 体育科学, 2013(11):58-65.
[3] 路瑛丽,冯连世,谢敏豪,等. 高住高练对肥胖大鼠FAS mRNA和ATGL mRNA表达的影响[J]. 中国运动医学杂志, 2014(08): 785-789.
[4] 路瑛丽. 高住高练对肥胖大鼠脂代谢的影响及机制研究[D]. 北京:北京体育大学,2013.
[5] 毛孙忠. 高原习服过程中骨骼肌脂肪氧化利用特点、机制及意义[D].重庆: 第三军医大学,2008.
[6] 马延超,张缨,刘花层. 不同低氧训练方式对血脂、体重及其变化机理的研究[J]. 中国体育科技, 2007(05): 136-140.
[7] 袁建琴,曹建民,徐勇,等. 现代五项高原训练某些生理生化指标的训练监控研究[J]. 北京体育大学学报, 2003(01): 51-52,58.
[8] 禹尚美. 低氧及低氧训练对大鼠身体脂肪代谢的影响[D].北京:北京体育大学,2015.
[9] 王宁琦,胡扬,官余凌,等. 4周低氧运动结合饮食控制对肥胖青年体重、血脂及胰岛素抵抗的影响[J]. 中国运动医学杂志, 2012(04): 289-294.
[10] AHMAD T, CHASMAN D I, BURING J E,. Physical activity modifies the effect of LPL, LIPC, and CETP polymorphis-ms on HDL-C levels and the risk of myocardial infarction in wo-men of European ancestry[J]. Circ Cardiovasc Genet, 2011, 4(1): 74-80.
[11] GONZALEZ-MUNIESA P, LOPEZ-PASCUAL A, DE ANERES J,. Impact of intermittent hypoxia and exercise on blood pressure and metabolic features from obese subjects suffering sleep apnea-hypopnea syndrome[J]. J Physiol Biochem, 2015, 71(3): 589-599.
[12] BROWN J D, PLUTZKY J. Peroxisome proliferator-activated receptors as transcriptional nodal points and therapeutic targets[J]. Circulation, 2007, 115(4): 518-533.
[13] HAN Q, YEUNG S C, IP M S,. Effects of intermittent hypoxia on A-/E-FABP expression in human aortic endothelial cells[J]. Int J Cardiol, 2010, 145(2): 396-398.
[14] HE W, BARAK Y, HEVENER A,. Adipose-specific peroxisome proliferator-activated receptor gamma knockout causes insulin resistance in fat and liver but not in muscle[J]. Proc Natl Acad Sci U S A, 2003, 100(26): 15712-15717.
[15] JIANG C, SUN J, DAI Y,. HIF-1A and C/EBPs transcrip-tionally regulate adipogenic differentiation of bone marrow-deriv-ed MSCs in hypoxia[J]. Stem Cell Res Ther, 2015, 6: 21.
[16] KARBIENER M, FISCHER C, NOWITSCH S,. MicroRNA miR-27b impairs human adipocyte differentiation and targets PPARgamma[J]. Biochem Biophys Res Commun, 2009, 390(2): 247-251.
[17] LIU S Y, ZHANG Y Y, GAO Y,. MiR-378 Plays an Important Role in the Differentiation of Bovine Preadipocytes[J]. Cell Physi-ol Biochem, 2015, 36(4): 1552-1562.
[18] LOPASCHUK G D, USSHER J R, FOLMES C D,. Myocard-ial fatty acid metabolism in health and disease[J]. Physiol Rev, 2010, 90(1): 207-258.
[19] LOZANO-VELASCO E, CONTRERAS A, CRIST C,. Pitx-2c modulates Pax3+/Pax7+ cell populations and regulates Pax3 expression by repressing miR27 expression during myogene-sis [J]. Dev Biol, 2011, 357(1): 165-178.
[20] LU Y L, JING W, FENG L S,. Effects of hypoxic exercise training on microRNA expression and lipid metabolism in obese rat livers[J]. J Zhejiang Univ Sci B, 2014, 15(9): 820-829.
[21] MARQUART T J, ALLEN R M, ORY D S,. miR-33 links SREBP-2 induction to repression of sterol transporters[J]. Proc Natl Acad Sci U S A, 2010, 107(27): 12228-12232.
[22] MCGREGOR R A, CHOI M S. MicroRNAs in the regulation of adipogenesis and obesity[J]. Curr Mol Med, 2011, 11(4): 304-316.
[23] OUIMET M, EDIRIWEERA H N, GUNDRA U M,. MicroRNA-33-dependent regulation of macrophage metabolism directs immune cell polarization in atherosclerosis[J]. J Clin Invest, 2015, 125(12): 4334-4348.
[24] SONG A, WANG C, REN L,. Swimming improves high-fat induced insulin resistance by regulating lipid and energy metabolism and the insulin pathway in rats[J]. Int J Mol Med, 2014, 33(6): 1671-1679.
[25] SZOSTAK J, MIGUET-ALFONSI C, BERTHELOT A,. Training-induced anti-atherosclerotic effects are associated with increased vascular PPARgamma expression in apolipoprotein E-deficient mice[J]. Acta Physiol (Oxf), 2016, 216(2): 221-230.
[26] TOFIGHI A, RAHMANI F, JAMALI QARAKHANLOU B,. The effect of regular aerobic exercise on reverse cholesterol transport A1 and apo lipoprotein a-I gene expression in inactive women[J]. Iran Red Crescent Med J, 2015, 17(4): e26321.
[27] VICKERS K C, SHOUCRI B M, LEVIN M G,. MicroRNA-27b is a regulatory hub in lipid metabolism and is altered in dyslipidemia[J]. Hepatology, 2013, 57(2): 533-542.
[28] WIESNER S, HAUFE S, ENGELI S,. Influences of normobaric hypoxia training on physical fitness and metabolic risk markers in overweight to obese subjects[J]. Obesity (Silver Spring), 2010, 18(1): 116-120.
[29] YAMADA H, OHASHI K, SUZUKI K,. Longitudinal study of circulating miR-122 in a rat model of non-alcoholic fatty liver disease[J]. Clin Chim Acta, 2015, 446: 267-271.
[30] DANKEL S N, DEGERUD E M, BORKOWSKI K,. Weight cycling promotes fat gain and altered clock gene expression in adipose tissue in C57BL/6J mice[J]. Am J Physiol Endocrinol Metab, 2014, 306(2): E210-224.
[31] DISANZO B L, YOU T. Effects of exercise training on indicators of adipose tissue angiogenesis and hypoxia in obese rats[J]. Metabolism, 2014, 63(4): 452-455.
[32] EL-JACK A K, HAMM J K, PILCH P F,. Reconstitution of insulin-sensitive glucose transport in fibroblasts requires expression of both PPARgamma and C/EBPalpha[J]. J Biol Chem, 1999, 274(12): 7946-7951.
[33] FEINBERG M W, MOORE K J. MicroRNA Regulation of Atherosclerosis [J]. Circ Res, 2016, 118(4): 703-720.
[34] GLATZ J F, LUIKEN J J, BONEN A. Membrane fatty acid transporters as regulators of lipid metabolism: implications for metabolic disease[J]. Physiol Rev, 2010, 90(1): 367-417.
[35] HAUFE S, WIESNER S, ENGELI S,. Influences of normobaric hypoxia training on metabolic risk markers in human subjects[J]. Med Sci Sports Exerc, 2008, 40(11): 1939-1944.
[36] JI J, ZHANG J, HUANG G,. Over-expressed microRNA-27a and 27b influence fat accumulation and cell proliferation during rat hepatic stellate cell activation[J]. FEBS Lett, 2009, 583(4): 759-766.
[37] KANG T, LU W, XU W,. MicroRNA-27 (miR-27) targets prohibitin and impairs adipocyte differentiation and mitochondrial function in human adipose-derived stem cells[J]. J Biol Chem, 2013, 288(48): 34394-34402.
[38] LAM D C, XU A, LAM K S,. Serum adipocyte-fatty acid binding protein level is elevated in severe OSA and correlates with insulin resistance[J]. Eur Respir J, 2009, 33(2): 346-351.
[39] LI X, LIAN F, LIU C,. Isocaloric pair-fed high-carbohydrate diet induced more hepatic steatosis and inflammation than high-fat diet mediated by miR-34a/SIRT1 axis in Mice[J]. Sci Rep, 2015, 5: 16774.
[40] LIN Q, GAO Z, ALARCON R M,. A role of miR-27 in the regulation of adipogenesis[J]. FEBS J, 2009, 276(8): 2348-2358.
[41] LIU W X, ZHOU F, WANG Y,. Voluntary exercise protects against ulcerative colitis by up-regulating glucocorticoid-mediated PPAR-gamma activity in the colon in mice[J]. Acta Physiol (Oxf), 2015, 215(1): 24-36.
[42] LU Y Z, WANG J, ZHANG C Y,. The cardioprotective effects of ischemic postconditioning on myocardial interstitium following ischemic/reperfusion in rats[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2014, 30(5): 431-435.
[43] LUI M A, MAHALINGAM S, PATEL P,. High-altitude ancestry and hypoxia acclimation have distinct effects on exercise capacity and muscle phenotype in deer mice[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 308(9): R779-791.
[44] MARTIN G G, LANDROCK D, LANDROCK K K,. Relative contributions of L-FABP, SCP-2/SCP-x, or both to hepatic biliary phenotype of female mice[J]. Arch Biochem Biophys, 2015, 588: 25-32.
[45] MOZOS A, CATASUS L, D'ANGELO E,. The FOXO1-miR27 tandem regulates myometrial invasion in endometrioid endometrial adenocarcinoma[J]. Hum Pathol, 2014, 45(5): 942-951.
[46] MUNSHI A, BABU M S, KAUL S,. Association of LPL gene variant and LDL, HDL, VLDL cholesterol and triglyceride levels with ischemic stroke and its subtypes[J]. J Neurol Sci, 2012, 318(1-2): 51-54.
[47] ORTIZ-MASIA D, DIEZ I, CALATAYUD S,. Induction of CD36 and thrombospondin-1 in macrophages by hypoxia-inducible factor 1 and its relevance in the inflammatory process[J]. PLoS One, 2012, 7(10): e48535.
[48] PARMAKSIZ G, NOYAN A, DURSUN H,. Role of new biomarkers for predicting renal scarring in vesicoureteral reflux: NGAL, KIM-1, and L-FABP[J]. Pediatr Nephrol, 2016, 31(1): 97-103.
[49] PRICE N L, FEMANDEZ-HERNANDO C. miRNA regulation of white and brown adipose tissue differentiation and function[J]. Biochim Biophys Acta, 2016, 1861(12 Pt B): 2104-2110.
[50] QIN N, CHEN Y, JIN M N,. Anti-obesity and anti-diabetic effects of flavonoid derivative (Fla-CN) via microRNA in high fat diet induced obesity mice[J]. Eur J Pharm Sci, 2016, 82: 52-63.
[51] STORCH J, THUMSER A E. Tissue-specific functions in the fatty acid-binding protein family[J]. J Biol Chem, 2010, 285(43): 32679-32683.
[52] XIE W, LI L, ZHANG M,. MicroRNA-27 prevents atherosclerosis by suppressing lipoprotein lipase-induced lipid accumulation and inflammatory response in apolipoprotein e knockout mice [J]. PLoS One, 2016, 11(6): e0157085.
[53] YANG H, LI TW, ZHOU Y,. Activation of a novel c-Myc-miR27-prohibitin 1 circuitry in cholestatic liver injury inhibits glutathione synthesis in mice[J]. Antioxid Redox Sign, 2015, 22(3): 259-274.
Study on Hypoxia Exercise Inducing miR - 27 / PPARγ to Regulate Fatty Acids Metabolism in Obese Rat’s Liver
ZHU Lei1,LU Ying-li2,FENG Lian-shi2
1.Qufu Normal University,Qufu 273165,China;2.China Institute of Sport Science,Beijing 100061,China.
Objective: To explore the sequential effects of hypoxic exercising on miR - 27 / PPARγ and lipid metabolism target gene and protein expression levels in the obesity rat’s liver. Methods: Fifty 13-week-old male diet-induced obesity rats were randomly divided into five groups (n=10 each): Control group (C), 1-week hypoxic exercise group (E1), 2-week hypoxic exercise group (E2), 3-week hypoxic exercise group (E3) and 4-week hypoxic exercise group (E4). All the rats were trained with a treadmill for 1 h/day, 5 d/week for a total of 4 weeks, and the control group was trained in the normal oxygen environment with the speed of 25 m/min, but the hypoxic groups were trained in the 13.6% hypoxic environment. To detect the concentrations of serum total cholesterol (TC), triglyceride (TG), low density lipoprotein (LDL-C), high-density lipoprotein (HDL-C) levels. MicroRNA-27(miR-27) expression levels in the liver were determined by Real-time PCR. Protein and mRNA expression levels of PPARγ、CD36、ATGL、LPL、L-FABP、SREBP1 were tested by western blot and immunohistochemistry in the obesity rat liver. Results: The fat/body weight ratio and the concentrations of TC, TG, LDL-C were gradually decreased in obese rats during four weeks hypoxic exercise, but the concentrations of HDL-C were gradually increased. With the prolonged hypoxic exercise time, the expression of miR-27 was gradually decreased in the liver of obese rat, E3 and E4 were significantly higher than other groups (≤0.01).However, the expression levels of PPARγ、CD36、ATGL、LPL were gradually increased, and the levels of CD36 in E4 group were significantly higher than C group (≤), the levels of AGTL were significantly lower than E2 group (≤), E3 and E4 group (≤), the levels of LPL were significantly lower than E2 and E3 group (≤), especially lower than E4 group (≤). Meanwhile, the levels of L-FABP were the highest in E1 group, which were significantly higher than C group (≤), but the expression levels of SREBP1 were no significant change. Conclusion: The expression of miR-27 in the obese rat liver was negatively correlated with the hypoxic exercise time, and hypoxic exercise could affect PPARγ expression and its downstream fatty acid metabolism related target genes and target proteins expression, improve the blood lipid level through miR-27. Finally, the lipid content was gradually decreased with the prolonged hypoxic exercise time.
G804.2
A
1002-9826(2018)01-0115-08
10.16470/j.csst.201801016
2017-08-10;
2017-12-25
国家自然科学基金资助项目(31471139)。
朱磊,男,副教授,博士,主要研究方向为低氧训练调控脂代谢的机制,E-mail:zhulei316@126.com。
冯连世,男,研究员,主要研究方向为运动训练监控、高原(低氧)训练。
