抗肿瘤药物所致神经毒性防治的研究进展*
2018-02-02综述罗春香杨润祥审校
董 超 综述,罗春香,杨润祥 审校
(昆明医科大学第三附属医院/云南省肿瘤医院内二科,昆明 650118)
化学药物治疗是抗肿瘤治疗的主要手段之一,在取得疗效的同时会引起治疗相关的神经系统的毒副作用。化疗药物引起的神经毒性主要包括中枢神经系统毒性、外周神经系统毒性和感受器毒性3个方面,其中CIPN(chemotherapy induced peripheral neurotoxicity,CIPN)是临床常见的剂量限制性不良反应,发病率为30%~40%[1]。引起CIPN常见的化疗药物有紫杉醇类、铂类、长春碱类、沙利度胺、硼替咪唑等。CIPN的发生与化疗药物的类型、累积化疗剂量及患者个人因素等相关,其可长期持续存在,不同程度地影响患者生活质量和精神心理,进而还会影响患者对化疗的耐受性,演变成严重、持久的甚至终身残疾的不良事件,因此需要引起高度重视。
抗肿瘤化疗药物引起的CIPN呈药物剂量依赖性,多以感觉神经受累为主,表现为双侧、远端、对称性的感觉障碍,感觉丧失、迟钝麻木和神经性刺痛,腱反射消失,呈现“袜子和手套”样分布,通常从足部开始对称发展,但也可能同时出现在双手和双足,有时会与手足综合征(肢端红斑)混淆。CIPN的致病机制尚不明确,不同药物因发病机制不同而具有相应的临床特征。多项研究结果显示诱发神经毒性的靶点为背根神经节(dorsal root ganglia,DRG),因其缺乏有效的血-神经屏障保护,更容易受到神经毒性的损害。除了DRG外,卫星细胞、施旺氏细胞、脊髓神经元和神经胶质细胞也是神经毒性的作用靶点。还有研究显示,细胞DNA损伤、细胞修复系统的异常、线粒体的改变、细胞内活性氧的增加、离子通道的改变、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和异位伤害性感受器的激活都可以激发CIPN和神经疼痛的发生[2-4]。
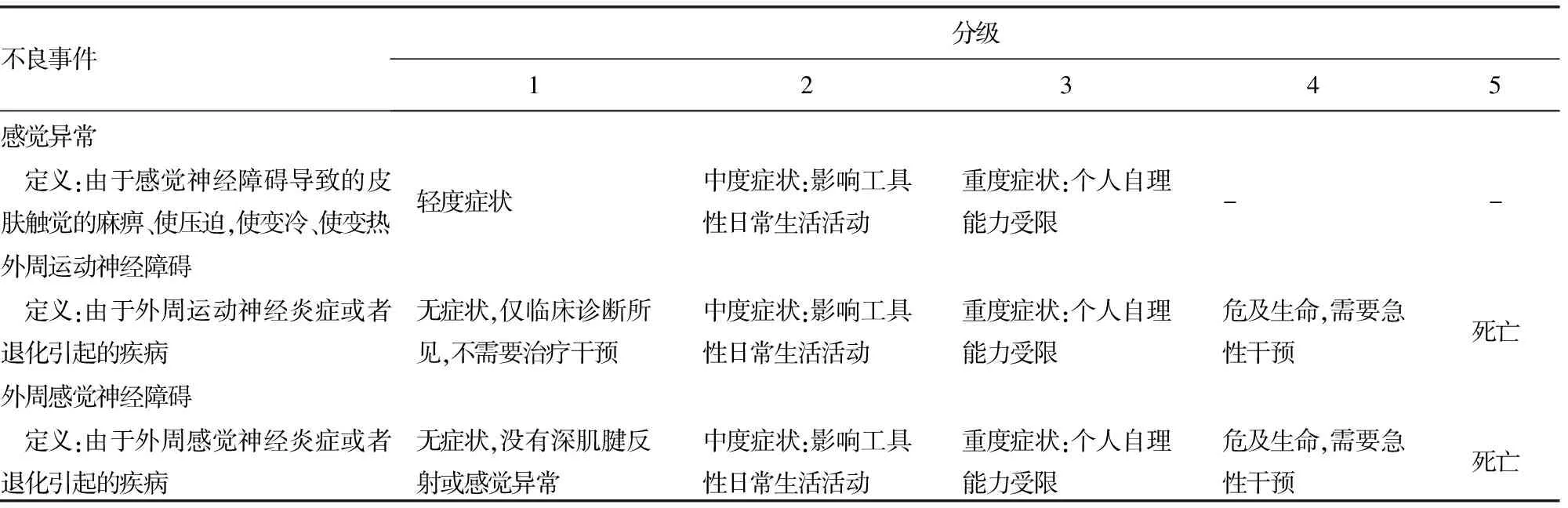
表1 神经系统不良反应事件评价标准(CTCAE 4.0版)
用于CIPN研究的临床评估量表有:(1)周围神经病变评分(peripheral neuropahty,PNP),(2)疼痛评价量表(pain quality assessment scale),(3)CIPN生活质量问卷-N20(QLQ-CIPNN20),(4)神经病变总体评分(total neuropathy score,TNS)。TNS是目前能同时从主观和客观两方面评价化疗药物诱导的周围神经损伤的一种工具[5]。各研究中心采用的诊断标准存在差异,因此尚无CIPN统一规范的诊断标准。在患者进行神经毒性化疗药物治疗前进行恰当的基线评估,协助患者确定神经病变的存在。评价体系应该包括神经功能障碍的客观依据和患者实际的临床症状,基线评估可用于最早识别CIPN,但长期随访在整个治疗过程具有至关重要的意义[6-7]。近年来应用药物基因技术遗传多态性鉴定和识别不同个体的神经毒性易感性的潜在差异,但仍缺乏遗传变异和神经毒性风险之间关联性的共识[8-9]。2010年6月,美国国家癌症研究所(National Cancer Institute,NCI)发布了常见不良反应事件评价标准(CTCAE)4.0版本,对化疗的不良反应的严重度进行评价,并对每1种不良反应的严重度从1~5级进行了特定的临床描述。神经系统的不良事件评价标准[10-11],见表1。不同的化疗药物作用不同的个体,结合药理学和遗传的变化,CIPN亦有不同。深入研究CIPN不仅需要随机对照试验,还需要足够数量受试者的观察性研究,才能对临床实践有真正的价值和意义[12]。
不同的化疗药物所致的CIPN临床表现是相似的,而不同药物所致神经毒性的潜在风险和作用机制是不同的,下面对临床常见的化疗药物的神经毒性做一介绍。
1 紫杉醇类
紫杉醇是一种新型的抗肿瘤药物,具有广谱的抗癌活性。其致CIPN的机制尚不明确,多项动物实验结果显示紫杉醇在DRG蓄积浓度较周围神经浓度高,可能通过破坏DRG上微管结构,导致轴突内的信息传递和供能障碍,从而发挥毒性作用[13-14]。紫杉醇抗肿瘤机制是促进微管蛋白聚集,影响轴突的运输,阻止细胞的有丝分裂,这一特性可能同样成为其损害神经系统的机制。紫杉醇的微管凝聚作用可能会通过干扰微管的形成,并影响快速轴突的信号运输和功能障碍。还有研究结果显示,紫杉醇所致神经病变与轴突中线粒体肿胀呈空泡状的显著增加有关,其打开了线粒体通透性转换孔,引起了线粒体中钙的释放,影响钙介导的神经元兴奋性,对其诱发神经毒性有一定作用[15-16]。
紫杉醇类所致的神经毒性呈剂量依赖性,通常发生在累积剂量超过300 mg/m2。累积剂量越高,神经毒性的发生率高,可出现近端肌无力,严重者可发展为肌肉疼痛。紫杉醇诱导的急性神经病变包括急性疼痛综合征,发生在治疗后的1~4 d,临床表现为严重的关节痛和肌肉酸痛,尤其出现在接受高累积剂量的紫杉醇患者中。一项紫杉醇和奥沙利铂引起的神经毒性的对比研究显示,这两种药物引起的慢性感觉神经病变,是比疼痛更为常见的麻木感和刺痛感。与奥沙利铂相比,紫杉醇引起的急性神经毒性更为常见,程度更重[17]。
多中心随机研究结果显示,使用紫杉醇化疗持续输注时间越短,神经毒性的风险越大(3 hvs.24 h),考虑神经毒性的发生与紫杉醇血药浓度峰值有关[18],不同的滴注时间疗效是相似的,但神经毒性的发生率和严重程度存在个体差异,总体来看,女性发生率较低[19]。然而,长期的紫杉醇治疗可能导致轴索变性,轻至中度的症状会持续存在,3年的随访中有39%的患者仍有主观神经系统异常[20]。与紫杉醇相比,多西他赛导致的神经毒性的发病率更加频繁,其特点是轻微或中度感觉轴索病变[21]。最近一项入组1 031例早期乳腺癌患者在治疗后1~3年内,约15%的患者持续存在多西他赛所致的神经毒性,并对生活质量造成不同程度影响。多西他赛的每周给药方案出现剂量限制性肌无力和神经毒性发病率更高[22]。有极少数罕见报道转移性乳腺癌患者使用多西他赛治疗后出现Lyell综合征(毒性表皮坏死松解综合征)[23]。
2 铂 类
临床上常用的铂类药物有顺铂、卡铂和奥沙利铂,铂类衍生物很难穿过血脑屏障,但与周围神经有很高的亲和力,顺铂和奥沙利铂的神经毒性较卡铂严重。顺铂导致的神经毒性表现为CIPN,且呈剂量依赖性。主要症状为四肢麻木、刺痛、感觉异常、肌肉痉挛和疼痛、本体感觉和深腱反射消失,疼痛症状明显,病变始于四肢远端,手足常见。即使治疗停止,神经症状还会继续恶化,可能持续数周或数月,称为“滑行现象”[24]。约30%的肿瘤患者在使用顺铂治疗是会出现剂量限制性神经毒性,现已发现,顺铂的累积剂量大于300 mg/m2时CIPN发病率约为45%,500~600 mg/m2时,几乎所有患者都难于幸免[25]。PODRATZ等[26]研究显示,由于DRG缺乏屏障保护,顺铂在鼠和人的DRG易于积累,造成胞体、胞核及核仁的皱缩改变,顺铂-DNA的加合物加速轴突转运减退和脊根神经节神经元凋亡,是导致神经毒性的重要机制之一。动物实验结果显示,在鼠DRG神经元,顺铂结合细胞核和线粒体DNA(mtDNA)诱导的DNA损伤和凋亡。铂-DNA的加合物抑制线粒体DNA的复制和转录导致线粒体退化,引起CIPN,明确线粒体特定的动力学和功能可能是治疗顺铂导致神经毒性的关键靶点[27]。卡铂的神经毒性较少见,产生的症状与顺铂类似,多见与紫杉醇联用时的报道[28-29]。奥沙利铂的神经毒性最为明显,包括急性和累积性神经毒性,表现为手、足和口周感觉异常和迟钝,握力减低。约1%~2%的患者发生急性喉痉挛,85%~95%的患者遇冷会激发和加重神经毒性。对肠癌患者的研究结果显示,贫血、高BMI和低镁血症等因素会加重神经毒性的发生[30]。而且神经毒性在奥沙利铂化疗间歇期仍持续存在,刺痛是最严重的症状,其次是麻木和疼痛,急性和慢性神经病变的严重程度是有关系的[31]。回顾性分析结果显示,大量患者即使停用奥沙利铂1年后仍有神经毒性症状[32]。目前还没有充足的证据证实,神经保护剂能够预防和减轻铂类药物的神经毒性。相关研究显示,氨磷汀、钙、镁、谷胱甘肽、维生素E可能有利于其降低化疗所致的神经毒性,但还需要深入研究[33]。
3 长春碱类
长春碱类化疗药物表现为周围神经损害最常见,呈渐进性的感觉运动性CIPN,最早出现在手,然后足,逐渐发展为精细动作障碍和行走受限,发病率为35%~45%[34-35]。长春碱类是儿童恶性肿瘤的常用治疗药物,其神经毒性有强烈剂量依赖性[36]。当剂量超过2 mg/m2就会出现神经毒性,而且和单次剂量也有关。因此无论体表面积多少,2 mg都是单次使用的最大剂量。几乎所有使用过长春新碱的患儿均出现神经毒性症状[37]。具体机制尚不明确,有研究认为其通过抑制神经轴突的微管功能而产生神经毒性。长春新碱和微管蛋白二聚体之间具有较强的亲和力有关,微管蛋白二聚体可阻止可溶性调节器与微管蛋白发生聚合作用。微管蛋白的结构变化导致外周神经轴索运输系统的损伤,除了最初的轴索损伤,施万细胞破坏后还可导致有髓神经纤维的继发性脱髓鞘和轴索变性[38-39]。
长春瑞滨神经毒性多表现为腱反射消失和下肢感觉异常,也可表现为胃肠植物神经麻痹而引起便秘和麻痹性肠梗阻,但后者发生罕见。MAASS等[40]研究评估伊马替尼联合长春瑞滨治疗转移性乳腺癌患者的有效性和安全性,结果显示约12.1%患者出现CIPN,9.1%为重度不良反应,总体来说,发病率不高,毒副反应可控。长春瑞滨作用机制是与微管蛋白结合,使细胞在有丝分裂过程中微管形成障碍,作用与长春新碱类似,当浓度大于12 mmol/L时可阻断G2-M期,此外,其对轴突微管也有亲和力。
4 其他细胞毒药物
硼替佐米和沙利度胺治疗多发性骨髓瘤患者有显著疗效,延长了生存时间。然而治疗引起的CIPN是一种常见的不良反应,危险因素包括高龄、前神经病变和使用其他药物的病史等[41]。LIU等[42]研究结果显示,与沙利度胺联合治疗时,在保证疗效的同时,尽可能减少神经毒性的发生率和严重程度,硼替佐米皮下使用剂量为1.3 mg/m2是比较合适的。LUO等[43]对1 264例患者的队列研究结果显示,与沙利度胺相比,来那度胺引起CIPN的风险较低(HR 0.71,95%CI:0.56~0.92)。
蒽环类药物(阿霉素、柔红霉素、米托蒽醌及表阿霉素)作用于DNA分子阻止其转录合成,因此CIPN很少见。KESLER等[44]研究显示,蒽环类药物对大脑特定的认知区域及大脑神经网络连接有不利影响。抗代谢类药物通常是酶的抑制剂,阻碍DNA和RNA的合成,故CIPN亦很少见。一项针对晚期转移性胰腺癌临床研究显示,白蛋白紫杉醇联合吉西他滨的疗效明显提高,但患者神经毒性的发生率明显增高(54%),而治疗持续时间和生存期越长的患者,其发生率越高[45]。
5 治 疗
高风险个体的识别是降低神经毒性发生率的关键,糖尿病、高龄、既往已有CIPN、酗酒、营养问题、感染等因素均可使CIPN的发生率增高。调整化疗药物的剂量是预防CIPN的最有效的策略[46]。2014年4月美国临床肿瘤学会(ASCO)发布了一项针对成人癌症幸存患者化疗引起的CIPN的预防和治疗的临床实践指南。由于缺乏高质量、一致性证据,其不推荐使用任何药物用于CIPN的预防。钙镁合剂长期以来被认为是预防奥沙利铂相关神经毒性很有前景的药物。但CHARLES等[47]研究结果表明钙镁合剂无法改善奥沙利铂引起的急性神经病变。
CIPN多可在治疗终止后自行缓解或消失,但治疗期间仍对患者生活质量有一定影响。其症状主要为感觉异常和神经疼痛,感觉异常通常使用神经营养药物预防、改善,如氨磷汀、谷氨酰胺、乙酰左旋肉碱和维生素E等。而神经疼痛治疗药物包括各种阿片类药物、三环类抗抑郁药、抗惊厥药、5-羟色胺再摄取抑制剂(serotonin reuptake inhibitor,SSRI)类和非甾体类抗炎药物。基于安慰剂对照临床试验的阳性结果,推荐度洛西汀用于化疗引起的外周神经病变的治疗,且认为是最优选药物[48]。度洛西汀可能对奥沙利铂诱发性(而非紫杉醇诱发性)痛性神经病变更有效,这一点还有待更多研究证实。同时也列出了其他可选药物,尽管缺乏强有力证据,对于三环类抗抑郁药物、加巴喷丁和含有巴氯芬、氯胺酮和阿米替林的外用凝胶等药物不推荐常规使用,但对症状明显的患者可以试用。
化疗相关的CIPN正在长期影响和困扰着肿瘤患者。尽管神经系统具有一定的恢复再生能力,但细胞毒药物在发挥抗肿瘤作用的同时,亦可严重损害神经系统造成长期或永久性的功能障碍。CIPN管理可以采用多学科协作的模式[49],不仅规范治疗,更需要早期识别和正确评估神经毒性,关注患者的临床症状,共同防止神经毒性不可逆损伤发生,减轻患者病痛。
[1]TAILLIBERT S,LE R E,CHAMBERLAIN M C.Chemotherapy-Related neurotoxicity[J].Curr Neurol Neurosci Rep,2016,16(9):81.
[2]CAVALETTI G,ALBERTI P,MARMIROLI P.Chemotherapy-induced peripheral neurotoxicity in cancer survivors:an underdiagnosed clinical entity?[J].Am Soc Clin Oncol Educ Book,2015:35(6) :e553-e560.
[3]CAROZZI V A,CANTA A,CHIORAZZI A.Chemotherapy-induced peripheral neuropathy:What do we know about mechanisms?[J].Neurosci Lett,2015,596(596):90-107.
[4]LI Y,ZHANG H M,KOSTURAKIS A K,et al.MAPK signaling downstream to TLR4 contributes to paclitaxel-induced peripheral neuropathy[J].Brain Behav Immun,2015,49(49):255-266.
[5]GUTIÉRREZ-GUTIÉRREZ G,SERENO M,MIRALLES A,et al.Chemotherapy-induced peripheral neuropathy:clinical features,diagnosis,prevention and treatment strategies[J].Clin Transl Oncol,2010,12(2):81-91.
[6]BEIJERS A J,JONGEN J L,VREUGDENHIL G.Chemotherapy-induced neurotoxicity:the value of neuroprotective strategies[J].Neth J Med,2012,70(1):18-25.
[7]CAVALETTI G,CORNBLATH D R,MERKIES I S,et al.The chemotherapy-induced peripheral neuropathy outcome measures standardization study:from consensus to the first validity and reliability findings[J].Ann Oncol,2013,24(2):454-462.
[8]REYES-GIBBY C C,WANG J,YEUNG S C,et al.Informative gene network for chemotherapy-induced peripheral neuropathy[J].Bio Data Min,2015,8(8):24.
[9]CAVALETTI G,ALBERTI P,MARMIROLI P.Chemotherapy-induced peripheral neurotoxicity in the era of pharmacogenomics[J].Lancet Oncol,2011,12(12):1151-1161.
[10]CAVALETTI G,FRIGENI B,LANZANI F,et al.Chemotherapy-Induced peripheral neurotoxicity assessment:a critical revision of the currently available tools[J].Eur J Cancer,2010,46(3):479-494.
[11]NATIONAL CANCER INSTITUTE PRO-CTCAE STUDY GROUP.Validity and reliability of the US National Cancer Institute′s patient-reported outcomes version of the common terminology criteria for adverse events (PRO-CTCAE)[J].JAMA Oncol,2015,1(8):1051-1059.
[12]ABDI S,DOUGHERTY P M.Chemotherapy-induced peripheral neuropathy:a challenge for clinicians[J].Oncology,2011,30(11):1030.
[13]LI Y,TATSUI C E,RHINES L D,et al.Dorsal root ganglion neurons become hyperexcitable and increase expression of voltage-gated T-type Calcium channels(Cav3.2)in paclitaxel-induced peripheral neuropathy[J].Pain,2017,158(3):417-429.
[14]LAPOINTE N E,MORFINI G,BRADY S T,et al.Effects of eribulin,vincristine,paclitaxel and ixabepilone on fast axonal transport and kinesin-1 driven microtubule gliding:implications for chemotherapy-induced peripheral neuropathy[J].Neurotoxicology,2013,37(4):231-239.
[15]TASNIM A,RAMMELKAMP Z,SLUSHER A B,et al.Paclitaxel causes degeneration of both central and peripheral axon branches of dorsal root ganglia in mice[J].BMC Neurosci,2016,17(1):47.
[16]CAROZZI V A,CANTA A,CHIORAZZI A.Chemotherapy-induced peripheral neuropathy:What do we know about mechanisms?[J].Neurosci Lett,2015,596(2):90-107.
[17]PACHMAN R,QIN R,SEISLER D,et al.Comparison of oxaliplatin and paclitaxel-induced neuropathy(Alliance A151505)[J].Support Care Cancer,2016,24(12):5059-5068.
[18]SMITH E,BROWN M,MAMOUNAS P,et al.Randomized trial of 3-hour versus 24-hour infusion of high-dose paclitaxel in patients with metastatic or locally advanced breast cancer:national surgical adjuvant breast and bowel project protocol B-26[J].J Clin Oncol,1999,17(11):3403-3411.
[19]WILLIAMS C,BRYANT A.Short versus long duration infusions of paclitaxel for any advanced adenocarcinoma[J].Cochrane Database Syst Rev,2011,11(5):CD003911.
[20]KANDULA T,PARK S B,COHN R J,et al.Pediatric chemotherapy induced peripheral neuropathy:A systematic review of current knowledge[J].Cancer Treat Rev,2016,50(11):118-128.
[21]OSMANI K,VIGNES S,AISSI M,et al.Taxane-induced peripheral neuropathy has good long-term prognosis:a 1- to 13-year evaluation[J].J Neurol,2012,259(9):1936-1943.
[22]CHU H,JOO L,SOOK L,et al.Current use of drugs affecting the central nervous system for chemotherapy-induced peripheral neuropathy in cancer patients:a systematic review[J].Support Care Cancer,2015,23(2):513-524.
[23]ARSHAD F,BHAT T S,LONE A R.Docetaxel induced Lyell′s syndrome:a rare life threatening cause of dermatitis medicamentosas[J].J Cancer Res Ther,2014,10(3):742-744.
[24]MCWHINNEY S R,GOLDBERG R M,MCLEOD H L.Platinum neurotoxicity pharmacogenetics[J].Mol Cancer Ther,2009,8(1):10-16.
[25]CAVALETTI G,MARZORATI L,BOGLIUN G,et al.Cisplatin-induced peripheral neurotoxicity is dependent on total-dose intensity and single-dose intensity[J].Cancer,1992,69(1):203-207.
[26]PODRATZ J L,KNIGHT A M,TA L E,et al.Cisplatin induced mitochondrial DNA damage in dorsal root ganglion neurons[J].Neurobiol Dis,2011,41(3):661-668.
[27]PODRATZ J L,LEE H,KNORR P,et al.Cisplatin induces mitochondrial deficits in Drosophila larval segmental nerve[J].Neurobiol Dis,2017,97(Pt A):60-69.
[28]EBATA T,YUNOKAWA M,BUN S,et al.Dose-dense paclitaxel plus carboplatin as neoadjuvant chemotherapy for advanced ovarian,fallopian tube,or primary peritoneal carcinomas[J].Cancer Chemother Pharmacol,2016,78(6):1283-1288.
[29]LEAL A D,QIN R,ATHERTON P J,et al.North central cancer treatment group/alliance trial N08CA-the use of glutathione for prevention of paclitaxel/carboplatin-induced peripheral neuropathy:a phase 3 randomized,double-blind,placebo-controlled study[J].Cancer,2014,120(12):1890-1897.
[30]SHAHRIARI-AHMADI A,FAHIMI A,PAYANDEH M,et al.Prevalence of oxaliplatin-induced chronic neuropathy and influencing factors in patients with colorectal cancer in Iran[J].Asian Pac J Cancer Prev,2015,16(17):7603-7606.
[31]PACHMAN R,QIN R,SEISLER K,et al.Clinical course of Oxaliplatin-Induced neuropathy:results from the randomized phase Ⅲ trial N08CB(alliance)[J].J Clin Oncol,2015,33(30):3416-3422.
[32]BEIJERS A J,MOLS F,VREUGDENHIL G.A systematic review on chronic oxaliplatin-induced peripheral neuropathy and the relation with oxaliplatin administration[J].Support Care Cancer,2014,22(7):1999-2007.
[33]ALBERS J,CHAUDHRY V,CAVALETTI G,et al.Interventions for preventing neuropathy caused by cisplatin and related compounds[J].Cochrane Database Syst Rev,2007,31(1):CD005228.
[34]GILCHRIST L S,MARAIS L,TANNER L.Comparison of two chemotherapy-induced peripheral neuropathy measurement approaches in children[J].Support Care Cancer,2014,22(2):359-366.
[35]LAPOINTE N E,MORFINI G,BRADY S T,et al.Effects of eribulin,vincristine,paclitaxel and ixabepilone on fast axonal transport and kinesin-1 driven microtubule gliding:implications for chemotherapy-induced peripheral neuropathy[J].Neurotoxicology,2013,37(4):231-239.
[36]MORA E,SMITH E M,DONOHOE C,et al.Vincristine-induced peripheral neuropathy in pediatric cancer patients[J].Am J Cancer Res,2016,6(11):2416-2430.
[37]LAVOIE SMITH E M,LI L,CHIANG C,et al.Patterns and severity of vincristine-induced peripheral neuropathy in children with acute lymphoblastic leukemia[J].J Peripher Nerv Syst,2015,20(1):37-46.
[38]BOYETTE-DAVIS J A,WALTERS E T,DOUGHERTY P M.Mechanisms involved in the development of chemotherapy-induced neuropathy[J].Pain Manag,2015,5(4):285-296.
[39]GOMBER S,DEWAN P,CHHONKER D.Vincristine induced neurotoxicity in cancer patients[J].Indian J Pediatr,2010,77(1):97-100.
[40]MAASS N,SCHEM C,BAUERSCHLAG D O,et al.Final safety and efficacy analysis of a phase Ⅰ/Ⅱ trial with imatinib and vinorelbine for patients with metastatic breast cancer[J].Oncology,2014,87(5):300-310.
[42]LIU H,XU R R,HUANG H M.Peripheral neuropathy outcomes and efficacy of subcutaneous bortezomib when combined with thalidomide and dexamethasone in the treatment of multiple myeloma[J].Exp Ther Med,2016,12(5):3041-3046.
[43]LUO J,GAGNE J J,LANDON J,et al.Comparative effectiveness and safety of thalidomide and lenalidomide in patients with multiple myeloma in the united states of america:a population-based cohort study[J].Eur J Cancer,2017,70(70):22-33.
[44]KESLER S R,BLAYNEY D W.Neurotoxic effects of anthracycline-vs. nonanthracycline-based chemotherapy on cognition in breast cancer survivors[J].JAMA Oncology,2016,2(2):185-192.
[45]GOLDSTEIN D,VON HOFF D D,MOORE M,et al.Development of peripheral neuropathy and its association with survival during treatment with nab-paclitaxel plus gemcitabine for patients with metastatic adenocarcinoma of the pancreas:a subset analysis from a randomised phase Ⅲ trial (MPACT)[J].Eur J Cancer,2016,52(52):85-91.
[46]SAAD M,TAFANI C,PSIMARAS D,et al.Chemotherapy-induced peripheral neuropathy in the adult[J].Curr Opin Oncol,2014,26(6):634-641.
[47]HERSHMAN D L,LACCHETTI C,DWORKIN R H,et al.Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers:american society of clinical oncology clinical practice guideline[J].J Clin Oncol,2014,32(18):1941-1967.
[48]LOPRINZI C L,QIN R,DAKHIL S R,et al.Phase III randomized,placebo-controlled,double-blind study of intravenous calcium and magnesium to prevent oxaliplatin-induced sensory neurotoxicity (N08CB/Alliance)[J].J Clin Oncol,2014,32(10):997-1005.
[49]STUBBLEFIELD M D,MCNEELY M L,ALFANO C M,et al.A prospective surveillance model for physical rehabilitation of women with breast cancer:chemotherapy-induced peripheral neuropathy[J].Cancer,2012,118(8 Suppl):2250-2260.
