复方新诺明联合二线药物治疗耐多药结核病的临床疗效分析*
2018-02-02曹培明严晓峰
曹培明,严晓峰,沈 明
(重庆市公共卫生医疗救治中心 400036)
20世纪中期结核病多采用单一的磺胺类药物进行治疗。近几十年来,随着利福平、异烟肼、乙胺丁醇等一系列经典抗结核药物的研发与推广,现多采用联合用药方式治疗结核[1]。但随着耐药菌株的不断出现,新药研发远远滞后于细菌变异[2]。此时,有学者提出老药新用的观点并在临床上取得一定的成效。复方新诺明(compound sulfamethoxazole,SMZ.Co)属于磺胺类抗菌药,是磺胺甲噁唑(sulfamethoxazole,SMZ)与甲氧苄啶(trimethoprim,TMP)的联合复方制剂,二者联用不仅增强了阻断细菌合成叶酸的作用、减轻了不良反应,同时也减轻了抗药性。近年来,国内外开展了多例SMZ.Co抗结核的研究,取得了较好疗效[3-7]。但将SMZ.Co用于治疗耐多药结核病(multiple drug-resistant tuberculosis,MDR-TB)患者的报道目前较少,现将研究报道如下。
1 资料与方法
1.1一般资料 收集本院2014年3月1日至2016年12月31日MDR-TB患者85例。按随机序列对纳入试验的患者进行编号,并给予与编号相对应的随机分配的3种治疗方案中的一种。3组分别为A组(SMZ.Co 0.96 g)、B组(SMZ.Co 0.48 g)和C组(对照组)。纳入标准:(1)半年内经药物敏感试验确诊为MDR-TB[8];(2)入组时痰涂片阳性;(3)年龄:18~65岁;(4)肝肾功能正常,空腹血糖小于6 mmol/L;(5)有治疗意愿,能理解本研究,愿意遵守研究方案并签署知情同意书。排除标准:(1)肺结核合并肺外结核病;(2)肺组织严重破坏,毁损超过1个肺叶或有2个以上空洞且其中之一直径大于3 cm或合并曲菌球;(3)对方案中任何药物有过敏史;(4)合并肝、肾、代谢、自身免疫性疾病,内分泌、血液、神经系统疾病,精神病,恶性肿瘤、长期服用免疫抑制剂或感染人免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS)患者等;(5)同时参加其他临床研究者。本研究已通过医院伦理委员会审查批准。
1.2方法
1.2.1治疗方案 A组:强化期使用阿米卡星(卷曲霉素)、SMZ.Co(0.96 g)、左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺、丙硫异烟胺(乙胺丁醇)方案6个月,继续期使用左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺、丙硫异烟胺(乙胺丁醇)方案12~18 个月(括号内为可替代药品)。B组:强化期使用阿米卡星(卷曲霉素)、SMZ.Co(0.48 g)、左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺、丙硫异烟胺(乙胺丁醇)方案6个月、继续期使用左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺,丙硫异烟胺(乙胺丁醇)方案12~18 个月(括号内为可替代药品)。C组:强化期使用阿米卡星(卷曲霉素)、左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺,丙硫异烟胺(乙胺丁醇)方案6个月,继续期使用左氧氟沙星(莫西沙星)、环丝氨酸(对氨基水杨酸)、吡嗪酰胺,丙硫异烟胺(乙胺丁醇)方案12~18 个月(括号内为可替代药品)。
1.2.2实验室检查 疗程结束后,对各组患者进行实验室检查,包括:(1)血常规检查、血沉检查、肝肾功能、血糖水平;(2)痰涂片、痰培养、药物敏感试验;(3)胸部X 射线及CT 检查。
1.2.3疗效评价指标 患者咳嗽、咳痰、痰菌转阴率、影像学检查及治疗转归情况等。
1.2.4治疗效果判定
1.2.4.1X射线检查 (1)病灶:明显吸收,吸收大于或等于1/2原病灶;吸收,吸收小于1/2原病灶;不变,无明显变化;恶化,扩大或播散。(2)空洞:闭合,闭合或阻塞闭合;缩小,缩小大于或等于原空洞直径1/2;不变,空洞直径无变化及缩小或增大小于原空洞直径1/2;增大,增大大于原空洞直径1/2。
1.2.4.2治疗转归 (1)治愈:完成规定的疗程,治疗终末连续2次涂片(培养)结果阴性,2次检查时间间隔 30 d;(2)死亡:在治疗过程中研究对象由于各种原因导致的死亡;(3)失败:治疗终末2个月内痰涂片(培养)有1次阳性;(4)丢失:由于任何原因治疗中断连续2个月或以上。
1.2.5治疗安全性 治疗期间,记录两组患者的不良反应,包括恶心呕吐、皮肤瘙痒、头晕头痛、过敏性休克等,同时对血尿常规、血生化进行检测。

2 结 果
2.1一般情况 MDR-TB 85例患者,男59例,女26例,平均年龄(37.1±11.0)岁。治疗过程中,A组有1例因经济原因回当地结核病防治所服用免费药物,失访;B组有1例在随访半年后病灶增加,住院后更换方案。最终本课题有83例患者完成治疗及随访工作:A组26例,其中男19例,女7例,平均年龄(35.5±14.4)岁;B组27例,其中男18例,女9例,平均年龄(39.0±9.4)岁;C组30例,其中男21例,女9例,平均年龄(37.8±8.9)岁。
2.2治疗效果 分别与C组相比,A组和B组的咳嗽、咳痰率均降低,差异有统计学意义(P<0.05);而痰菌转阴率、病灶、空洞的变化与治疗转归率的比较,差异均无统计学意义(P>0.05),见表1。
而与B组相比,A组患者的咳嗽、咳痰率、痰菌阴转率、病灶、空洞变化与治疗转归率差异均无统计学意义(P>0.05),见表1。
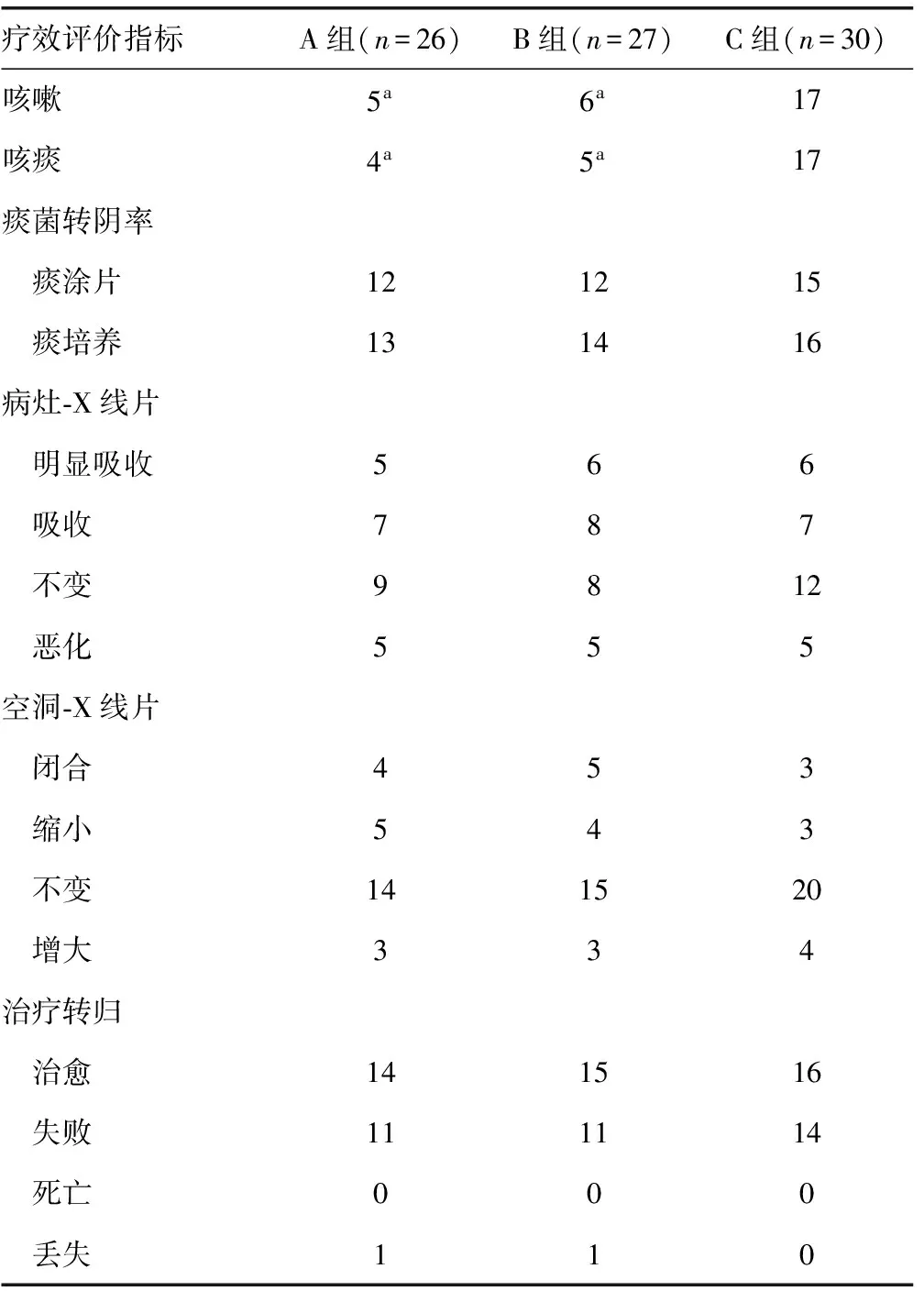
表1 3组MDR-TB患者抗结核治疗结果(n)
a:P<0.05,与C组比较

表2 3组MDR-TB患者咳嗽、咳痰情况(n)
a:P<0.05,与治疗前比较;b:P<0.05,与C组比较
2.3SMZ.Co对咳嗽、咳痰症状缓解的情况 3组患者在接受治疗前咳嗽、咳痰率比较差异无统计学意义(P>0.05)。治疗后1个月,B组及C组与治疗前比较差异均无统计学意义(P>0.05),A组与治疗前比较差异有统计学意义(P<0.05)。 A组与C组差异有统计学意义(P<0.05),B组与C组比较差异无统计学意义(P>0.05)。
治疗后2个月,B组与治疗前比较差异有统计学意义(P<0.05),且B组和C组比较差异也有统计学意义(P<0.05)。而C组与治疗前比较差异无统计学意义(P>0.05)。
治疗后6个月,C组与治疗前比较差异有统计学意义(P<0.05)。A、B组和C组比较差异有统计学意义(P<0.05)。A、B两组间比较差异无统计学意义(P>0.05),表明持续治疗6个月后,与C组相比,联合使用SMZ.Co的A、B组患者咳嗽、咳痰率明显下降,见表2。
2.4治疗安全性 3组患者均未出现过敏性休克等不良反应,个别患者出现恶心呕吐、头晕头痛、皮肤瘙痒等,未经特殊干预并在短时间内症状消除,部分患者出现肝功能异常,经给予保肝药物治疗后逐渐恢复正常,未影响此次研究,血尿常规指标均在正常范围内。
3 讨 论
结核治疗是抗结核药物与结核杆菌耐药性之间的一场博弈[8-9]。耐药结核病的传播、联合用药导致的药物不耐受、临床不合理用药以及新药研发滞后都是导致MDR-TB出现的原因,给结核病的治疗与控制带来了巨大挑战[10-12]。ALSAAD等[13]、HUANG等[14]及VILCHEZE等[15]老药新用,将古老的抗菌药物应用于耐药性细菌感染的治疗之中,并取得较好的临床疗效。SMZ.Co是SMZ与TMP的复方制剂。SMZ抑制细菌合成叶酸,TMP干扰叶酸的合成代谢。与单药相比,SMZ.Co抗菌作用较强、抗菌谱较广,半衰期长,在感染性疾病中的应用十分广泛[16-20]。
TMP联合SMZ对耐多药结核菌株有较好的体外抑菌活性,且该活性与细菌对其他药物是否耐药无关[3-4]。且SMZ.Co联合常规雾化治疗可明显改善支气管结核患者临床症状,提高痰菌转阴率[5-6]。本研究发现,经过6个月抗结核治疗后,虽然3组患者的咳嗽、咳痰率均比治疗前减少,但与服用常规二线药物患者相比,联合使用SMZ.Co患者的咳嗽、咳痰率更低。且联合使用SMZ.Co患者的咳嗽、咳痰率仅需1~2个月即能明显降低,对症状的缓解更为迅速,表明SMZ.Co对MDR-TB患者有转好的治疗效果,且无剂量依赖性。呼吸道传播是结核病传播的主要途径,而咳嗽、咳痰时带出的含有结核杆菌的飞沫是结核传播的主要介质。咳嗽、咳痰的减少可以减少结核患者向周围健康人群传播结核病。使结核的传播率得到有效控制。
还有研究发现,磺胺类药物是碳酸酐酶抑制剂的一种[21-24]。碳酸酐酶是人体内的一种含锌金属酶,可催化CO2和水的可逆反应,促进CO2生成HCO3-,在呼吸、体液循环、糖异生、肿瘤形成中起着重要作用。而碳酸酐酶和(或)带3蛋白是影响肺气体交换的重要因素。因此,笔者猜测SMZ.Co中的磺胺成分通过抑制碳酸酐酶,进而调控肺气体交换和体液循环,减少MDR-TB患者的咳嗽、咳痰等症状。
综上,TMP联合SMZ用药对MDR-TB有显著疗效,且SMZ不良反应少、价格低廉,可将其和常规抗结核治疗联合使用,缓解MDR-TB 患者的咳嗽、咳痰率,进而控制MDR-TB的传播。
[1]DEY T,BRIGDEN G,COX H,et al.Outcomes of clofazimine for the treatment of drug-resistant tuberculosis:a systematic review and meta-analysis[J].J Antimicrob Chemother,2013,68(2):284-293.
[2]WORLD H O.Companion handbook to the guidelines for the programmatic management of drug-resistant tuberculosis[R].Geneva:World Health Organization,2014,14(6):672-682.
[3]于霞,赵立平,姜广路,等.磺胺类药物对结核分枝杆菌的体外抑菌作用及与其他抗结核药物相互作用的研究[J].中国防痨杂志,2013,35(6):433-438.
[4]王静,李同心,聂晓平,等.磺胺类药物对结核分枝杆菌体外抗菌活性的研究[J].国际检验医学杂志,2015,36(23):3383-3384.
[5]刘红艳,胡萍.复方磺胺甲恶唑联合常规雾化治疗支气管结核的疗效观察[J].现代医学,2016,44(7):996-998.
[6]刘碧翠,皁仕鹤,余新华.复方磺胺甲恶唑联合常规雾化治疗支气管结核的临床疗效观察[J]中国生化药物杂志,2014,34(4):155-160.
[7]MACINGWANA L,BAKER B,NGWANE A H,et al.Sulfamethoxazole enhances the anti-mycobacterial activity of rifampicin[J].J Antimicrob Chemother,2012,67(12):2908-2911.
[8]中国防痨协会.耐药结核病化学治疗指南(2005)[J].中国防痨杂志,2015,37(5):421-469.
[9]中华人民共和国卫生部.卫生部全国结核病耐药性基线调查报告(2007-2008年)[M].北京:人民卫生出版杜,2010:25-52.
[10]WORLD H O.Global Tuberculosis Control:WHO Report 2011[J].Aust N Z J Public Health,36(5):497-498.
[11]中华人民共和国卫生部疾病预防控制局,中华人民共和国卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年版)[M].北京:中国协和医科大学出版社,2009.
[12]CHANG K C,LEUNG C C,YEW W W,et al.Pyrazinamide may improve fluoroquinolone-based treatment of multidrug-resistant tuberculosis[J].Antimicrob Agents Chemother,2012,56(11):5465-5475.
[13]ALSAAD D,VAN A R,PRANGER A D,et al.Evaluation of co-trimoxazole in treatment of multidrug-resistant tuberculosis[J].Euro Respir J,2012,42(8):829-837.
[14]HUANG T S,KUNIN C M,YAN B S,et al.Susceptibility of mycobacterium tuberculosis to sulfamethoxazole,trimethoprim and their combination over a 12 year period in Taiwan[J].Antimicrob Chemother,2012,67(3):633-637.
[15]VILCHEZE C,JACOBS W R.The combination of sulfamethoxazole.Trimethoprim,and isoniazid or rifampin is bactericidal and prevents the emergence of drug resistance in Mycobacterium tuberculosis[J].Antimicrob Agents Chemother,2012,56(10):5142-5248.
[16]KAPITO-TEMBO A,MESHNICK S R,VAN M B,et al.Marked reduction in prevalence of malaria parasitemia and anemia in HIV-infected pregnant women taking cotrimoxazole with or without sulfadoxine-pyrimethamine intermittent preventive therapy during pregnancy in Malawi[J].J Infect Dis,2011,203:464-472.
[17]ANTONIOU T,GOMES T,JUURLINK D N,et al.Trimethoprim-sulfamethoxazole-induced hyperkalemia in patients receiving inhibitors of the renin-angiotensin system:a population-based study[J].Arch Intern Med,2010,170:1045-1049.
[18]HUOVINEN P.Resistance to trimethoprim-sulfamethoxazole[J].Clin Infect Dis,2001,32(11):1608-1614.
[19]GOLDBERG E,PAUL M,TALKER O,et al.Co-trimoxazole versus vancomycin for the treatment of methicillin-resistant Staphylococcus aureus bacteraemia:a retrospective cohort study[J].J Antimicrob Chemother,2010,65:1779-1783.
[20]MERMIN J,EKWARU J P,LIECHTY C A,et al.Effect of co-trimoxazole prophylaxis,antiretroviral therapy,and insecticide-treated bednets on the frequency of malaria in HIV-1-infected adults in Uganda:a prospective cohort study[J].Lancet,2006,367:1256-1261.
[21]HASAN T,MUSTAFA D,SERPIL Y,et al.Carbonic anhydrase inhibitors.Novel sulfanilamide/acetazolamide derivatives obtained by the tail approach and their interaction with the cytosolic isozymes Ⅰ and Ⅱ,and the tumor-associated isozyme Ⅸ[J].Bioorg Med Chem,2005,15:367-372.
[22]VALERIA M,GIUSEPPINA D S,ANNA D F,et al.Carbonic anhydrase inhibitors:X-ray crystallographic studies for the binding of 5-amino-1,3,4-thiadiazole-2-sulfonamide and 5-(4-amino-3-chloro-5-fluorophenylsulfonamido)-1,3,4-thiadiazole-2-sulfonamide to human isoform Ⅱ[J].Bioorg Med Chem,2006,16:6204-6208.
[23]ANNA D F,ANDREA S,JEAN-YVES W,et al.Carbonic anhydrase inhibitors:Binding of an antiglaucoma glycosyl-sulfanilamide derivative to human isoform Ⅱ and its consequences for the drug design of enzyme inhibitors incorporating sugar moietiesq[J].Bioorg Med Chem,2007,17:1726-1731.
[24]宋春泽,周成合,袁勇.磺胺类碳酸酐酶抑制剂研究进展[J].中国新药杂志,2007,16(18):1438-1444.
