Tubacin对大鼠骨髓间充质干细胞膜表面结构及力学性能的影响*
2018-02-02周艳芳彭新生张琛琛梁嘉强
卢 芳,周艳芳△,彭新生,张琛琛,梁嘉强
(广东医科大学:1.病理生理学教研室;2.药剂学教研室,东莞 523808)
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)易于分离培养且免疫排斥弱,被广泛应用于干细胞移植治疗等组织工程学研究[1],然而移植的外源性BMSCs在体内损伤部位存活率低、生物分布十分有限,极大地阻碍了其临床应用,因此提高干细胞移植效率是目前迫切需要解决的问题之一。组蛋白去乙酰化酶(histone deacetylases,HDAC)通过去乙酰化修饰,在染色质重构,基因转录及蛋白质功能调控中起重要作用。最近研究表明,HDAC6参与脑损伤的发生、发展,而HDAC6抑制剂tubacin不仅参与脑损伤后抗炎抗凋亡、促进神经再生等保护机制,还可诱发干细胞激活并向受损区域迁移,促进脑缺血区域神经和血管新生[2-3]。本研究利用AFM对tubacin处理后的BMSC形貌和表面超微结构进行观察,以期更深入地了解tubacin对BMSC形态结构的改变及其与细胞迁移之间的关系。
1 材料与方法
1.1材料
1.1.1实验动物 幼年雄性清洁级SD大鼠2只,体质量约80~100 g,用于BMSCs原代培养(由南方医科大学实验动物中心提供)。第4代细胞用于实验。
1.1.2主要试剂及仪器 原子力显微镜(AFM,NanoScope-V,Veeco instruments,美国),倒置荧光显微镜(Olympus,日本),细胞培养箱(Thermo Scientific,美国),DMEM/F12液体培养基,胎牛血清,胰蛋白酶(Gibco,美国),tubacin(Sigma,美国),戊二醛(南京森贝伽生物科技有限公司)。
1.2方法
1.2.1BMSCs的分离及培养 大鼠颈椎脱臼处死,浸泡于75%乙醇消毒20 min。无菌操作原则下迅速剥离双侧胫骨及股骨,清除残余肌肉和结缔组织,保持骨膜及干骺端完整。无菌磷酸盐缓冲液(PBS)冲洗3遍后剪去双侧干骺端,用5 mL一次性注射器抽取DMEM培养基反复冲洗骨髓腔,尽量将骨髓组织全部冲出。随后将骨髓组织冲洗液移入15 mL离心管,1 000 r/min离心10 min,弃上清。加入含10%胎牛血清的DMEM/F12培养液5 mL,轻轻吹打混匀后接种于细胞培养瓶内,置于37 ℃、5% CO2培养箱培养。48 h后首次全量换液,保留贴壁细胞,之后隔天换液,当贴壁细胞达到80%~90%融合时,用0.25%胰酶消化,1 000 r/min离心5 min后按1∶2比例进行传代培养。
1.2.2四甲基偶氮唑蓝(MTT)法检测tubacin对BMSCs活力的影响 取指数生长期的BMSCs,0.25%胰酶消化离心收集细胞,用含10%胎牛血清的DMEM/F12培养基稀释成2×104/mL的细胞悬液,96孔培养板内每孔加入100 μL细胞悬液,计数每孔约含细胞2 000个,设置调零组,对照组,不同浓度(0.25、0.50、0.75、1.00、2.00 μmol/L tubacin)药物处理组,每组各设5个复孔。待细胞贴壁后吸出培养基,各组添加含不同浓度tubacin的培养基200 μL,阴性对照组添加相同体积的无血清培养基,置于培养箱继续培养24 h后,每孔加入20 μL浓度5 g/L 的MTT溶液继续培养4 h,吸去上清,每孔加200 μL二甲基亚砜(DMSO),结晶溶解后在波长490 nm的酶标免疫检测仪上测定各孔光吸收(A)值。按照公式计算细胞存活率:细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%,As:实验孔吸光度值;Ac:对照孔吸光度值;Ab:空白孔吸光度值。
1.2.3AFM样品制备与成像 收集生长良好的第4代BMSCs,调整密度至2×105/mL接种于35 mm的细胞培养皿,待细胞贴壁后各组分别加入含不同浓度tubacin的培养基,24 h后弃去培养基,PBS洗2次后用1%戊二醛固定细胞10 min,随后PBS洗3次,最后三蒸水洗涤2次,室温自然晾干。AFM在空气中采用接触模式对样品进行观察,ScanAsyst成像,Scanasyst-Air型探针,设置256个采样点,扫描速率为0.7 Hz。AFM图像全部经过自带软件(Nanoscope Analysis)平滑处理,以消除扫描方向上的低频背景噪音。AFM力谱用于分析力曲线计算杨氏模量,所有力曲线都在同一加载速率测得。

2 结 果
2.1BMSCs的原代培养及形态学观察 骨髓细胞接种于培养瓶后,细胞呈圆形,大小不一,胞体透亮悬浮于培养液中,首次换液后观察到部分细胞开始贴壁,呈圆形、梭形或多角形,以后贴壁细胞逐渐增多,6 d左右细胞融合80%~90%。消化传代12 h后大部分细胞贴壁,镜下观察BMSCs多呈长梭形或星形,细胞质丰富,核大而清晰,折光性好。细胞生长旺盛,每5天可传代1次,经过第1、2次传代后,细胞呈放射状或漩涡状同向排列,形态趋于一致,见图1。

A:原代培养第4天;B:原代培养第6天;C:第3代细胞;D:第4代细胞
图1不同时期的BMSC形态学观察(×40)

图2 不同浓度tubacin作用于BMSC 24 h后的细胞存活率

A、D:对照组;B、E:0.25 μmol/L tubacin组;C、F:0.50 μmol/L tubacin组
图3 BMSC的二维、三维形貌图

A、D:对照组;B、E:0.25 μmol/L tubacin组;C、F:0.50 μmol/L tubacin组
图4 BMSC高度直径图

A、D、G:对照组;B、E、H:0.25 μmol/L tubacin组;C、F、I:0.50 μmol/L tubacin组
图5 BMSC超微结构及膜表面粒径分布图
2.2MTT实验结果 与对照组相比,tubacin处理24 h后细胞存活率显著提高,以0.50 μmol/L tubacin组作用最为明显,存活率高达180%,当tubacin浓度提高到1.00 μmol/L以上时,细胞存活率下降,结果差异有统计学意义(P<0.05)。MTT结果表明,低浓度tubacin具有促BMSC增殖作用,因此,本实验选择0.25 μmol/L和0.50 μmol/L的tubacin作下一步细胞预处理,见图2。
2.3BMSC的AFM观察 AFM不仅有纳米级的高分辨率,而且能在高分辨率基础上观察样品的三维结构。应用AFM获得低浓度tubacin 预处理细胞的二维和三维图像,见图3。根据隆起的边缘可清楚辨别细胞位置和细胞质界限,BMSC以梭形为主,胞核大而清晰,丝状伪足形成毗邻细胞之间的网状连接。图4显示对照组细胞直径为43.7 μm,高度在20~100 nm之间,0.25 μmol/L tubacin处理组细胞直径为70.4 μm,高度在50~200 nm之间,0.50 μmol/L tubacin处理组细胞直径为81.4 μmol/L,高度在80~200 nm之间。结果显示,随着tubacin浓度的增加,细胞变得更狭长,拥有更长而丰富的伪足。图5A~F为BMSC膜表面5 μm×5 μm的超微结构图。对照组细胞膜表面粗糙不平整,有明显孔洞和凹陷,表面颗粒分布不均,堆积松散,高度多集中在50~200 nm(图5G)。随着tubacin浓度的增加,细胞表面更为光滑,颗粒分布均匀,大小在10~600 nm(图5H、I),表面颗粒连接紧密,或成团聚集(图5B),或呈条索状排列(图5C)。各实验组分别选取10个1 μm×1 μm的膜表面超微结构区域,用NanoScope Analysis软件进行测量,得到各组细胞膜表面粗糙度,结果显示tubacin处理组的细胞膜表面均方根粗糙度(Rq)及平均粗糙度(Ra)较对照组明显降低,见表1、图6。AFM可测量力-距离曲线用于分析各实验组细胞膜的机械性能,本实验测量的区域为1 μm×1 μm,每个区域测量256条力曲线,每个细胞测量5个不同区域,各组分别测量10个细胞并进行统计。杨氏模量反映细胞膜表面的刚性,杨氏模量越大,细胞越不易发生形变。图6为各组细胞杨氏模量对比,随着tubacin浓度的增加,杨氏模量逐渐增大,说明与对照组相比,tubacin处理后细胞骨架排列更为紧密,抗形变能力增强,可承受更多的机械应力。
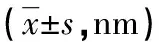
表1 各组BMSC膜表面Rq及Ra统计
a:P<0.05,与对照组比较

a:P<0.05,与对照组比较
图6 BMSCs膜表面粗糙度

A:对照组;B:0.25 μmol/L tubacin组;C:0.50 μmol/L tubacin组
图7杨氏模量统计分布图
3 讨 论
近年来,大量研究证实HDAC在细胞增殖分化中发挥重要作用[4-5],HDAC6是HDACs家族中最独特的成员,拥有2个锌指催化结构域,可特异性催化非组蛋白底物,参与调节众多生理病理进程。在胞内,HDAC6通过与α微管蛋白(α-tubulin)、皮层肌动蛋白(cortactin)、热休克蛋白90(HSP90)等底物蛋白相互作用,参与调节细胞运动[6]。
细胞的形貌结构与其生理状态和功能密切相关,细胞膜上分布的糖类、蛋白质和脂质等各类生物大分子,不仅保持着细胞膜的完整性,还负责传递细胞信号,参与调节细胞增殖、分化及细胞间相互作用[7],膜结构的改变被认为与细胞迁移、黏附密切相关[8-9]。本研究中,经tubacin处理的BMSC呈长梭形延伸铺展,拥有更丰富的伪足,这既有利于细胞间的信息传递,又能增加细胞与基底接触面积,从而增强细胞的运动能力[10]。膜表面粗糙度也是细胞超微结构的重要参数,它被证实与细胞骨架的完整性有关[11]。本研究中,tubacin处理后的细胞膜表面颗粒高度增加,粗糙度下降,这可能是细胞膜表面蛋白质等大分子增加和细胞内部骨架重新排列共同作用的结果。
细胞迁移是一个高度复杂的过程,首先细胞运动前端向迁移方向伸出伪足,与基质黏附并向前移动,同时细胞后缘回缩,与基质分离,这几个步骤循环重复,同时细胞内部不断进行骨架重排,结构不断发生变化[12-13]。细胞硬度可直接反应细胞骨架的构成,硬度高的细胞内部骨架排列更为紧密,在迁移过程中可承受更大外力并保持细胞内部结构的有序性[14]。此外,增加硬度还能为细胞运动时的伸展、回缩提供更强大驱动力,帮助维持运动方向,增强细胞迁移能力[15]。AFM力学检测结果表明tubacin处理组细胞杨氏模量更大,硬度增加,机械性能增强,有助于提升细胞迁移效率。
本研究结果提示,低浓度tubacin可促进BMSC增殖,引起细胞形貌及膜表面超微结构改变,增强细胞机械性能,有助于提高细胞移植治疗效率。本课题组将进一步检测低浓度tubacin对BMSC迁移、黏附能力的影响及其潜在作用机制,为干细胞移植疗法提供新思路。
[1]WANG X,WANG Y,GOU W L,et al.Role of mesenchymal stem cells in bone regeneration and fracture repair:a review[J].Int Orthop,2013,37(12):2491-2498.
[2]YUAN L M,WANG Z,LIU L H,et al.Inhibiting histone deacetylase 6 partly protects cultured rat cortical neurons from oxygen-glucose deprivation-induced necroptosis[J].Mol Med Rep,2015,12(2):2661-2667.
[3]汪皖君,管雅琳,王雅静,等.骨髓间充质干细胞移植对大鼠脑缺血再灌注损伤的神经保护作用[J].中风与神经疾病杂志,2016,33(11):1017-1020.
[4]SUN J Y,WANG J D,WANG X,et al.Marine-derived chromopeptide A,a novel class I HDAC inhibitor,suppresses human prostate cancer cell proliferation and migration[J].Acta Pharmacol Sin,2017,38(4):551-560.
[5]MARQUEZ-CURTIS L A,QIU Y Y,XU A A.Migration,proliferation,and differentiation of cord blood mesenchymal stromal cells treated with histone deacetylase inhibitor valproic acid[J].Stem Cells Int,2014,2014:610495.
[6]RAN J,YANG Y F,LI D W,et al.Deacetylation of α-tubulin and cortactin is required for HDAC6 to trigger ciliary disassembly[J].Sci Rep,2015,5:12917.
[7]WU L T,DONG H J,ZHAO J,et al.Diosgenin stimulates rat TM4 cell proliferation through activating plasma membrane translocation and transcriptional activity of estrogen receptors[J].Biol Reprod,2015,92(1):24.
[8]LANIER M H,MCCONNELL P,COOPER J A.Cell migration and invadopodia formation require a membrane-binding domain of CARMIL2[J].J Biol Chem,2016,291(3):1076-1091.
[9]朱丹,项世龙,薛智敏,等.细丝蛋白A在细胞黏附和迁移中的作用[J].中国细胞生物学学报,2014,36(8):1142-1152.
[10]SURANENI P,RUBINSTEIN B,UNRUH J R,et al.The Arp2/3 complex is required for lamellipodia extension and directional fibroblast cell migration[J].J Cell Biol,2012,197(2):239-251.
[11]温稳,张保平,白仲添,等.杨氏模量及细胞骨架重塑对肝癌细胞侵袭的影响[J].中华消化杂志,2015,35(6):371-376.
[12]KIM M O,RYU J M,SUH H N,et al.cAMP promotes cell migration through cell junctional complex dynamics and actin cytoskeleton remodeling:implications in skin wound healing[J].Stem Cells Dev,2015,24(21):2513-2524.
[13]梁红霞,李依芃,时书勤,等.血管介导下的神经细胞迁移[J].河南大学学报(医学版),2015,34(4):285-289.
[14]刘玉洁,黎小妍.Nesprin-1通过组织细胞骨架结构调控细胞迁移[J].中国处方药,2014,12(10):1-3.
[15]CHEN S Y,LIN J S,YANG B C.Modulation of tumor cell stiffness and migration by type Ⅳ collagen through direct activation of integrin signaling pathway[J].Arch Biochem Biophys,2014,555(8):1-8.
