兰州百合褐腐病罹病根和根盘及鳞片分出的真菌和卵菌
2018-02-02何苏琴于安芬荆卓琼李瑞琴柳利龙
白 滨 ,何苏琴 ,于安芬 ,荆卓琼 ,李瑞琴 ,徐 瑞 ,柳利龙
(1.甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;2.甘肃省农业科学院农业质量标准与检测技术研究所,甘肃 兰州 730070;3.农业部农产品质量安全风险评估实验室(兰州),甘肃兰州 730070;4.甘肃省农业科学院植物保护研究所,甘肃 兰州 730070;5.农业部天水作物有害生物科学观测实验站,甘肃 天水 741200)
兰州百合[Lilium davidii var.willmottiae(E.H.Wilson)Raffill]是川百合的一个变种[1],具有食用、药用、保健和观赏价值。兰州百合不仅是中国百合中的上品,而且是中国唯一的甜百合,享有“兰州百合甲天下”的美誉。兰州栽培百合的历史已有400多年,作为兰州市最具特色的农产品之一,历经数百年的发展,兰州百合已经成为产区农民摆脱贫困、增加收入的支柱产业[2-5]。目前,兰州百合种植面积在6 667 hm2以上,年产量3 000 万~4 000 万 kg[6]。
兰州百合的种植区域集中且生产周期较长(从母籽培育到形成商品百合一般需要5~6 a),轮作倒茬困难,随着种植面积的扩大和种植年限的延长,百合根和鳞茎褐腐病日趋严重,严重影响了兰州百合的产量和质量。由于受侵染部位不同,可产生根腐、根盘腐烂和鳞片腐烂等多种症状:鳞片上单个病斑圆形、黄褐色至黑褐色,稍隆起至明显凹陷,一些病斑在鳞片上形成穿孔,病斑直径1~5mm,可相连成片,严重时外面的1~2层鳞片完全变黑腐烂;根盘受害呈黄褐色至黑褐色;病根呈污黄、黄褐或黑褐色(见封三图1)。
由于百合种类、种植区域、栽培方式及生态条件的不同,百合根和鳞茎褐腐(斑)病的病原种类也存在较大差异。在北美和加拿大,Colletotrichum dematium、Fusarium oxysporum f.sp.lilii和Cylindrocarpon radicicola是引起百合鳞茎腐烂的主要病原[7-9];在荷兰,Bollen[10]于 1971—1975年对采自23块百合田块的病害标样进行了分离,Cylindrocarpon sp.的分离频率在50.3%~51.0%,Fusarium oxysporum的分离频率在35.1%~38.7%,Penicillium corymbiferum的分离频率在4.3%~19.7%,Sistotrema sp.的分离频率在6.6%~18.4%,且Penicillium corymbiferum和Sistotrema sp.在地下茎和鳞片上的分离频率明显不同;在西班牙,Fusarium oxysporum f.sp.lilii和Fusarium proliferatum可引起百合叶片黄化和落叶,根和鳞茎产生坏死斑,甚至植株矮化和死亡[11];在以色列,引起百合根腐和鳞茎腐烂的病原包括Rhizoctonia AG-A,Rhizoctonia solani, Pythium oligandrum, Fusarium proliferatum和F.oxysporum[12]。我国报道的可引起百合生长期根和鳞茎腐烂的病原菌有Botrytis elliptica, Colletotrichum liliacearum, Fusarium moniliform,Fusarium oxysporum,Fusarium solani,Fusarium tricinctum,Penicillium cyclopium,Phytophthora parasitica, Pythium sp., Rhizoctonia solani,Sclerotium rolfsii等[13-22]。
为了探明兰州百合褐腐病相关真菌和卵菌种类,给病害科学防治提供技术支撑,我们于2013年秋季在兰州百合主产区采集标样,对兰州百合褐腐病罹病根、根盘和鳞片组织进行了组织分离,对分出真菌和卵菌的优势种群进行了分析,并对部分菌株的致病性进行了测定,现报道如下。
1 材料与方法
1.1 标样采集
于2013年9月在兰州百合主产区的5个样点采集罹病百合标样。标样标记后置于保鲜袋中,带回实验室后立即摊晾开,在48 h之内对标样进行组织分离。标样采集明细见表1。
1.2 培养基
培养基为马铃薯葡萄糖琼脂培养基(PDA),配方为马铃薯200 g、葡萄糖20 g、琼脂12 g,水1 000mL,pH自然。
1.3 真菌和卵菌的分离、纯化及保藏
采用常规的真菌组织分离法进行分离[23]。将罹病鳞片和根盘组织剪成0.5cm×0.5cm的小块,根剪成长1cm左右的小段,用70%乙醇表面消毒5~10 s,再用灭菌水冲洗4~5次,置PDA平板上,20~22℃黑暗培养,长出的真菌及时纯化保藏。
1.4 真菌和卵菌的鉴定
采用传统的形态分类鉴定方法,依据分出真菌和卵菌的培养特征和显微形态特征,鉴定到属。分类鉴定参考的主要文献包括《真菌鉴定手册》[24],Illustrated genera of imperfect fungi[25],Delimitation ofNeonectria and Cylindrocarpon (Nectriaceae,Hypocreales, Ascomycota) and related genera with Cylindrocarpon-like anamorphs等[26]。
1.5 分离结果统计
以分出率衡量罹病组织中真菌和卵菌的丰富程度及每个组织块受多重侵染的发生频率。分出率(isolation rate)为分离到的某一类型真菌和卵菌的菌株数占分离样品组织块总数的百分率,以分离频率比较判断优势菌群。分离频率(isolation frequency)为分离到的某一类型真菌和卵菌的菌株数占分离总的真菌和卵菌菌株数的百分率[27]。

表1 罹病百合标样采集明细
1.6 部分菌株的致病性测定
在分出真菌的3个优势菌群中,选择代表性的9个菌株为测试菌株。待测丝核菌属(Rhizoctonia)菌株在PDA平板上20℃黑暗培养3 d,在菌落边缘取直径5mm菌丝块,接种于健康的兰州百合鳞片和小鳞茎上,每菌株接种10枚百合鳞片和6枚小鳞茎,每枚鳞片接种1块菌丝块,在每枚小鳞茎的根盘和根部接种2~3块菌丝块,以不接菌的兰州百合鳞片和小鳞茎为对照,放置在直径20cm的培养皿内、室温(20℃)下保湿培养。土赤壳属(Ilyonectria)和镰刀菌属(Fusarium)待测菌株在PDA平板上20℃黑暗培养7~10 d,在菌落边缘取直径5mm的菌丝块,接种于健康的兰州百合鳞片上,每菌株接种10枚百合鳞片,每枚鳞片接种1块菌丝块,以不接菌的兰州百合鳞片为对照,置直径20cm培养皿内、室温(20℃)下保湿培养。小鳞茎接种后7 d、鳞片接种后35 d统计发病率,对发病的百合组织进行病原菌重分离。
2 结果与分析
2.1 分出真菌和卵菌的组成
从表2可以看出,从5个样点采集的罹病百合标样中共分离得到真菌和卵菌574株,鉴定后归于6个属,少数不产孢真菌或疑难菌暂归为其他。在属的水平上,以土赤壳属(Ilyonectria)、镰刀菌属(Fusarium)和丝核菌属(Rhizoctonia)为优势菌群,分别占总菌株数的46.86%、32.23%、17.07%。病组织块的真菌和卵菌分出率为100.00%~134.78%,从1块病组织上分出1种以上菌类的现象普遍。
2.2 优势菌群在不同地块间的差异
从表3可以看出,3个优势菌群在不同地块的差异明显。不同地块间土赤壳属(Ilyonectria)的分离频率为18.92%~85.85%,分出率为19.44%~91.00%;镰刀菌属(Fusarium)的分离频率为1.75%~58.02%,分出率为1.83%~66.67%;丝核菌属(Rhizoctonia)的分离频率为2.83%~45.61%,分出率为3.00%~47.71%。3个优势菌群在不同地块分出真菌和卵菌中的占比差异与采样地块的土壤含水量间无线性关系。
2.3 优势菌群在不同分离部位的差异
从表4可以看出,3个优势菌群在罹病百合不同部位分出真菌和卵菌中的占比差异明显,土赤壳属(Ilyonectria)在鳞片和根上的分出率和分离频率较高,镰刀菌属(Fusarium)在根盘上的分出率和分离频率最高,而丝核菌属(Rhizoctonia)的在根盘和根上的分出率和分离频率明显高于鳞片。
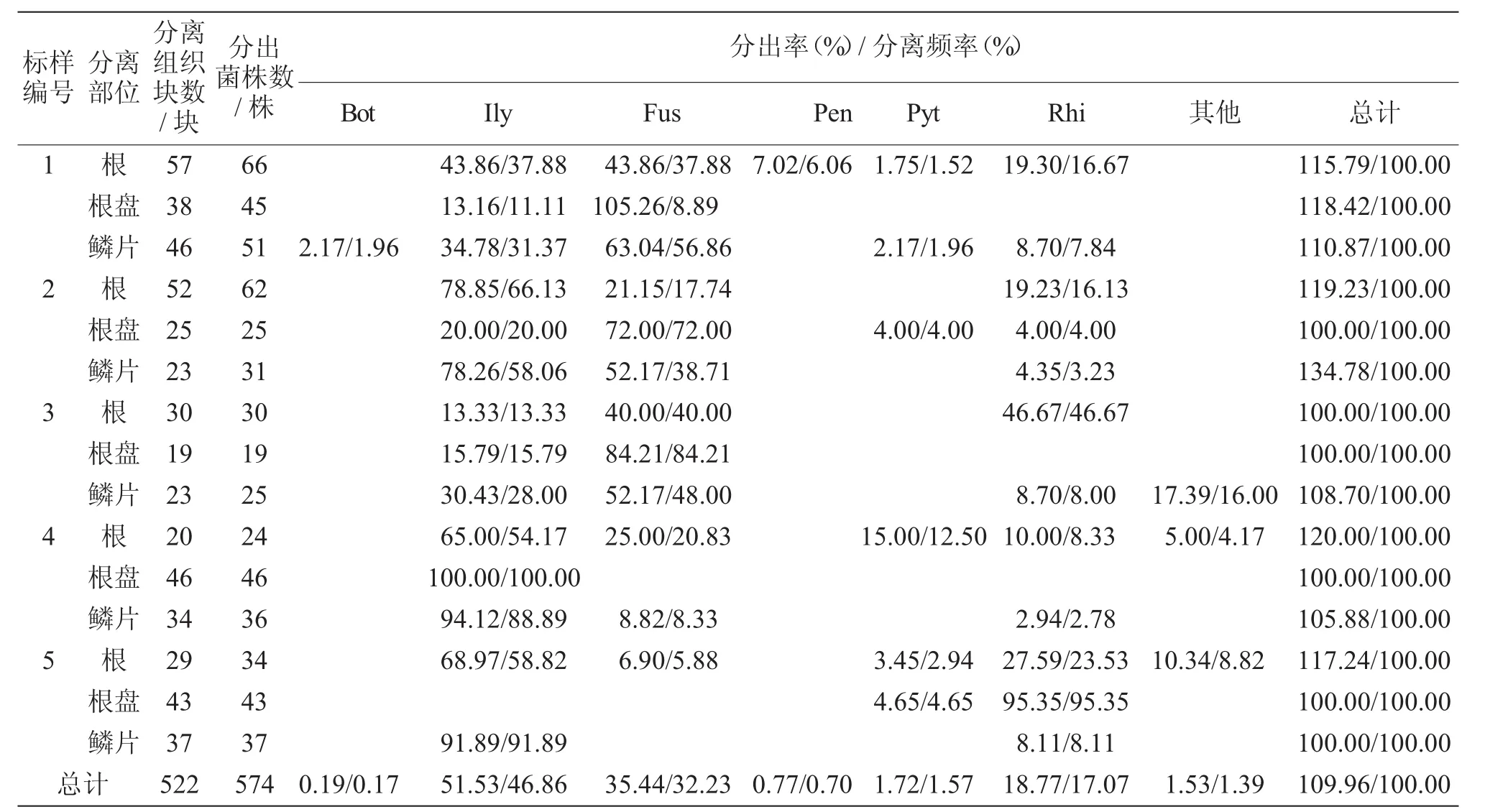
表2 百合褐腐病分出真菌和卵菌的类群组成①Bot、Ily、Fus、Pen、Pyt、Rhi分别为Botrytis、Ilyonectria、Fusarium、Penicillium、Pythium、Rhizoctonia的缩写,下同。
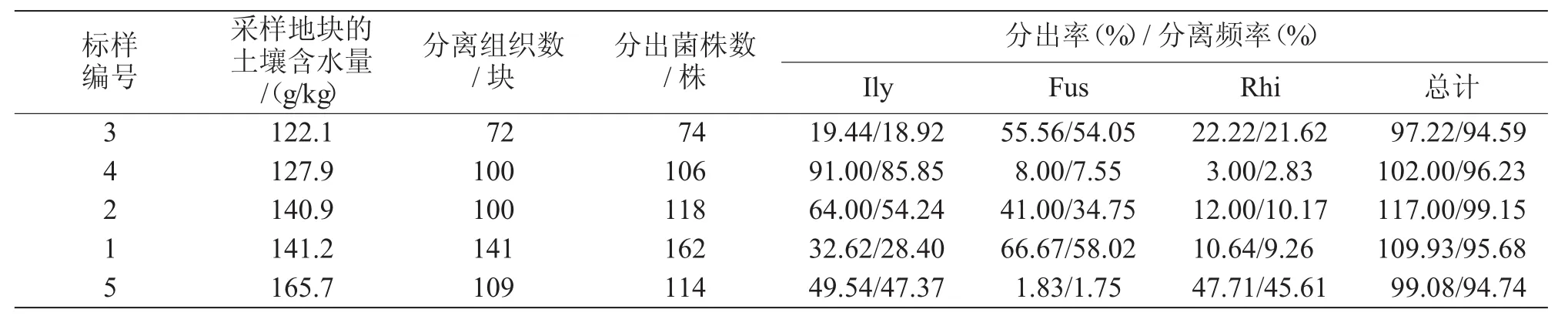
表3 不同地块百合褐腐病分出真菌和卵菌优势菌群的差异
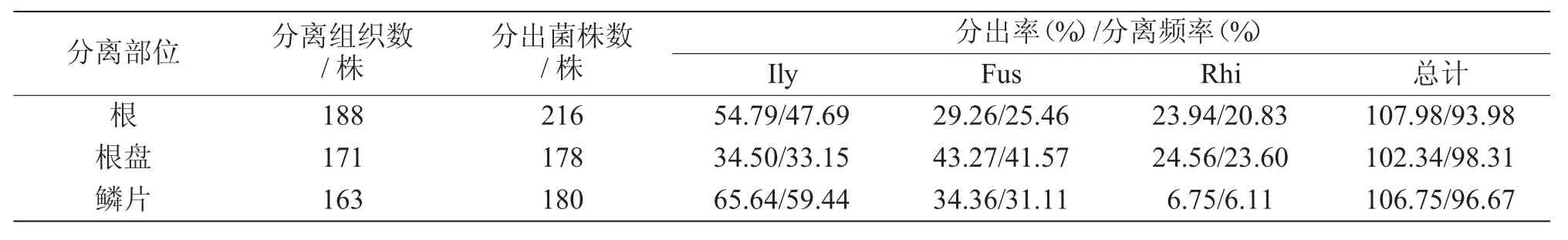
表4 百合褐腐病不同部位分出真菌和卵菌优势菌群的差异
2.4 试验菌株对兰州百合的致病性
测试的9个菌株中有7个菌株对兰州百合具有致病性。对发病的百合组织进行病原菌的重分离,原接种菌的分出率达100%(见表5、封三图2)。

表5 试验菌株对兰州百合的致病性
3 小结与讨论
百合属植物大约有115种,主要分布于北半球的温带和高山地区,特别是东亚地区,我国有55种[1]。关于兰州百合的学名,除Lilium davidii var.willmottiae(E.H.Wilson)Raffill外[1],使用较多的还有 Lilium davidii var.unicolor Cotton[25],Lilium davidii var.unicolor Salisb 等[29-30],这些名称间的关系如何,期待相关的植物分类学工作者进行梳理和规范使用。
本研究中,土赤壳属[Ilyonectria(Cylindrocarpon-like anamorphs)]、镰刀菌属(Fusarium)和丝核菌属(Rhizoctonia)3类菌的分出频率分别为46.86%、32.23%和17.07%,总的分出频率达96.17%,与李诚[14]1990—1993年对采自兰州市和平凉市的兰州百合的分离结果(Fusarium oxysporum,Fusarium solani和Fusarium moniliform 3种镰刀菌总的分离比率达84%)相比较,差异较大;与 Bollen[10]1971—1975 年对采自荷兰的 23 块百合田块的病害标样的分离结果(Cylindrocarpon sp.的分离频率达50.3%~51.0%)有部分相似。
土赤壳属(Ilyonectria)大多数种类为植物病原菌,可引起植物根腐病和黑腐病等[31],其无性型柱孢属(Cylindrocarpon Wollenw.)真菌是人参、西洋参和三七等药用植物根腐(锈腐)病的主要病原菌[32-36]。
本研究中,土赤壳属[Ilyonectria(Cylindrocarpon-like anamorphs)]的3个菌株、镰刀菌属(Fusarium)的2个菌株和丝核菌属(Rhizoctonia)的2个菌株对兰州百合的致病性得到确认,但由于不同种类病菌的致病条件存在差异,在同一条件下对试验菌株致病性的测定结果并不能完全反映其致病力强弱。分出真菌和卵菌的种的鉴定,在不同温湿度条件下和对寄主不同组织部位的致病性,以及非致病种类与致病菌的关系等,都有待于进一步开展细致的研究工作。
[1]LIANG S J,TAMURA MN,LILIUM LINNAEUS.Flora of China[EB/OL].(2000-12-20)[2016-09-09].http://flora.huh.harvard.edu/china/PDF/PDF24/lilium.pdf.
[2]周清泉.兰州百合产业发展现状及对策[J].甘肃农业科技,2016(1):64-66.
[3]周清泉.二阴地区兰州百合无公害栽培关键技术[J].甘肃农业科技,2016(4):74-75.
[4]石有太,林育红,崔文娟.兰州百合高效配方施肥技术[J]. 甘肃农业科技,2013(7):61-62.
[5]兰州百合基础知识[J].甘肃农业,2015(11):25-26.
[6]佘佳蔓.兰州百合产业现状与发展新思路[J].园艺与种苗,2012(5):42-45.
[7]SMITH J D,MAGINNES E A.Scale rot test for hybrid lilies[J].Canadian Plant Disease Survey, 1966, 46(3):92-94.
[8]SMITH J D,MAGINNES E A.Scale rot test of hardy hybrid lilies[J].Canadian Plant Disease Survey,1969,49(2):43-45.
[9]BALD J G,LENZ J V,PAULUS A O,et al.Multicomponent preplanting dips for easter lily bulbs[J].Plant Disease,1982,66(5):399-401.
[10]BOLLEN G J.Pathoganicity of fungi isolated from stems and bulbs of lilies and their sensitivity to benomyl[J].Netherlands Journal of Plant Pathology,1977,83:317-329.
[11]PRADOS-LIGERO A M,BASALLOTE-UREBA M J,MELERO-VARA J M.First report of Fusarium oxysporum f.sp lilii and F.proliferatum affecting Lilium crops in Spain[J].Tropical Plant Pathology,2008,33(3):235-236.
[12]LEBIUSH-MORDECHAIL S,ERLICHL O,MAYMON M,et al.Bulb and root rot in lily(Lilium longiflorum)and onion(Allium cepa)in Israel[J].Journal of Phytopathology,2014,162: 466-471.
[13]王拱辰,寿绍贤,鲍建荣.百合鳞茎斑点病病原菌鉴定[J]. 植物病理学报,1994,24(3):212-217.
[14]李 诚.百合鳞茎带菌及种球消毒试验[J].植物保护,1994,20(4):24-25.
[15]唐祥宁,游春平,刘福秀,等.江西百合病害调查与鉴定[J]. 江西农业学报,1997,9(4):1-8.
[16]梁巧兰,徐秉良,刘艳梅.观赏百合根腐病病原鉴定及药剂筛选[J].甘肃农业大学学报,2004,39(1):25-28.
[17]冯翠萍,李艳琼,纳玲洁,等.玉溪市百合病害种类的调查与鉴定[J]. 福建林业科技,2007,34(1):126-127.
[18]毛军需,李 有.豫西百合病害种类的调查与分析[J]. 华中农业大学学报, 2007,26(3):302-305.
[19]安智慧,石延霞,刘永春,等.百合根腐病病原鉴定及防治方法[J].中国蔬菜, 2010(3):23-24.
[20]朱海燕,夏 花,高必达.湖南省食用百合生长期鳞茎腐烂病的病原鉴定[J].植物病理学报,2012,42(5):525-527.
[21]LI Y Y,WANG Y J,XIE Z K,et al.First report of lily blight and wilt Caused by Fusarium tricinctum in China[J].Plant Disease,2013,97(7):993.
[22]SHANG Q H,ZHAO X,LI Y Y,et al.First report of Fusarium tricinctum causing stem and root rot on Lanzhou lily(Lilium davidii var.unicolor)in China[J].Plant Disease,2014,98(7):999.
[23]方中达.植病研究方法[M].4版.北京:中国农业出版社,1998:122-126.
[24]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:1-780.
[25]BARNETT H L,HUNTER B B.Illustrated genera of imperfect fungi(4th edition)[M].Minnesota: APS Press,1998:1-218.
[26]CHAVERRI P,SALGADO C,HIROOKA Y,et al.Delimitation of Neonectria and Cylindrocarpon(Nectriaceae, Hypocreales, Ascomycota) and related genera with Cylindrocarpon-like anamorphs[J].Studies in Mycology,2011,68:57-78.
[27]杜少康,陈双林,林 岱,等.银杏叶部内生真菌多样性的研究[J]. 菌物学报,2009,28(4):504-511.
[28]黄彦玮,师桂英,李谋强,等.外源GA3、ABA对低温冷藏兰州百合种球萌发的促抑效应及种球碳水化合物变化研究[J].甘肃农业大学学报,2016,51(1):55-61.
[29]马君义,赵小亮,张 继,等.兰州百合的研究进展[J]. 塔里木农垦大学学报,2005,17(4):53-56;76.
[30]李玉帆,明 军,刘新艳,等.15个百合种和品种的食用性比较研究[J].园艺学报,2013,40(增刊):2693.
[31]王玉君,张丽春,郭顺星.土赤壳属三个中国新记录种[J]. 菌物学报,2015,34(6):1209-1214.
[32]张天宇,李恭民,陈伟群,等.西洋参锈腐病病原研究[J]. 西北农业大学学报,1991,19(1):43-48.
[33]严雪瑞,傅俊范.柱孢属(Cylindrocarpon)真菌和参类锈腐病的研究历史与现状[J].沈阳农业大学学报,2002,33(1):71-75.
[34]缪作清,李世东,刘杏忠,等.三七根腐病病原研究[J]. 中国农业科学,2006,39(7):1371-1378.
[35]王 琴,金若忠,云丽丽,等.人参锈腐病发生情况和病原研究[J].辽宁林业科技,2014(3):15-17.
[36]龙月娟,毛忠顺,朱书生,等.三七锈斑病的病原菌[J]. 菌物学报,2015,34(2):177-185.
