绵羊CD9基因g.208082881C>A位点多态性与产羔数的关联分析
2018-02-02汤继顺刘秋月王翔宇胡文萍储明星中国农业科学院北京畜牧兽医研究所农业部动物遗传育种与繁殖重点实验室北京0093安徽省农业科学院畜牧兽医研究所合肥23003
汤继顺 ,狄 冉 ,刘秋月 ,王翔宇 ,胡文萍 ,储明星 (.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 0093;2.安徽省农业科学院畜牧兽医研究所,合肥 23003)
产羔数是影响绵羊生产效率的主要因素之一,但产羔数是一个低遗传力的性状,不仅受遗传基因的控制,还受性别和年龄等的制约,难以用常规的育种技术来选择。Gabina[1]报道,将繁殖性状合并为一个选择指数,根据母绵羊各自的生产性能对母羊进行选择时,产羔数是其中最重要的一个性状,其对遗传进展的经济效益贡献为74%~96%,找到与产羔数相关的主效基因或有效分子遗传标记是现代绵羊分子育种的关键。影响产羔性能的因素很多,主要有外界因素(饲料营养、配种方式和公羊效应等)和遗传因素等,其中遗传因素是内在因素,决定着排卵数的多少和受胎率的高低等,而受胎率也与精卵融合效率密切关联。精卵融合的过程涉及到精子和卵子细胞膜表面的一系列分子参与其中[2-4]。研究发现,精子表面存在精卵结合蛋白Izumo1[5-6],在哺乳动物卵子质膜上除了必需受体蛋白叶酸受体4(Juno)与Izumo1相互作用外,白细胞分化抗原簇9(cluster of differentiation antigen 9,CD9)在哺乳动物的精卵质膜融合过程中也起着关键作用[7-8]。CD9蛋白属于跨膜4超家族(transmembrane 4 superfamily,TM4SF)成员,是一种跨膜糖蛋白,大多分布在细胞膜,少数分布在细胞的板状伪足、丝状伪足和细胞囊泡中[9]。近年来发现,精卵融合效率对哺乳动物的受胎率有着重要影响,因此CD9等基因得到重视并逐渐展开了深入研究[10-12]。
全基因组重测序是目前动植物疾病、生产以及经济性状等功能基因挖掘最主要的方法之一[13-15]。对多个群体进行选择信号检测常用的方法是群体分化指数(Fst)法,Fst是检测群体间遗传分化的重要指标之一,通过对全基因组范围内的单个位点Fst(0<Fst<1,1表示该区域种群完全分化)估值就能对每个位点分析其分化程度,最终实现选择信号检测[16]。因此,针对产羔数性状不同的绵羊品种(多羔和单羔),利用本课题组前期重测序结果并使用Fst方法对多羔组和单羔组分化程度进行分析并鉴定选择信号,从而筛选出与绵羊产羔数相关的候选基因CD9基因g.208082881C>A位点。
本研究以繁殖力存在差异的绵羊品种为试验对象,结合多重PCR技术、Mass ARRAY IPLEX单碱基延伸技术和基质辅助激光解吸附电离飞行时间质谱分析质谱技术(matrix-assisted laser desorption/ionization-time of flight,MALDI-TOF)进行分型检测[17-18],快速检测绵羊CD9基因g.208082881C>A位点多态性并分析其与产羔数性状的关系,以期为绵羊高繁殖力性状的标记辅助早期选择提供参考依据。
1 材料与方法
1.1 材料
血液样品来源:小尾寒羊、苏尼特羊、滩羊、草原藏羊、萨福克羊和杜泊羊6个绵羊品种,总共760只,其中小尾寒羊为多羔品种,其他都是单羔品种。各试验绵羊群体均健康状况良好,饲养条件相对一致,同时记录小尾寒羊头3胎产羔记录。每只绵羊颈静脉采血10 mL,采用柠檬酸葡萄糖抗凝,-20℃保存。其中小尾寒羊血液样本380份采自山东省郓城县,苏尼特羊血液样本100份采自天津市畜牧兽医研究所种羊场,滩羊血液样本80份采自宁夏盐池县,草原藏羊血液样本131份采自西藏当雄县,萨福克羊血液样本39份和杜泊羊血液样品30份均采自北京市顺义区北京奥鑫牧业有限公司。
1.2 主要仪器与试剂
基因分型鉴定委托北京君诺德生物技术有限公司完成。主要仪器和试剂:基因扩增为ABI GeneAmp9700 384 Dual,质谱点样为MassARRA-Y Nanodispenser RS 1000,质谱分析为MassARRAY Compact System,试剂为Complete Genotyping Reagent Kit for Mass ARRAYCompact 384。
1.3 方法
1.3.1 DNA提取和纯度质控 DNA提取根据天根生化科技(北京)有限公司血液基因组EasyPureTMBlood Genomic DNA Kit试剂盒说明步骤进行,提取的DNA样品浓度采用微量紫外分光光度计检测(Nano Drop2000)DNA OD值,并通过1.5%琼脂糖凝胶电泳对DNA质量进行检测。分型样品选择:6个绵羊品种DNA,每个样品需要量 20 μL,DNA 最终浓度 10~30 ng/μL。
1.3.2 引物设计及引物质控 根据SNP位点序列信息,采用Sequenom公司的引物设计软件Assay design 3.1设计PCR反应和单碱基扩增引物并合成(见表1)。通过MALDI-TOF进行质检,将引物稀释到质谱反应所需浓度。具体操作:吸取2 μL延伸引物加到40 μL ddH2O中,进行质谱检测。配置PCR引物储备液,终浓度100 μmol/L;配置单碱基引物储备液,终浓度500 μmol/L。

表1 PCR反应和单碱基扩增引物
1.3.3 PCR反应 5 μL的PCR反应体系中含有ddH2O 1.8 μL,10×PCR Buffer 0.5 μL,MgCl2(25 mM)0.4 μL,dNTP(25 mM)0.1 μL,Hotstar Taq(5 U/μL)0.2 μL,PCR Primer mix 1 μL,待检测 DNA 样品 1 μL。
PCR 扩增条件:95℃预变性 2 min;95℃变性 30 s,56℃退火 30 s,72℃延伸 1 min,共 45 个循环;最后 72℃延伸5 min,25℃保存。
1.3.4 PCR产物纯化 利用SAP酶去除PCR产物中剩余的dNTP,以保证单碱基延伸的准确性。
SAP酶消化反应:配制SAP酶Mix,2 μL反应体系中含有 ddH2O 1.53 μL,SAP Buffer 0.17 μL,SAP Enzyme 0.3 μL。在 PCR 仪中进行 SAP 酶消化:37℃ 40 min,85℃5 min,25℃保存。
1.3.5 单碱基延伸 配制Mix,2 μL反应体系中含有ddH2O0.619μL,iPLEXBuffer0.2μL,Terminatormix0.2μL,Extend primer mix 0.94 μL,iPLEX Enzyme 0.041 μL。
反应体系:94℃预变性 30 s;94℃ 5 s,52℃ 5 s,80℃5 s,40 个循环;52℃ 5 s,80℃ 5 s,5 个循环;最后 72℃延伸 3 min,25℃保存。
1.3.6 树脂纯化 将Clean Resin树脂平铺到6 mg的树脂板中,加16 μL ddH2O到延伸产物的对应孔内,将干燥后的树脂倒入延伸产物板中,封膜,低速(2 000 r/min)垂直旋转30 min,使树脂与反应物充分接触,离心使树脂沉入孔底部。将脱盐处理后的样品点在样品靶上,自然结晶。
1.4 基因分型
样品树脂纯化后,启动Mass ARRAY Nano dispenser RS1000点样仪,将树脂纯化后的延伸产物移至384孔SpectroCHIP(Sequenom)芯片上,并用基质辅助激光解析电离飞行时间质谱进行分析,检测结果用TYPER 4.0软件完成分型,并输出结果。
1.5 数据处理
使用Microsoft Excel 2016软件统计绵羊CD9基因g.208082881C>A位点的基因型频率、等位基因频率、多态信息含量(polymorphism information content,PIC)、杂合度(heterozygosity,He)和有效等位基因数(effective number of allele,Ne),并进行 Hardy-Weinberg 平衡检测。使用SPSS 22.0软件程序中一般线性模型中单因素方差分析的最小显著差异(least significant difference,LSD)法对小尾寒羊基因型与产羔表型数据进行关联分析。
2 结果与分析
2.1 DNA提取纯度质控和引物质控
由图1A得知,采用浓度为1.5%琼脂糖凝胶,电泳电压5 v/cm,时间20 min,电泳检测胶发现,DNA条带单一、清晰、无杂质,没有弥散、拖尾现象。
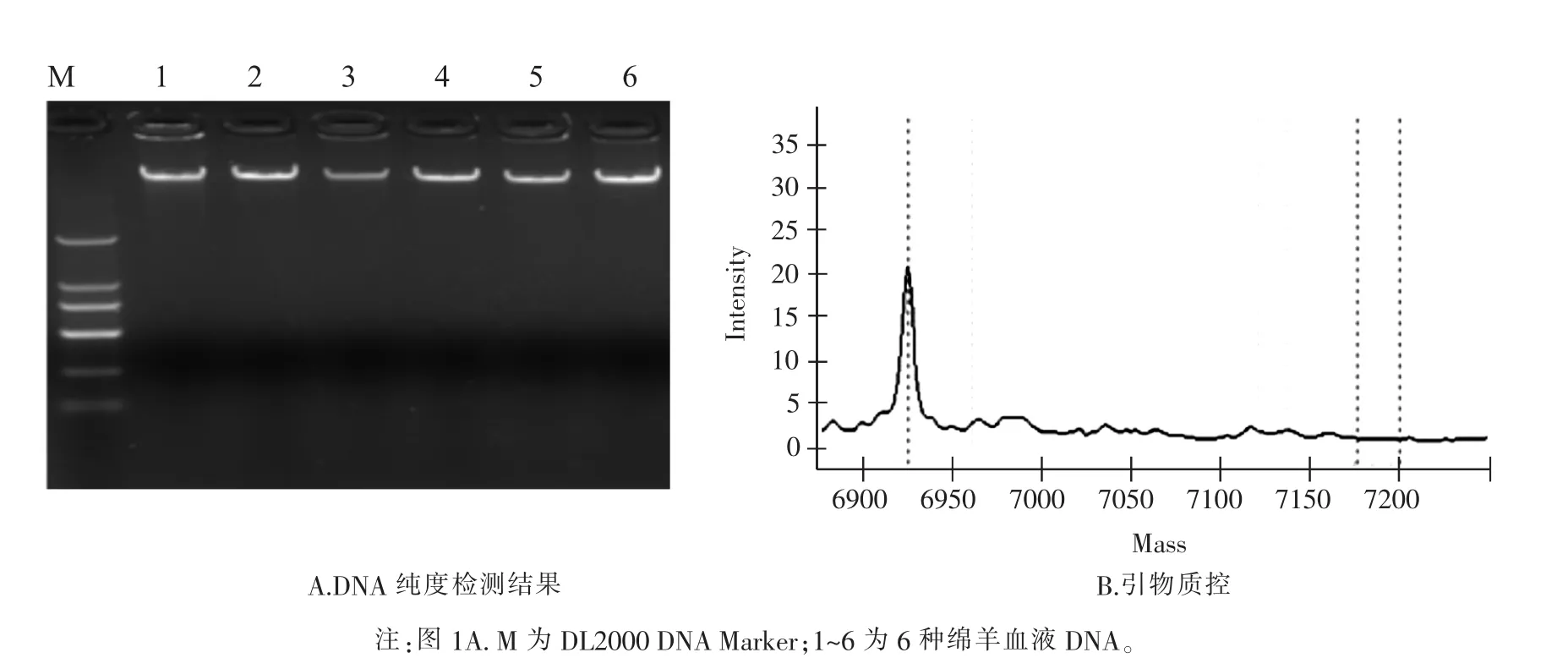
图1 DNA提取纯度检测和引物质控
由图1B得知,设计的延伸引物进行质谱检测后,所得峰图分子量与理论值一致,无杂峰。
2.2 CD9基因多态性分析
通过基因分型发现,CD9基因g.208082881C>A位点在单、多羔绵羊品种中均存在两种基因型,分别是AA和CA。具体信息见图2和表2。
由表2可知,绵羊CD9基因g.208082881C>A位点等位基因频率在单、多羔绵羊品种间差异达到极显著水平(P<0.01),且无论在单羔还是多羔品种中,A基因均是优势等位基因。
2.3 CD9基因g.208082881C>A位点在不同绵羊品种中的群体遗传学分析
由表3可知,绵羊CD9基因g.208082881C>A位点在小尾寒羊、苏尼特羊、滩羊、草原藏羊、萨福克羊绵羊品种中均为中度多态(0.25<PIC<0.5),在杜泊羊中表现为低度多态(PIC<0.25)。卡方适合性检验结果表明,CD9基因g.208082881C>A位点在杜泊羊群体中处于Hardy-Weinberg平衡状态(P >0.05),而在其余绵羊品种中均处于Hardy-Weinberg不平衡状态(P<0.05)。
2.4 CD9基因g.208082881C>A位点与小尾寒羊产羔数的关系
由表4可知,CD9基因g.208082881C>A位点2种基因型与小尾寒羊头3胎产羔数之间并无显著关联(P>0.05),但从第2胎和第3胎产羔数分析,AA型产羔数高于CA型。

图2 CD9基因g.208082881C>A位点分型结果

表2 CD9基因g.208082881C>A位点在单羔、多羔绵羊品种中的基因型频率和等位基因频率
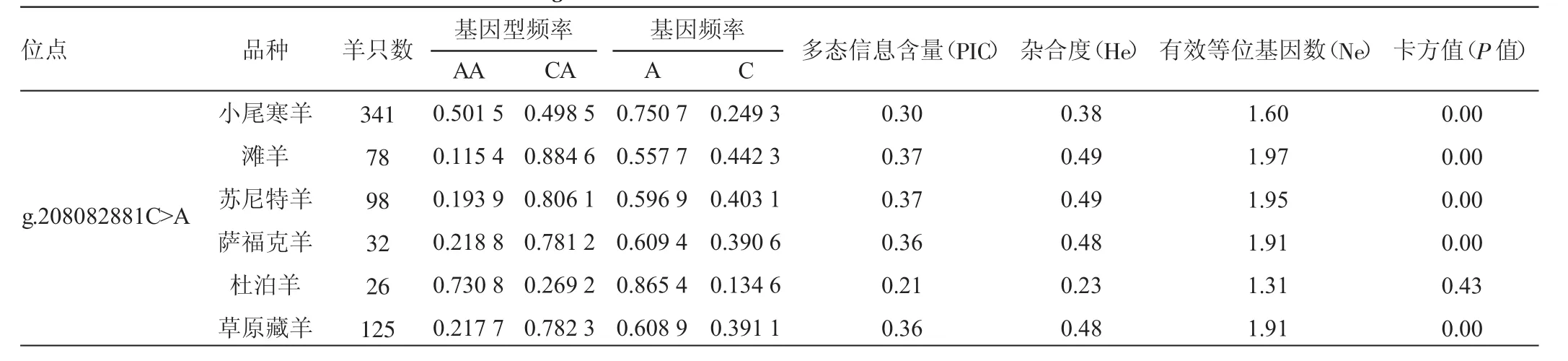
表3 CD9基因g.208082881C>A位点在不同绵羊品种中的群体遗传学分析

表4 CD9基因g.208082881C>A位点2种基因型小尾寒羊产羔数
3 讨论
3.1 CD9基因功能及对哺乳动物精卵融合的影响
CD9是存在于包括卵母细胞等多种细胞的细胞膜中的一种糖蛋白,相对分子质量为24 kD,编码226个氨基酸的肽链,含典型TM4SF蛋白特征序列——CCG基序[19-20]。绵羊的CD9基因定位于第3号染色体上,包含7个外显子。在哺乳动物精卵融合过程中CD9直接参与精子和卵子的膜融合过程,并在其中起到关键性的作用[9,21-22]。Bianchi等[23]利用小鼠研究发现,CD9可能调控Juno结构,从而能促进Juno与Izumo1结合。此外,CD9还参与细胞支持、黏附、运动、增殖以及肿瘤细胞的转移等[24-26]。
CD9基因在造血细胞、骨髓细胞、脑细胞、肌肉细胞、生殖器官和卵母细胞表面都有分布,并可与多种分子等形成蛋白质复合体参与功能表达[27-28]。周思畅等[25]研究发现,小鼠未成熟的卵母细胞膜上有强的CD9基因表达,在完全成熟的卵母细胞膜上CD9基因表达最强。随着绵羊卵泡的形成,在初级卵泡期就能检测到CD9荧光信号,成熟的卵母细胞CD9mRNA表达量显著增加[11]。此外,Li等[29]研究表明,猪卵母细胞成熟期CD9显著增多,从而提示其与卵细胞受精能力有关。
目前,哺乳动物CD9的研究热点主要集中在受精过程中胞外受体识别、胞内信号传导通路以及与其他细胞因子的关系等方面。体外实验证实,CD9基因敲除(CD9-/-)实验进一步确认了CD9蛋白在精卵融合过程中的关键地位。2011年Fanaei等发现,雌性小鼠(CD9-/-)的卵子不能与精子融合而导致受精失败[30]。采用免疫共沉淀证明,CD9蛋白在卵质膜上与整合素α6β1形成物理联结,可引起整合素介导的膜脂筏(lipid raft)微域结构信号传导反应,如细胞内pH值、细胞质钙水平、磷脂代谢、氨基酸(酪氨酸、丝氨酸和苏氨酸)磷酸化的改变以及基因表达,从而促进精卵融合[31]。
3.2 CD9基因g.208082881C>A位点多态性与产羔数的关系
在群体遗传结构分析中多态信息含量(PIC)是衡量基因变异位点程度高低的指标。PIC>0.50表示该位点高度多态性;PIC在0.25~0.50之间为中度多态性;PIC<0.25为低度多态性[32]。有效等位基因数(Ne)反映等位基因之间的相互影响,Ne越接近等位基因的绝对数,表明人工选择压力就越大。杂合度(He)是反映某位点上遗传变异量大小的指标。若PIC高,有效等位基因数目Ne多,He大,表明该群体在该位点的遗传变异程度高[33]。
本研究选择的CD9基因g.208082881C>A位点通过群体遗传学分析发现,在小尾寒羊、苏尼特羊、滩羊、草原藏羊和萨福克羊绵羊品种中,PIC在0.25~0.50之间,为中度多态,表明该位点在这些绵羊群体中存在较强的选择潜力。在杜泊羊品种中处于低度多态(0.21),表明该位点在杜泊羊中的遗传多样性则相对贫乏。小尾寒羊、苏尼特羊、滩羊、萨福克羊和草原藏羊的He和Ne分别在0.38~0.49和1.60~1.95间,说明这几个绵羊品种遗传变异程度高。进一步分析发现,CD9基因g.208082881C>A位点在小尾寒羊、苏尼特羊、滩羊、草原藏羊和萨福克羊绵羊品种中均处于Hardy-Weinberg不平衡状态,可能是因为自然选择或人工选择对该位点分布影响较大,或与试验选择的羊品种数量较少有关。通过基因分型发现,该位点在单羔、多羔绵羊品种中都只存在AA和CA型。与产羔数关联分析结果显示,AA和CA型与小尾寒羊的头3胎的产羔数并无显著关联(P>0.05),但从第2胎开始AA型产羔数高于CA型,推测该位点突变在一定程度上提高了小尾寒羊的产羔能力。
4 结论
本研究表明,绵羊CD9基因g.208082881C>A位点在小尾寒羊、苏尼特羊、滩羊、草原藏羊和萨福克羊绵羊品种中存在较强的选择潜力。AA和CA型小尾寒羊头3胎产羔数并无显著差异(P>0.05),但从第2胎开始AA型产羔数高于CA型。
[1]Gabina D.Improvement of the reproductive performance of Rasa Aragonesa flocks in frequent lambing systems.I.Effects of management system,age of ewe and season[J].Livestock Production Science,1989,22(1):87-98.
[2]Rubinstein E,Ziyyat A,Wolf J P,et al.The molecular players of sperm-egg fusion in mammals[J].Seminars in Cell&Developmental Biology,2006,17(2):254-263.
[3]Klinovska K,Sebkova N,Dvorakovahortova K.Sperm-egg fusion:a molecular enigma of mammalian reproduction[J].International Journal of Molecular Sciences,2014,15(6):10652-10668.
[4]Jankovicˇová J,Simon M,Antalíková J,et al.Role of tetraspaninCD9molecule in fertilization of mammals[J].Physiological Research,2015,64(3):279-293.
[5]Satouh Y,Inoue N,Ikawa M,et al.Visualization of the moment of mouse sperm-egg fusion and dynamic localization of IZUMO1[J].Journal of Cell Science,2012,125(21):4985-4990.
[6]Ikawa M,Inoue N,Benham A M,et al.Fertilization:a sperm's journey to and interaction with the oocyte[J].Journal of Clinical Investigation,2010,120(4):984-995.
[7]Vicens A,Roldan E R.Coevolution of positively selected IZUMO1 andCD9in rodents:evidence of interaction between gamete fusion proteins?[J].Biology of Reproduction,2014,90(5):1-9.
[8]Hemler M E.Tetraspanin proteins promote multiple cancer stages[J].Nature Reviews Cancer,2014,14(1):49-60.
[9]王焕景,陈富美,濮黎萍,等.精卵融合过程中关键蛋白的研究进展[J].基因组学与应用生物学,2016,35(11):3028-3033.
[10]Antalikova J,Jankovicova J,Simon M,et al.Localization ofCD9molecule on bull spermatozoa:its involvement in the sperm-egg interaction[J].Reproduction in Domestic Animals,2015,50(3):423-430.
[11]乌丽雅苏,乌亚罕,史振丹,等.绵羊卵母细胞超低温冷冻对四跨膜蛋白CD9表达的影响 [J].中国畜牧兽医,2016,43(8):2104-2111.
[12]吴国权,权国波,吕春荣,等.猪卵母细胞在GV期与MⅡ期的冷冻保存效果比较研究[J].中国畜牧兽医,2017,44(3):807-812.
[13]Yano K,Yamamoto E,Aya K,et al.Genome-wide association study using whole-genome sequencing rapidly identifies new genes influencing agronomic traits in rice[J].Nature Genetics,2016,48(8):927-934.
[14]汪文强,赵生国,马利青,等.动物基因组学重测序的应用研究进展[J].畜牧兽医学报,2016,47(10):1947-1953.
[15]潘章源,贺小云,刘秋月,等.全基因组测序(WGS)在畜禽群体进化和功能基因挖掘中的应用[J].农业生物技术学报,2016,24(12):1945-1954.
[16]曾滔,赵福平,王光凯,等.基于群体分化指数FST的绵羊全基因组选择信号检测[J].畜牧兽医学报,2013,44(12):1891-1899.
[17]Johansen P,Andersen J D,Borsting C,et al.Evaluation of the iPLEXsample ID plus panel designed for the sequenom MassARRAYsystem.A SNP typing assay developed for human identification and sample tracking based on the SNP for ID pane[lJ].Forensic Science International Genetics,2013,7(5):482-487.
[18]Ortega M S,Denicol A C,Cole J B,et al.Use of single nucleotide polymorphisms in candidate genes associated with daughter pregnancy rate for prediction of genetic merit for reproduction in Holstein cows[J].Animal Genetics,2016,47(3):288-297.
[19]Xing W J,Wang L Q,Wu Q,et al.Molecular cloning and characterization ofCD9cDNA from sheep and cashmere goa[tJ].Reproduction in Domestic Animals,2010,45(3):383-392.
[20]Mazurov D,Barbashova L,Filatov A.Tetraspanin proteinCD9interacts with metalloprotease CD10 and enhances its release via exosomes[J].FEBS Journal,2013,280(5):1200-1213.
[21]Stein K K,Primakoff P,Myles D.Sperm-egg fusion:events at the plasma membrane [J].Journal of Cell Science,2004,117(26):6269-6274.
[22]Miyado K ,Kang W ,Yamatoya K ,et al.Exosomes versus microexosomes:shared components but distinct functions[J].Journal of Plant Research,2017,130:479-483.
[23]Bianchi E,Doe B,Goulding D,et al.Juno is the egg Izumo receptor and is essential for mammalian fertilisation [J].Nature,2014,508(7497):483-487.
[24]Bauerschlag D,Brautigam K,Moll R,et al.Systematic analysis and validation of differential gene expression in ovarian serous adenocarcinomas and normal ovary[J].Journal of Cancer Research and Clinical Oncology,2013,139(2):347-355.
[25]周思畅,倪崖,石其贤.四次跨膜蛋白CD9与精卵融合[J].国际生殖健康 /计划生育杂志,2005,24(1):13-15.
[26]Yu J,Lee C Y,Changou C A,et al.TheCD9,CD81,and CD151 EC2 domains bind to the classical RGD-binding site of integrin αvβ3[J].Biochemical Journal,2017,474(4):589-596.
[27]许媛媛,吴艳红,李秋艳,等.精卵膜融合过程中卵膜上的候选分子[J].中国细胞生物学学报,2006,28(1):33-36.
[28]Ha C T,Waterhouse R,Warren J,et al.N-glycosylation is required for binding of murine pregnancy-specific glycoproteins 17 and 19 to the receptorCD9[J].American Journal of Reproductive Immunology,2008,59(3):251-258.
[29]Li Y H,Hou Y,Ma W,et al.Localization ofCD9in pig oocytes and its effects on sperm-egg interaction [J].Reproduction,2004,127(2):151-157.
[30]Fanaei M,Monk P N,Partridge L J.The role of tetraspanins in fusion[J].Biochemical Society Transactions,2011,39(2):524-528.
[31]宋凯.人CD9基因真核表达载体的构建及蛋白表达检测[D].杨凌:西北农林科技大学,2006.
[32]Botstein D,White R L,Skolnick M,et al.Construction of a gene tic-linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,32(3):314-331.
[33]王斌,昝林森,余横伟,等.秦巴山区黄牛群体的微卫星DNA遗传多样性[J].农业生物技术学报,2016,24(2):233-244.
