基于UPLC—Q—TOF/MS技术的桑叶化学成分快速识别分析
2018-02-01刘金玲李文姣王韧李森张雨恬周晋贺福元
刘金玲+李文姣+王韧+李森+张雨恬+周晋+贺福元


摘要:目的 采用超高液相色谱-四级杆-飞行时间质谱(UPLC-Q-TOF/MS)方法对桑叶的化学成分进行快速分析。方法 采用ACQUITY UPLC- Q-TOF/MS联用仪,以乙腈-水(含0.1%甲酸)为流动相梯度洗脱,流速0.3 mL/min,电喷雾离子源负离子模式采集检测,以Masslynx4.1软件分析数据。结果 根据质谱所提供的保留时间、精确相对分子质量及二级质谱裂解碎片信息并结合文献进行分析,共鉴定和推测了桑叶中19种化学成分。结论 该方法可快速、灵敏、全面地分析桑叶的化学成分,为探讨桑叶的药效物质基础提供依据。
关键词:桑叶;超高液相色谱-四级杆-飞行时间质谱;化学成分;黄酮
DOI:10.3969/j.issn.1005-5304.2018.02.016
中图分类号:R284.1 文献标识码:A 文章编号:1005-5304(2018)02-0069-05
Fast Identification Analysis on Chemical Constituents in Mori Folium
by Using UPLC-Q-TOF/MS Method
LIU Jin-ling1,2, LI Wen-jiao1,2, WANG Ren1,2, LI Sen1,2, ZHANG Yu-tian1,2, ZHOU Jin1,2,3, HE Fu-yuan1,2,3
1. Pharmacy College, Hunan University of Chinese Medicine, Changsha 410208, China; 2. Laboratory of Supramolecular Mechanism and Mathematic-Physics Chracterization for Chinese Materia Medica, Changsha 410208, China; 3. Hunan Key Laboratory of Druggability and Preparation Modification for Traditional Chinese Medicine, Changsha 410208, China
Abstract: Obejective To conduct fast identification analysis on chemical constituents of Mori Folium UPLC-Q-TOF/MS method. Methods ACQUITY UPLC-Q-TOF/MS spectrometer was used, acetonitrile and water (containing 0.1% formic acid) as mobile phase with gradient elution. The flow rate was 0.3 mL/min, with ESI negative ion mode detection, data analysis with Masslynx4.1 software. Results According to the retention time provided by the mass spectrometry, the exact molecular weight and the secondary mass spectrometry were used to analyze the fragments by referring to literature, and 19 chemical constituents of Mori Folium were identified and deduced. Conclusion The method can analyze the chemical constituents of Mori Folium rapidly, sensitively and comprehensively, and provide the basis for the study of the pharmacological basis of Mori Folium.
Keywords: Mori Folium; UPLC-Q-TOF-MS; chemical constituents; flavonoids
桑葉为桑科植物桑Morus alba L.的干燥叶,分布于全国各地,性寒,味甘、苦,归肺、肝经,具有疏散风热、清肺润燥、清肝明目功效[1]。桑叶主要含有黄酮类化合物、绿原酸、甾体、三萜类化合物及微量挥发油等成分[2-4],且黄酮类化合物占桑叶干重的
1%~3%,是茎叶中黄酮含量较高的植物。目前已有芦丁、异槲皮苷、绿原酸等成分的研究,为了明确桑叶的药效活性物质基础和作用机制,有必要全面分析桑叶的化学成分。
近年来,超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)技术结合了超高液相的高分离度和高分辨率质谱的高准确、灵敏性,可快速提供各色谱峰的质谱碎片信息,且可提供化合物的精确分子质量信息,相对误差<5×10-6,以及二级特征裂解碎片离子信息。即使在缺乏对照品的情况下,也可通过分析质谱峰的质谱信息或对比文献数据实现复杂体系中化学成分的快速分析,在中药成分体系定性定量分析方面已成为重要的研究手段[5-9]。本试验采用UPLC-QTOF/MS技术对桑叶甲醇提取物进行全成分扫描与快速鉴定,根据其准分子离子峰以及二级碎片离子、文献数据等,鉴定桑叶中的化学成分,为全面有效地建立桑叶的质量标准及现代开发提供支撑。
1 仪器与试药
超高效液相色谱串联四级杆/飞行时间质谱(UHPLC-H-CLASS/XEVO G2-XS Qtof)联用仪(美国Waters公司),配有Masslynx4.1数据处理系统;ACQUITY UPLC BEHC18色谱柱(美国Waters公司);RE52系列旋转蒸发器(上海雅荣生物设备仪器有限公司);CP114型电子精密天平(奥豪斯仪器有限公司);DTD系列超声波清洗机(宁波新芝生物科技股份有限公司);H1850R离心机(湖南湘仪公司);PINE-TREE型超纯水制水机(北京湘顺源科技有限公司);移液器(上海大龙医疗设备有限公司)。endprint
绿原酸对照品(中国食品药品检定研究院,批号110753-201415),芦丁对照品(中国食品药品检定研究院,批号100080-201409),异槲皮苷对照品(中国食品药品检定研究院,批号111809-201403);乙腈、甲醇(色谱纯,美国Tedia公司),甲酸(色谱纯,美国Sigma-Aldrich公司),水为超纯水,其他试剂均为分析纯。桑叶,产于湖南长沙,经湖南中医药大学石继连副教授鉴定为桑科植物桑Morus alba L.的干燥叶,低温干燥粉碎后过40目筛备用。
2 方法与结果
2.1 对照品溶液的制备
分别精密称取绿原酸8.0 mg、芦丁5.0 mg、异槲皮苷5.5 mg、紫云英苷5.0 mg,分别置于25 mL容量瓶中,用50%甲醇溶解并定容至刻,进样前稀释至1~100 ng/mL并过0.22 μm微孔滤膜,备用。
2.2 供试品溶液的制备
称取适量桑叶样品,低温干燥粉碎后过40目筛,精密称定样品粉末1 g,置具塞锥形瓶中,加50%甲醇90 mL,密塞,精密称定,超声提取(功率100 W,频率40 kHz)1 h,取出后放冷至室温,再次精密称定,加50%甲醇补足减失的质量,12 000 r/min高速离心15 min,取上清液,用0.22 ?m微孔滤膜过滤后作为供试品溶液。
2.3 液质联用条件
2.3.1 色谱条件
采用Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相A为0.1%甲酸水溶液、B为乙腈,梯度洗脱(0~5 min,10%~16%B;5~9 min,16%~24%B;9~14 min,24%~76%B;14~20 min,76%~100%B;20~25 min,100%~10%B);进样量1 μL;流速0.3 mL/min;柱温30 ℃。
2.3.2 质谱条件
电喷雾离子源(ESI),用负离子模式采集数据,使用高纯氮气作为雾化器和辅助气,氩气作为碰撞气,离子源温度为120 ℃,去溶剂化温度300 ℃,锥孔气流50 L/h,去溶剂化气流800 L/h,喷雾电压-4500 V,温度600 ℃,碰撞电压30 V,校正离子554.262 0 m/z,质量数扫描范围m/z 100~1200,数据采集时间25 min。
2.4 桑叶中化学成分确认
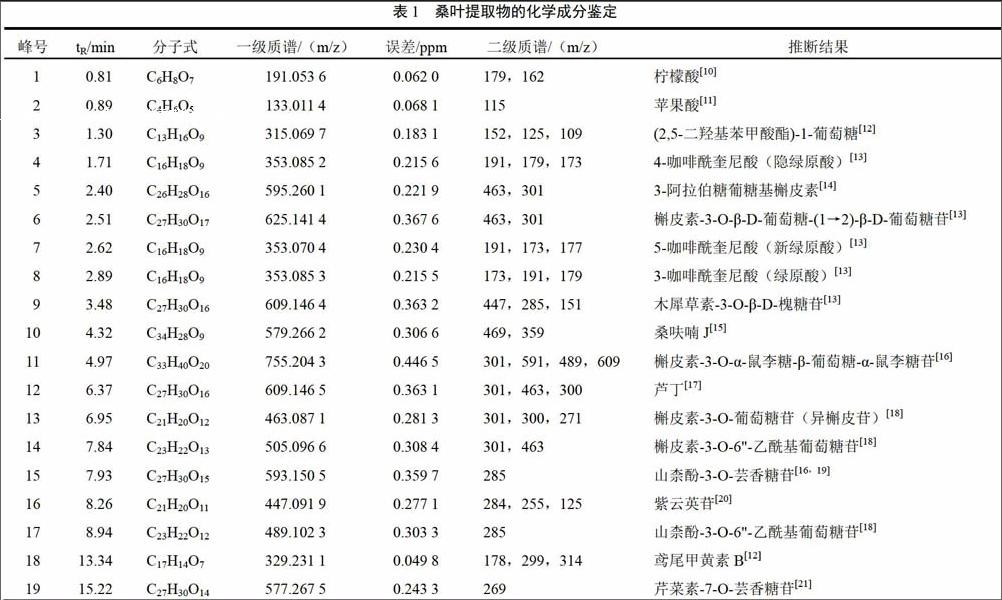
按“2.3”项下条件对50%甲醇提取桑叶药材成分进行定性分析,桑叶样品在ESI-模式下获得了良好的响应值,其(-)ESI-MS的质谱总离子流图(TIC)见图1。采用Masslynx4.1软件分析其中各化学成分的保留时间及其质谱信息,并结合其分子离子峰与对照品、文献报道的数据进行对比,再对其中的化学成分进行辨别,从而鉴定出桑叶提取物中19个化合物,鉴定结果见表1。
桑叶主要含黄酮类和咖啡酰奎尼酸类化合物,这2种物质在负离子模式下,其羟基更容易形成稳定的氧负离子,产生[M-H]-准分子离子峰信号。由于两类化合物分别具有相同的母核,在质谱中有相似的规律,故本文选择具有代表性的8号咖啡酰奎尼酸类和6、9、12、13、19号黄酮类化合物,详细分析其裂解过程。
2.4.1 咖啡酰奎尼酸类裂解规律
8号化合物:3-咖啡酰奎尼酸(绿原酸)为例,在质谱负离子模式條件下,保留时间2.62 min,一级质谱准分子离子峰为m/z 353.070 4,酰氧键断裂形成m/z 179.031 9的[M-qunic-H]-碎片离子及m/z 191.053 7的[M-caffeoyl-H]-碎片离子,两碎片离子分别进一步脱去一分子CO2和H2O,形成m/z 135.042 5及m/z 173.043 0的碎片离子,并结合对照品信息可推断该化合物。二级质谱裂解图见图2,裂解途径见图3。
2.4.2 黄酮苷类裂解规律
化合物6:在保留时间2.51 min,一级质谱准分子离子峰为m/z 625.141 4 [M-H]-,在负离子模式下该化合物分别出现了二级碎片离子m/z 463.087 0和m/z 301.031 8,由此推断该化合物有槲皮素母核为黄酮苷类成分。结合文献报道,准分子离子峰失去一分子半乳糖m/z 162.055 0和一分子葡萄糖m/z 162.054 2形成的,推测该化合物为槲皮素-3-O-β-D-葡萄糖-(1→2)- β-D-葡萄糖。
化合物9:在保留时间3.48 min,一级质谱准分子离子峰为m/z 609.146 4 [M-H]-,在负离子模式下该化合物分别出现了二级碎片离子m/z 447.091 3和m/z 285.037 5,同时C环发生RDA裂解,产生m/z 151.894 2的碎片离子,推测为准分子离子峰失去一分子鼠李糖m/z 162.055 1和一分子葡萄糖m/z 162.053 8形成的。综合质谱信息及文献报道,推测该化合物为木犀草素-3-O-β-D-槐糖苷。
化合物12:在保留时间6.37 min下,一级质谱准分子离子峰为m/z 609.146 5 [M-H]-,负离子模式下,m/z 609.146 5脱掉C环3位羟基上的一分子芸香糖m/z 308.111 3生成碎片离子m/z 301.035 2;脱去鼠李糖m/z 146.067 9生成m/z 463.078 6碎片离子,该离子继续脱去葡萄糖得到苷元碎片m/z 301.032 4和m/z 300.025 2。其中m/z 301.032 4的丰度明显小于m/z 300.025 2,说明C环3位糖苷键主要以均裂方式断裂。再对比对照品芦丁的保留时间及质谱信息,推断12号峰为芦丁。
化合物13:保留时间6.95 min,根据母离子m/z 463.087 1 [M-H]-,可得到化合物分子式为C21H20O12。该化合物的二级质谱图中出现了m/z 301.031 8的碎片离子,为脱去一分子中性葡萄糖的槲皮素苷元碎片的离子峰[(M-H)-162]-;m/z 271.021 3为槲皮素失去一分子CO后分子结构重排脱去2个H的碎片离子,由此推断该化合物可能有槲皮素母核。结合对照品信息,可推测该化合物为槲皮素-3-O-葡萄糖苷(异槲皮苷),其二级质谱裂解图见图4,裂解途径见图5。endprint
化合物16:保留时间8.26 min,根据母离子[M-H]- m/z 447.091 9,可推测化合物分子式为C21H20O11。该化合物的二级质谱图中出现了m/z 285.036 0的碎片离子,为脱去一分子葡萄糖的山奈酚苷元碎片的离子峰;m/z 255.026 9为苷元碎片失去一分子CO后分子结构重排脱去2个H生成,该碎片离子继续失去一分子CO生成m/z 227.031 8碎片离子,结合对照品信息,可推测该化合物为山柰酚-3-葡萄糖苷(紫云英苷)。
化合物19:保留时间15.22 min,其负离子模式下一级质谱准分子离子峰为m/z 577.267 5,计算其分子式可能为C27H30O14,其二级质谱产生了m/z 269.087 0的碎片离子,可推断为失去一分子芸香糖m/z 308.180 5的芹菜素苷元,结合文献信息可推断该化合物为芹菜素-7-O-芸香糖苷。
综上可知,黄酮苷类化合物主要由黄酮苷元及糖苷构成,主要裂解方式是产生脱去糖基的碎片离子,含有的糖基主要是鼠李糖、半乳糖、葡萄糖和芸香糖,以ESI负离子模式为例,其主要产生丢失该糖基的[M-H-146]-、[M-H-162]-、[M-H-162]-、[M-H-308]-。苷元结构黄酮母核C环脱去一分子CO(28 Da),或C环发生RDA再裂解,产生[M-101]-和[M-120]-碎片离子。根据该裂解方式及其各峰的质谱裂解信息,故可推断黄酮类化合物结构。
2.4.3 其他类裂解规律
化合物10:在保留时间4.32 min下,一级质谱准分子离子峰为m/z 579.300 9,负离子模式下,发生Mclafferty重排失去中性间苯二酚,得到m/z 469.778 4和m/z358.810 9。结合文献的相关信息,推断12号峰为Diels-Alder型加和物桑呋喃J,其二级质谱裂解图见图6,裂解途径见图7。
3 讨论
本研究采用UPLC-Q-TOF/MS结合Masslynx4.1软件数据处理方法,根据色谱峰的准分子离子峰,结合其二级质谱信息快速成功鉴别了桑叶甲醇提取物的19个化合物,包括3个咖啡酰奎尼酸类化合物、12个黄酮类化合物、4个有机酚酸(酯)类化合物,且有4个化合物得到了对照品验证。UPLC-Q-TOF/MS具有操作简单、准确、快速、无需对照品等特点,对于中药复杂体系中活效成分的初步定性研究及产物的分离具有重要意义。本试验可为桑叶的质量控制、原料产品开发提供保障,并为进一步桑叶药效物质基础的研究提供了化学依据。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:297.
[2] 李明聪,杨丹,郭英,等.桑叶中黄酮类化学成分及药理作用研究进展[J].辽宁中医杂志,2012,39(2):377-380.
[3] 刘利.桑叶化学成分研究[C]//中国蚕学会.全国桑树种质资源及育种和蚕桑综合利用学术研讨会论文集.广州:中国蚕学会,2005:695-698.
[4] 欧阳臻,陈钧.桑叶的化学成分及其药理作用研究進展[J].江苏大学学报:自然科学版,2003,24(6):39-44.
[5] LI S L, SONG J Z, QIAO C F, et al. A novel strategy to rapidly explore potential chemical markers for the discrimination between raw and processed Radix Rehmanniae by UHPLC-TOFMS with multivariate statistical analysis[J]. J Pharm Biomed Anal,2010, 51(4):812-823.
[6] AZNAR M, RODRIGUEZ-LAFUENTE A, ALFARO P, et al. UPLC-Q-TOF-MS analysis of non-volatile migrants from new active packaging materials[J]. Anal Bioanal Chem,2012,404(6/7):1945-1957.
[7] GAO L L, GUO T, XU X D, et al. Rapid identification and simultaneous analysis of multiple constituents from Rheum tanguticum Maxim. ex Balf. by UPLC/Q-TOF-MS[J]. Natural Product Research,2017:1-7.
[8] 秦振娴,张瑜,齐梦蝶,等.中国沙棘和西藏沙棘叶中化学成分的UPLC/Q-TOF-MS快速分析[J].中国中药杂志,2016,41(8):1461-1468.
[9] 尹权微,李家春,秦建平,等.UPLC/Q-TOF-MS快速分析桂枝茯苓胶囊的入血成分[J].中国实验方剂学杂志,2016,22(21):83-86.
[10] SHI Y, WU C, CHEN Y, et al. Comparative analysis of three Callicarpa herbs using high performance liquid chromatography with diode array detector and electrospray ionization-trap mass spectrometry method[J]. J Pharm Biomed Anal,2013,75:239-247.endprint
[11] 馬志国,杨中林,冯云鹏.大鼠口服松果菊苷粪便中代谢物的HPLC-MSn分析[J].中国天然药物,2008,6(5):387-390.
[12] S?NCHEZ-SALCEDO E M, TASSOTTI M, DEL R D, et al. (Poly)phenolic fingerprint and chemometric analysis of white (Morus alba L.) and black (Morus nigra L.) mulberry leaves by using a non-targeted UHPLC-MS approach[J]. Food Chem,2016,212:250-255.
[13] CLIFFORD M N, JOHNSTON K L, KNIGHT S, et al. Hierarchical scheme for LC-MSn identification of chlorogenic acids[J]. J Agric Food Chem,2003,51(10):2900-2911.
[14] 李伟,冯育林,黎田儿,等.UPLC-Q-TOF/MS 技术结合诊断离子方法快速分析连钱草中黄酮类化合物[J].质谱学报,2016,37(6):504-516.
[15] 张庆建.鸡桑、华桑化学成分及生物活性研究[D].北京:中国协和医科大学,2007.
[16] MENA P, S?NCHEZ-SALCEDO E M, TASSOTTI M, et al. Phytochemical evaluation of eight white (Morus alba L.) and black (Morus nigra L.) mulberry clones grown in Spain based on UHPLC-ESI-MSn, metabolomic profiles[J]. Food Research International,2016:1116-1122.
[17] 冯阳,陈玉梅,辛华.金樱子黄酮类成分的UPLC-Q-TOF-MS分析[J].中国实验方剂学杂志,2017,23(12):71-76.
[18] 李泮霖,李楚源,刘孟华,等.基于UFLC-Triple-Q-TOF-MS/MS技术的金银花、山银花化学成分比较[J].中南药学,2016,14(4):363-369.
[19] 王放.基于LC-HR-MSn的苦碟子及血栓通注射剂化学成分研究[D].北京:北京中医药大学,2014.
[20] 汪丹,蔡甜,吴志军,等.HPLC-ESI-Q-TOF-MS法分析金钱草颗粒的化学成分[J].中国药房,2016,27(12):1651-1654.
[21] SEO O N, KIM G S, PARK S, et al. Determination of polyphenol components of Lonicera japonica Thunb. using liquid chromatography-tandem mass spectrometry:Contribution to the overall antioxidant activity[J]. Food Chemistry,2012,134(1):572-577.endprint
