快速康复外科对胃癌患者腹腔镜术后免疫功能及营养状态的影响
2018-02-01朱代华唐云昊邹开鹏重庆医科大学附属第二医院胃肠外科重庆400010
肖 端,朱代华,唐云昊,邹开鹏(重庆医科大学附属第二医院胃肠外科,重庆400010)
根治性手术切除是胃癌患者得到治愈可能的唯一途径[1]。在传统开腹手术基础上,GOH等于1997年首次运用腹腔镜胃癌D2根治术治疗进展期胃癌,近20年来其疗效已得以证实并在各级医院普遍开展。有文献证实,腹腔镜手术能达到与开腹手术同等的淋巴结清扫效果,且从术中出血量、胃肠道功能恢复、下床活动时间及术后住院时间方面明显优于开腹组[2⁃3]。快速康复外科(FTS)是指采用具有循证医学证据的围手术期系列优化措施减轻患者术后应激反应,促进胃肠道功能恢复,缩短术后机体恢复时间。腹腔镜手术操作与FTS理念相结合既充分发挥了微创外科的系列特点,又体现了FTS的巨大优势。本研究旨在探讨快速康复外科在腹腔镜胃癌根治术后对机体免疫功能及营养状态的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析本院胃肠外科2015年7月至2017年5月收治的胃癌患者76例,均行全身麻醉下腹腔镜胃癌D2根治术,主刀者均为医疗组同一医生。纳入标准为:(1)术前经胃镜及相关病理检查明确诊断为胃癌;(2)术前胸腹部增强CT等检查无远处转移;(3)无严重器官功能障碍者;(4)术前无明显营养不良者。排除标准:(1)因各种原因中转开腹者;(2)术前行新辅助放、化疗者;(3)手术期间行胃或空肠造瘘者;(4)术前或术中输血者。根据治疗方式分为观察组(34例)和对照组(42例)。两组患者在性别、年龄、肿瘤大小及分期等方面比较,差异均无统计学意义(P>0.05)。见表1。本研究经本院医学伦理委员会批准,所有患者均对本研究知情同意并签署同意书。
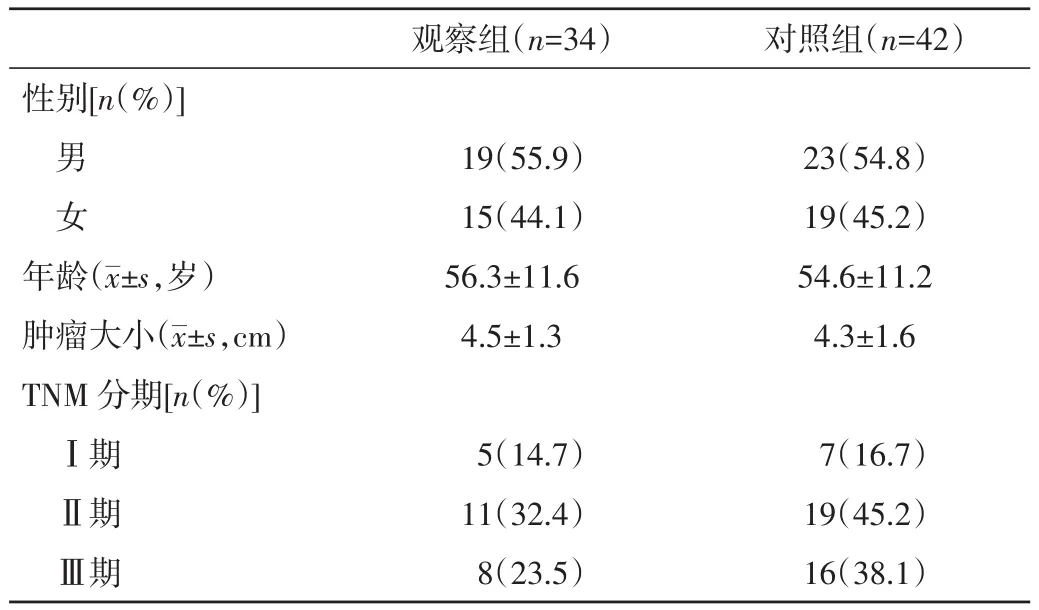
表1 两组患者一般资料比较
1.2 方法
1.2.1 围手术期处理方案 两组患者均接受同一组手术医生行5孔法腹腔镜D2胃癌根治术,对照组采用常规围手术期处理方案,观察组采用FTS围手术期处理方案。见表2。

表2 两组围手术期处理方案
1.2.1.1 常规围手术期处理方案 (1)术前告知病情;(2)术前1 d口服缓泻剂,避免胃肠道过量气体、粪便影响腹腔镜操作;(3)术前严格禁食 12 h,禁饮 4 h;(4)术前留置导尿管,于术后48 h去除;(5)术前留置胃管,术后第5天,经口少量饮水,未发现腹腔引流液浑浊、无腹胀、呕吐后,于术后6~7 d拔除;(6)术中、术后常规非控制性输液;不重视术中保温;(7)留置腹腔引流管2~3根,经口饮水后未发现明显吻合口瘘,腹腔引流液色淡、量少时拔除,约留置7 d;(8)术前30 min、手术开始3 h后及术后预防性应用头孢米诺3~5 d;(9)胃管拔除后允许进食,由流质饮食逐步过渡到进食普通食物;(10)患者根据自我耐受情况选择合适的活动方式;(11)患者疼痛呼叫时给予镇痛剂。
1.2.1.2 FTS围手术期处理方案 (1)术前营养评估,健康宣教及告知FTS处理方案。(2)不常规行术前肠道准备。(3)术前6 h禁食,术前2 h在护士指导下口服5%葡萄糖200 mL。(4)麻醉成功后留置导尿管,术后24 h拔除。(5)术前备导丝鼻胃管入手术室,根据胃腔的扩张与否决定是否行鼻胃管放置,扩张解除者复苏前拔除鼻胃管。(6)术中、术后控制性输液,维持血压、循环稳定情况下,尽量减少液体输注;重视术中保温。(7)减少腹腔引流管的放置,留置1~2根,3~4 d内拔除。(8)术前30 min、手术开始3 h后及术后预防性应用头孢米诺不超过24 h。(9)术后第1天,经口间断饮清流质200 mL,术后第2天根据患者情况增加清流质的摄入量;术后第3天,经口间断饮肠内营养制剂,并逐步过渡到半流质饮食。(10)患者清醒后便鼓励床上活动并嘱其早期下床活动,规定下床活动时间。(11)严格记录患者疼痛评分,按照评分给予镇痛。
表3 两组患者手术前后体液免疫学指标比较(±s,g/L)

表3 两组患者手术前后体液免疫学指标比较(±s,g/L)
注:与同组术前比较,aP<0.05
表4 2组患者手术前后的T细胞亚群指标变化(±s)

表4 2组患者手术前后的T细胞亚群指标变化(±s)
注:与同组术前比较,aP<0.05
表5 两组患者手术前后营养指标变化(±s,g/L)
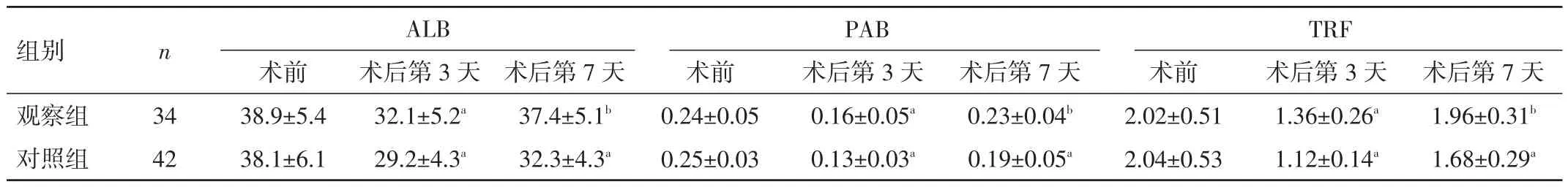
表5 两组患者手术前后营养指标变化(±s,g/L)
注:与同组术前比较,aP<0.05;与对照组同时间比较,bP<0.05
1.2.2 观察指标 于术前、术后3、7 d晨起空腹抽取外周静脉血,检测免疫球蛋白(IgG、IgA、IgM)、T细胞亚群(CD4+、CD8+)及血清清蛋白(ALB)、前清蛋白(PAB)、转铁清蛋白(TRF)水平。
1.3 统计学处理 采用SPSS24.0统计学软件进行分析,计量资料以表示,采用t检验;计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者手术前后体液免疫学指标比较 两组患者术前IgG、IgA、IgM水平比较,差异无统计学意义(P>0.05);术后第 3天,两组患者 IgG、IgA、IgM 3项指标均有不同程度的下降,但对照组下降更为明显,术后第7天观察组基本恢复至术前水平,但对照组仍明显低于术前,差异均有统计学意义(P<0.05)。见表3。
2.2 手术前后T细胞亚群指标比较 两组患者术前CD4+、CD8+、CD4+/CD8+水平比较,差异均无统计学意义(P>0.05);两组术后第 3 天 CD4+、CD8+、CD4+/CD8+水平较术前均降低,对照组降低更明显,差异均有统计学意义(P<0.05);术后第 7 天,观察组 CD4+、CD8+、CD4+/CD8+基本恢复至术前水平,而对照组仍低于术前,差异均有统计学意义(P<0.05)。见表 4。
2.3 两组患者手术前后营养指标变化 两组患者术前ALB、PAB、TRF水平比较,差异均无统计学意义(P>0.05);术后第3天均明显下降,术后第7天有所上升,且观察组术后第3、7天血清各指标水平均高于对照组,差异均有统计学意义(P<0.05)。见表5。
3 讨 论
肿瘤的发生、发展与机体的免疫功能密切相关,根据肿瘤免疫编辑理论,机体免疫功能低下是肿瘤发生发展的重要促进因素[4]。胃癌是我国的最常见的恶性肿瘤之一,死亡率居恶性肿瘤的第二位[5],相较结直肠癌患者的预后较差。有研究表明,胃癌患者的淋巴细胞、免疫球蛋白、补体及细胞因子均低于结直肠癌,可能与胃癌患者大都有明显的食欲减退、恶心、呕吐等影响营养物质的消化吸收有关[6]。有研究表明,营养不良对免疫系统的各个环节均有显著影响,营养不良使免疫功能受损,免疫功能受损则导致机体肿瘤抑制作用减弱,造成肿瘤术后出现转移复发[7],三者间形成恶性循环。所以营养不良及免疫功能低下势必影响患者的远期预后,因此,改善机体术后的营养状况及免疫功能对胃癌患者十分重要。腹腔镜胃癌根治术作为微创手术,相较传统开腹手术在减轻手术应激,保护免疫功能,缩短术后住院时间方面的优越性已有文献报道[8⁃9],在腹腔镜微创手术的基础上进一步的保护患者的免疫功能及改善术后营养状况是一个值得探讨的课题。2001年,丹麦“快速康复外科之父”KEHLET正式提出FTS理念,其是一系列有效措施的组合,其内容包括术前宣教,消化道准备,麻醉方式,术中操作,引流管放置,术后镇痛,早期肠内营养支持,早期活动等多个方面的处理流程,并需要结合患者自身实际制定个体化的操作方案。国内多个医疗中心的相关研究证实,将FTS运用于胃癌根治手术并没有增加术后并发症,提示FTS运用于胃癌外科是安全可行的[10]。
FTS强调术前宣教,并且贯穿整个围手术期,其内容包括详细告知患者病情及治疗措施,以及手术相关的风险及术后可能并发症及处理,特别强调与传统模式之间的差异,让患者及家属充分了解术前、术后各个环节及要求,缓解患者术前焦虑及恐惧感,减轻生理应激反应。术前宣教是FTS程序在治疗全程能顺利得以实施的重要环节。
研究表明,传统口服泻药及清洁灌肠等严格消化道准备并没有减少患者腹腔感染及吻合口瘘发生,相反,可能导致胃肠道组织水肿,以及患者水电解质和酸碱失衡,增加术后创伤应激的风险[11]。FTS强调短时间禁食,术后早期口服肠内营养液能有效促进消化液及胃肠激素的分泌,保护胃肠黏膜屏障功能,减轻肠道细菌及内毒素易位,从而保护及改善患者术后的营养状况及免疫功能。
RAMÍREZ等[12]研究证实,腹部手术限制补液感染的发生率要低于常规补液,可能与术后限制补液能减少白细胞介素 6(IL⁃6)、IL⁃10、肿瘤坏死因子 α(TNF⁃α)等炎性因子的分泌,从而降低术后感染的风险。术中体温的保持也是FTS重要的一环,术中低体温将导致复温过程中产生应激,损害凝血机制及白细胞功能,注意术中保温具有减少术中出血及术后感染,并且具有减轻术后的分解代谢、改善机体负氮平衡的意义[13]。
术后早期下床活动有利于促进全身血液循环,增加机体合成代谢,促进胃肠道功能的恢复,有效避免术后肠粘连及肠梗阻,减少下肢深静脉血栓发生的风险。术中及术后长时间放置胃肠减压管,腹腔引流管及尿管,有引起机体发热、肺不张和肺炎,破坏机体黏膜屏障及免疫稳态的可能[14],对于肠道内环境的平衡也有一定的影响,并且限制患者早期的下床活动。
本研究的结果显示,观察组术后第3、7天IgG、IgA、IgM、CD4+、CD8+、CD4+/CD8+水平均高于对照组,且第7天基本恢复至术前水平,而对照组仍显著低于术前,表明在FTS的实施下能有效保护并维持机体的免疫功能。机体抗肿瘤的免疫机制主要是细胞免疫,CD4+/CD8+反映机体细胞免疫水平的高低,比值降低说明免疫功能下降,且杀伤肿瘤的主要效应细胞是CD8+CTL,因而CD4+/CD8+及CD8+细胞水平的稳定能提高机体抗肿瘤的能力,抑制肿瘤的复发转移[15]。本研究还显示患者术后第3天血清ALB、PAB、TRF水平均明显下降,术后第7天有所上升,且观察组指标术后第3、7天明显高于对照组,提示FTS能有效改善患者术后的营养状态,从而维持机体正常的免疫功能。
有人强调FTS是继腹腔镜外科手术后的又一次外科革命,腹腔镜外科手术需要在FTS的理念下进行才能充分发挥微创外科的优势。本研究证实将符合条件的择期腹腔镜胃癌根治术患者纳入FTS路径能明显改善手术及围手术相关措施对患者免疫功能及营养状态的不良影响,改善机体术后的免疫功能,对增强术后患者抗肿瘤转移和复发的能力,改善远期预后具有积极的意义。
[1]季加孚,季鑫,步召德.进展期胃癌的综合治疗[J].临床外科杂志,2014(10):715⁃717.
[2]余佩武,钱锋,郝迎学,等.腹腔镜胃癌根治术726例的疗效分析[J].中华消化外科杂志,2011,10(1):44⁃47.
[3]丁杰,廖国庆,晏仲舒,等.腹腔镜与开腹D2远端胃切除术治疗胃癌的 meta分析[J].中国普通外科杂志,2013,22(4):401⁃408.
[4]MEDZHITOV R,JANEWAY CA.How does the immune system distin⁃guish self from nonself?[J].Semin Immunol,2000,12(3):185⁃188.
[5]罗盛,马峻岭,陈景武.恶性肿瘤死亡率地域分布的趋势面分析[J].中国卫生统计,2008,25(4):357⁃359.
[6]雷尚通,薛琪,石汉平.胃癌,大肠癌患者营养及免疫功能比较[J].中国普通外科杂志,2005,14(1):63⁃64.
[7]SHIMURA T,TOIYAMA Y,TANAKA K,et al.Angiopoietin⁃like pro⁃tein 2 as a predictor of early recurrence in patients after curative surgery for gastric cancer[J].Anticancer Res,2015,35(9):4633⁃4639.
[8]孙小飞,何子锐.腹腔镜与开腹根治术对进展期胃癌患者免疫及应激水平的影响[J].海南医学院学报,2016,22(22):2721⁃2723.
[9]张治国,薛慧婧,宋仕茂,等.腹腔镜根治术治疗胃癌的效果观察及其免疫功能和应激炎性因子的变化情况分析[J].胃肠病学和肝病学杂志,2015,24(6):724⁃727.
[10]姜志伟,黎介寿,李宁,等.胃癌患者运用加速康复外科治疗的安全性及有效性研究[J].中华外科杂志,2007,45(16):1314⁃1316.
[11]SUGISAWA N,TOKUNAGA M,MAKUUCHI R,et al.A phaseⅡstudy of an enhanced recovery after surgery protocol in gastric cancer surgery[J].Gastric Cancer,2016,19(3):961⁃967.
[12]RAMÍREZ JM,BLASCO JA,ROIG JV,et al.Enhanced recovery in colorectal surgery:a multicentre study[J].BMC Surg,2011(11):9.
[13]汪刘华,王道荣,鱼海峰,等.快速康复外科模式在腹腔镜胃癌根治术中的应用[J].中国现代普通外科进展,2012,15(6):444⁃446.
[14]ABRAHAM N,ALBAYATI S.Enhanced recovery after surgery pro⁃grams hasten recovery after colorectal resections[J].World J Gastroin⁃test Surg,2011,3(1):1⁃6.
[15]JOSEFOWICZ SZ,LU LF,RUDENSKY AY.Regulatory T cells:mecha⁃nisms of differentiation and function[J].Annu Rev Immunol,2012(30):531⁃564.
