叶酸修饰新藤黄酸泡囊对人肝癌HepG2细胞增殖及凋亡作用研究
2018-01-31常佳丽方清影张变陈凯云余琼芳彭代银王飘飘陈卫东
★ 常佳丽 方清影 张变 陈凯云 余琼芳 彭代银 王飘飘 陈卫东
(1.安徽中医药大学药学院 合肥 230012;2.安徽中医药大学药物代谢研究所 合肥 230012;3.安徽省中医药科学院 合肥 230012;4.安徽道地中药材品质提升协同创新中心 合肥 230012)
肝癌作为常见恶性肿瘤之一,发病率和死亡率逐年上升,严重威胁人类生命安全[1-2]。因此研发一种抗癌疗效强,毒副作用小的抗癌药物具有重要的意义。研究发现新藤黄酸(gambogenic acid,GNA)能特异性抑制肝癌细胞HepG2的增殖,诱导其凋亡,具有治疗肝癌的潜力[3]。GNA是从中药藤黄中提取出来的有效成分,具有抗瘤谱广,毒性较低的特点,有望成为新的抗肿瘤药物[4]。
但是GNA水溶性差,体内消除快,半衰期非常短,血管刺激性大,从而制约了GNA的开发和临床应用[5]。泡囊是由非离子表面活性剂在水性介质中形成的单层或多层双分子结构的药物载体,既可以包裹亲水性药物,又可以包裹疏水性药物。其具有安全、稳定,可减小药物副作用,提高药物在体内循环时间,改善药物生物利用度,表面可以进行修饰等优点,已在多种药物载体得到应用[6]。而近年来,靶向制剂掀起一股热潮,引起了广泛关注。叶酸受体(Folate recptor,FR)[7]是一种糖基化磷脂肌醇连接的膜糖蛋白,在肿瘤细胞表面高度表达并有较高的活性,在正常组织表达很少。同时叶酸( folic acid,FA)[8]无毒,稳定,免疫原性低,与叶酸受体有高度亲和性,故利用叶酸配体-受体特异性结合来靶向输送药物,可以特异性治疗恶性肿瘤。本课题组为改善GNA缺陷,提高抗肿瘤作用,将其制备成泡囊并用叶酸进行修饰,且在前期已成功制备,做了相关表征,包封率在80%以上,载药量10%左右,粒径在180nm左右,形态观察大小均一圆整,均符合药用要求。故本实验在课题组前期基础上继续相关研究,本文以人肝癌HepG2细胞为研究对象,探索叶酸修饰新藤黄酸泡囊对HepG2细胞的增殖抑制作用及凋亡作用。
1 材料
1.1 药物及试剂 新藤黄酸(黄色干燥粉末,纯度>99.0%,由安徽中医药大学新藤黄酸课题组提供);FA-GNA-NISVs、GNA-NISVs(实验室自制);RPMI1640培养液(江苏凯基生物公司);MTT(美国Sigma公司);二甲亚砜(天津灏洋生物公司产品);胰蛋白酶(美国Sigma公司);Annexin V-FITC/PI凋亡试剂盒(上海BestBio-贝博生物);PBS(pH7.2~7.4)(实验室自制);其他试剂均为分析纯。
1.2 细胞 人肝癌细胞株HepG2来于中国科学院上海细胞所。
1.3 仪器 ELX800uv酶标仪(Bio-TEK公司);ES-315高压灭菌锅(日本Tomy KOQYO公司);干燥箱(SHANGHAI BOXUN);371型CO2培养箱(Germany);BHC-1300IIA/B2超净工作台(苏净集团安泰公司);FACS Calibur流式细胞仪(美国Becton Dickinson公司);光学倒置显微镜(上海长方光学仪器有限公司);AB135-S 电子分析天平(德国METTLER TOLEDO公司);TDL-5离心机(德国EPPENDORF公司);75cm2培养瓶(美国Corning公司);96及6孔培养板(美国Corning公司)。
2 方法
2.1 细胞培养和传代 接种HepG2 细胞于培养瓶中,用含10%胎牛血清的RPMI 1640培养基培养,并置于 37 ℃、5% CO2培养箱,相对饱和湿度的条件下生长,每天观察细胞生长状况,待细胞贴壁生长至80%~90%的密度时,胰酶消化后传代,周期为2-3天。
2.2 对HepG2 细胞的增殖抑制作用 取对数生长期的HepG2 细胞,用0.25%胰蛋白酶消化后,加入培养基终止消化,1000rpm离心5min,稀释一定倍数制成细胞悬液,按5×104个/cm2密度将细胞接种到96孔细胞培养板中,每孔100μL,置于细胞培养箱中培养24h贴壁后,分别加入不同质量浓度的GNA溶液,GNA-NISVs溶液和FA-GNA-NISVs溶液各100μL(配药时用不完全培养基),使其最终浓度为0.2,1,4,6,8,10,16μg/mL,空白制剂组各浓度按FA-GNA-NISVs组同等稀释,各实验组设6个复孔,另设不含药物孔作药物组阴性对照,培养基(无细胞)作调零孔。24h后每孔加入5mg/mL的MTT溶液20μL,继续培养3.5~4.0h,弃去上清液,加入二甲基亚砜(DMSO)150μL,振荡15min,待蓝色结晶完全溶解后,用酶标仪在波长490nm处测量吸光度。然后计算药物对细胞的抑制率。抑制率IR%=(阴性对照组OD值-实验组OD值)/阴性组OD值×100%。
2.3 对HepG2 细胞形态的影响 0.25%胰蛋白酶消化对数生长期的细胞,离心,配成细胞悬液后接种于6孔细胞培养板中(5×104),37℃、5%CO2培养箱中培养过夜,至细胞贴壁生长成单层后加入培养基稀释的GNA、FA-GNA-NISVs与GNA-NISVs,终浓度均为8μmol/L。培养箱中继续培养24h后,倒置显微镜下观察,并拍摄照片。
2.4 对HepG2 细胞凋亡实验 HepG2 细胞以细胞数为2×105个细胞接种于六孔板中,培养箱中培养,待细胞完全贴壁后,弃去原培养液,PBS清洗两遍。分别加入培养基稀释的GNA、GNA-NISVs、FA-GNA-NISVs(浓度分别为4μg/mL,8μg/mL)作为给药组,另设空白对照组(不含药物),平行3组。在37℃、5%CO2条件下继续孵育24h,收集原含药培养液,PBS洗两遍,收集,加入0.5mL不含EDTA的胰蛋白酶消化细胞,待消化完全,加入培养基终止消化,吹打混匀,转入离心管内2000rpm离心5min,弃去上清。加入预冷的PBS混悬,离心弃去上清,重复两次,收集细胞,用0.5mL的结合缓冲液重悬细胞,转入1.5mL EP管中,加入5μL的Annexin-V/FITC冰浴下避光孵育15min,再加入10μL的PI染色,充分混匀,继续孵育5min,最后转入流式管内,上流式细胞分析仪检测。

3 结果
3.1 对HepG2 细胞的增殖抑制作用 MTT试验表明,GNA对HepG2细胞有明显的抑制效应,表现出较强的细胞毒性,且呈剂量依赖性。将GNA制备成泡囊后,对细胞的抑制率有所提高,并有显著性差异(P<0.05),而空白载体对细胞几乎没有毒性。叶酸修饰组与未修饰组相比,叶酸修饰后的新藤黄酸泡囊显著抑制了HepG2细胞的增殖,且与另外两组比较差异有显著性意义(P<0.05)。详细见图1(GraphpPad Prism6.02拟合)。经SPSS17.0拟合IC50得出FA-GNA-NISVs的IC50值为1.701μg/mL,分别是GNA-NISVs和GNA Solution的1/3、1/5左右,见表1。再一次证明叶酸修饰的新藤黄酸非离子表面活性剂泡囊,增加了对肿瘤细胞的抑制效应,具有明显的受体靶向作用和细胞杀伤性。
3.2 对HepG2 细胞形态的影响 倒置显微镜下观察细胞(见图2),可明显看出,空白组细胞贴壁生长良好,呈梭形或不规则形,给药组细胞多呈现变圆固缩状态,透亮度变差,且有大量死细胞漂浮,出现明显的凋亡趋势。给予相同浓度的不同实验组显示出,原料药组细胞变圆不明显,而FA-GNA-NISVs处理过的细胞凋亡趋势较为显著,活细胞数量明显较少,且倒置显微镜下观察漂浮有大量死细胞。
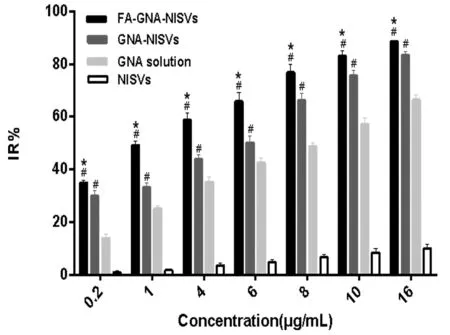
注:与GNA游离药组比较,#P<0.05;与GNA-NISVs组比较,*P<0.05。
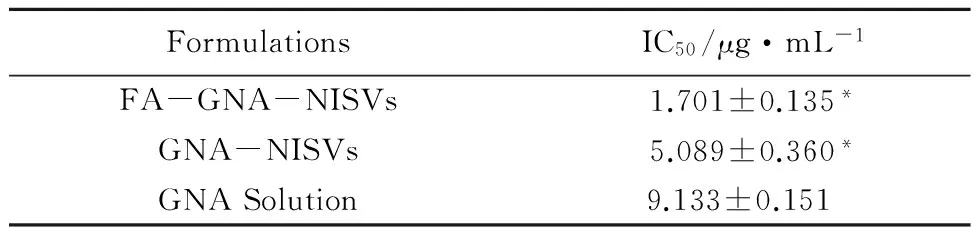
Formulations IC50/μg·mL-1FA-GNA-NISVs 1.701±0.135*GNA-NISVs 5.089±0.360*GNASolution9.133±0.151
注:与GNA Solution组比较,*P<0.05。

1.空白对照组;2.新藤黄酸游离药8μg/mL;3.非叶酸修饰新藤黄酸泡囊8μg/mL;4.叶酸修饰新藤黄酸泡囊8μg/mL;
3.3 对HepG2 细胞凋亡实验 正常细胞和早期凋亡的细胞膜是完整的,Propidium iodide (PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡晚期的细胞和坏死细胞,PI能透过细胞膜和细胞核结合而呈现红色,故将Annexin V与PI匹配使用,可以将凋亡早期的细胞和晚期细胞及坏死细胞区分开。流式结果显示,与空白对照组相比,药物干预24h后,细胞成活率明显降低。当给予4μg/mL的各组药物时,FA-GNA-NISVs组显示了较高的凋亡率,早期凋亡及晚期凋亡都明显增加,说明叶酸修饰后的GNA泡囊可提高诱导凋亡的能力。相比于4μg/mL药物组,当浓度增加一倍时,细胞却呈坏死趋势,且FA-GNA-NISVs诱导坏死细胞最多。
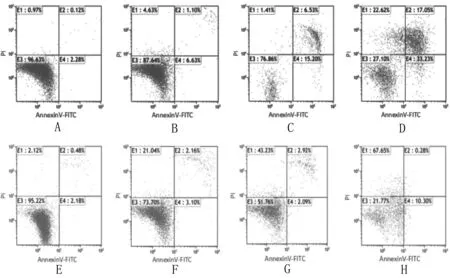
A.空白对照组;B.新藤黄酸游离药4μg/mL;C.非叶酸修饰新藤黄酸泡囊4μg/mL;D.叶酸修饰新藤黄酸泡囊4μg/mL;E.空白对照组;F.新藤黄酸游离药8μg/mL;G.非叶酸修饰新藤黄酸泡囊8μg/mL;H.叶酸修饰新藤黄酸泡囊8μg/mL
4 讨论
泡囊是类似于脂质体的新型药物载体,其成膜材料生物相容性好、易降解、安全无害,用来运载药物具有选择性高、缓释的优势[9]。再利用叶酸配体修饰药物载体表面,可达到抗癌药物的主动靶向输送[10]。叶酸修饰泡囊运载药物治疗癌症时可运输药物到达肿瘤细胞表面,因此可减少药物的给药剂量,降低药物毒副作用,提高药物抗肿瘤作用。
Fenggen Yan[11]发现新藤黄酸能抑制HepG2细胞增殖,诱导其凋亡,且凋亡机制与Phospho-Erk1 / 2和Phospho-p38 MAPK在HepG2细胞中的蛋白表达变化有关。课题组研制出叶酸修饰新藤黄酸泡囊新剂型,研究其对HepG2细胞体外药效。MTT试验表明FA-GNA-NISVs对肝癌HepG2细胞抑制作用显著,抑制率也明显高于其它组,且呈现出良好的量效关系。AnnexinV-FITC/PI双染检测细胞凋亡,在两个剂量浓度下FA-GNA-NISVs均呈现较高的凋亡率和死亡率,提示药物抑制细胞增殖主要通过诱导细胞凋亡及坏死导致,表明修饰后的药物包载小剂量的药物即可达到抗肿瘤效果。但流式实验中我们发现了细胞呈两种不同形式的细胞死亡状态,在低剂量下,细胞主要呈凋亡式死亡,高剂量时,细胞坏死比较明显。细胞凋亡和坏死一般是细胞死亡的两种不同形式,且在发生机制、形态上、过程和结局上都有着明显的不同,但两种在某些状态下有一定的相关性,细胞凋亡在一定条件下可转化为细胞坏死[12]。本文出现这种现象可能是由于药物剂量较大时,激活了诱导细胞坏死的某种程序,从而引发细胞坏死。
但无论细胞以哪一种状态死亡,叶酸修饰组的细胞存活率都明显低于其它组,显示出一种优良的抗肿瘤疗效,增加了对肿瘤细胞的主动靶向的能力。但具体的凋亡及坏死机制尚不明确,本课题后期也将对GNA溶液、GNA-NISVs和FA-GNA-NISVs诱导HepG2细胞凋亡及坏死的具体路径及机制,对实体肿瘤的抗癌效应等进一步探讨。
[1]张炜,崔恩海.石蒜碱诱导肝癌HepG2 细胞凋亡作用研究[J].中国中药杂志,2015,40(16):3 278-3 282.
[2]谢斌,曹建国,周志愉,等.破血逐瘀中药虻虫对荷H22 肝癌小鼠免疫功能及细胞凋亡的影响[J].江西中医药大学学报, 2016, 28(5):75-78.
[3]刘卫海,肖国丽,赖小平,等.新藤黄酸诱导HepG2细胞凋亡与Bax及Bcl-2的关系[J].中国药理学通报, 2012,28(3):439-440.
[4]Yuan H, Li X, Zhang C, et, al. Nanosuspensions as delivery system for gambogenic acid:characterization and in vitro/in vivo evaluation[J].Drug Deliv, 2016,23(8):2 772-2 779.
[5]Luo Q, Lin T, Zhang CY, et, al. A novel glyceryl monoolein-bearing cubosomes for gambogenic acid:Preparation, cytotoxicity and intracellular uptake[J].Int J Pharm, 2015, 493(1-2): 30-39.
[6]Balakrishnan P , Shanmugam S, Lee WS, et, al. Formulation and in vitro assessment of minoxidil niosomes for enhanced skin delivery[J]. Int J Pharm, 2009, 377(1-2):1-8.
[7]Chen C, Ke J, Zhou XE, et, al. Structural basis for molecular recognition of folic acid by folate receptors[J]. Nature, 2013, 500(7463):486-489.
[8]Liu MC, Lin L, Wang XR, et, al. Folate receptor-targeted liposomes loaded with a diacid metabolite of norcantharidin enhance antitumor potency for H22 hepatocellular carcinoma both in vitro and in vivo[J].Int J Nanomedicine, 2016(11):1 395-1 412.
[9]Abidin L, Mujeeb M, Imam SS, et al. Enhanced transdermal delivery of luteolin via non-ionic surfactant-based vesicle: quality evaluation and anti-arthritic assessment[J].Drug Deliv, 2016, 23(3):1 079-1 084.
[10]Mohammadi M, Li Y,Abebe DG, et , al. Folate receptor targeted three-layered micelles and hydrogels for gene delivery to activated macrophages[J].J Control Release, 2016, 244(Pt B): 269-279.
[11]Yan F, Wang M, Li J, et, al. Gambogenic acid induced mitochondrial-dependent apoptosis and referred to Phospho-Erk1/2 and Phospho-p38 MAPK in human hepatoma HepG2 cells[J]. Enviro Toxicol Pharmacol, 2012, 33(2):181-190.
[12]刘发全.细胞坏死的研究近况[J].国外医学、生理、病理科学与临床分册,2003, 23(6):618-620.
